Br∅nsted酸性离子液体催化合成乙酸丁酯的化学动力学研究:一个物理化学综合实验
张海波 丁琼 谢音
(武汉大学化学与分子科学学院 湖北武汉430072)
化学反应速率是化学反应进行的快慢程度(平均反应速率),用单位时间内反应物或生成物的物质的量来表示。影响化学反应速率的因素有很多,例如反应物浓度、反应温度、反应介质、催化剂、光效应、反应物颗粒大小、多相反应中反应物的接触面积及各物质的扩散速率等。化学反应本身的速率只与反应组分的浓度、温度以及催化剂和溶剂的种类有关。乙酸丁酯的合成在有机化学实验中是一个比较经典的酯化反应[1],但以前都是以浓硫酸作为催化剂,且用量较大(n(硫酸):n(醋酸)=0.1:1~1:1)[2]。实验发现硫酸作为催化剂存在如下缺点:①加料时速度要慢,否则易使体系温度升高,使丁醇挥发,导致收率降低;这无疑会延长实验时间。②由于浓硫酸同时具有酯化、氧化、脱水等作用,酯化的同时易导致醚化等副反应;若局部过热,硫酸还可使有机溶剂碳化,不仅会导致收率降低,还会给产品的精制带来许多麻烦。③因浓硫酸具有强腐蚀性,如操作不慎,易被烧伤,安全性较差[3]。除了硫酸以外,许多固体酸也可作为催化剂合成乙酸丁酯,但在化学实验教学中并不使用。
离子液体(ionic liquids)是完全由离子组成的液体,是低温(<100℃)下呈液态的盐,也称为低温熔融盐,它一般由有机阳离子和无机阴离子所组成。离子液体是一种新型的溶剂和催化剂[4],对有机、金属有机、无机化合物有很好的溶解性。由于离子液体几乎没有蒸气压,可以用于高真空下的反应;同时离子液体又无味、不燃,在作为环境友好的溶剂方面有很大的潜力。离子液体具有极性,可溶解作为催化剂的金属有机化合物,替代对某些金属具有强配位能力的极性溶剂如乙腈等。溶解在离子液体中的催化剂同时具有均相和非均相催化剂的优点,使催化反应有高的反应速率和高的选择性,产物可通过静止分层或蒸馏分离出来;留在离子液体中的催化剂可循环使用。随着离子液体化学的发展,在离子液体中开展酯化反应的研究也迅速展开。与常规方法相比,离子液体中的酯化反应速率快,转化率高,同时离子液体还可以循环使用。近年来,离子液体作为一种酯化反应的全新催化剂受到了人们的极大关注,并有希望成为传统催化剂的替代品[5]。在实验教学中几乎还没有涉及离子液体的实验,将这一研究内容引入本科物理化学实验,可以使学生较早地接触前沿科学,更好地了解现代化学的发展方向,有利于高素质人才的培养。
1 实验目的
①了解离子液体的含义及其在酯化反应中的应用。
②熟悉Br∅nsted酸性离子液体的制备方法。
③熟悉化学反应动力学的常用研究手段。
2 实验原理
假设此反应方程为[5]:
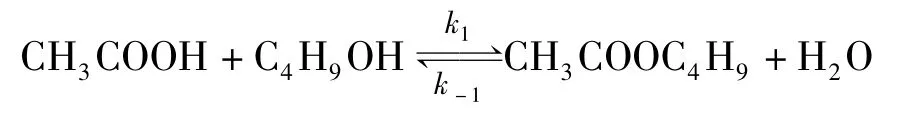
其中k1、k-1分别为正、逆反应速率常数,此过程的正、逆反应都是二级反应。则速率方程式为:
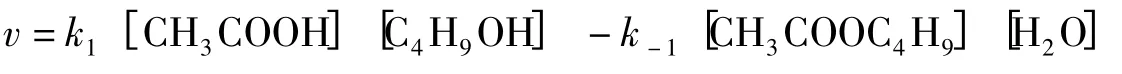
若乙酸与丁醇的初始浓度c0相同,则速率常数为:

平衡常数:

式中k1为正反应速率常数(L·mol-1·min-1);k-1为逆反应速率常数(L·mol-1·min-1);ce为平衡时的醋酸浓度降低量(mol·L-1);c0为醋酸的初始浓度(mol·L-1);t为反应时间(min);cx为产物某时刻t时的浓度(mol·L-1);K为平衡常数;α=(1/K)1/2。
已知初始浓度c0,只要由实验测得不同时刻t时的cx,就可以由式(1)、式(3)算出不同时刻t时的正反应速率常数k1值和平衡常数K;逆反应速率常数k-1可根据式(2)求得。如果k1和K均为常数,就可以证明该反应的正、逆反应都是二级反应。
不同时刻生成物乙酸丁酯的浓度可用化学分析法测定(例如用标准酸滴定反应液中的OH-),也可以用仪器分析法测定(如气相色谱)。本实验采用气相色谱法测定反应混合物的峰面积,经面积归一化和校正因子处理得到各组分的组成。
根据Arrhenius公式[6]计算该反应的活化能,有:

式中Ea为反应的活化能(J·mol-1);R为气体通用常数(8.314J·mol·K-1);T为热力学温度(K)。若温度变化范围不大,Ea可看作常数,则有:

式中A为指前因子。将温度和正逆反应的速率常数代入上式,以lnk对1/T作图应得一直线,斜率为-Ea/R,由此可求得Ea。
3 实验仪器及药品
仪器:250mL三口圆底烧瓶、球形冷凝管、滴液漏斗、温度计、恒温磁力器、SP-6890型气相色谱仪(山东鲁南化工仪器厂,采用热导检测器)、N2000气相色谱工作站(浙大智达有限公司)、微量注射器5.0μL。
药品:丁醇、冰醋酸、甲基吡咯烷酮、甲磺酸(上述试剂均为分析纯)、Br∅nsted酸性离子液体(自制)。
4 实验过程
①Br∅nsted酸性离子液体甲基吡咯烷酮甲磺酸盐的合成:将0.2mol N-甲基吡咯烷酮加入到带有搅拌磁子的100mL圆底烧瓶中,在冰水浴中搅拌,缓慢滴加0.2mol甲烷磺酸,加料完毕后,逐步升温至50℃,搅拌反应2小时。在滴加酸过程中,有白雾产生,搅拌过程中反应物逐渐变成透明澄清液,最后冷却至室温,成透明液体,即得Br∅nsted酸性离子液体甲基吡咯烷酮甲磺酸盐。
②在一个250 mL三口圆底烧瓶中依次加入60.05g(1.0mol)醋酸、74.12g(1.0mol)正丁醇、0.99g(0.005mol)离子液体作为催化剂,在三口圆底烧瓶中间出口安装回流冷凝管,一个侧口连接温度计,另一侧口为采样口,使用磁力搅拌,反应温度由恒温油浴控制。当反应温度升高至所需温度时开始计时,保持温度恒定(±0.5℃)。每间隔一定的时间,从三口瓶中取样进行气相色谱分析。
③气相色谱定量分析方法:在反应过程中,用微量进样器定时从反应体系中取出微量样品进入气相色谱作组分分析。通过色谱柱的分离作用,将反应混合体系中的原料乙酸、丁醇,产物乙酸丁酯、水分别分离,并在流动相的带动下依次经过热导检测器,得到各组分的出峰时间及峰面积。各组分依照相对分子质量大小分别流出。最小的水最先出峰;最大的乙酸丁酯的出峰时间最长,色谱峰在最后。由于各个反应组分的导热系数不同,色谱分析所得到的色谱峰与物质在反应混合体系中的真实质量分率也不同,需通过相应的校正因子校正后得到相应组分在体系中的质量分率。在色谱分析中,由于不同气相色谱仪结构不同,且操作条件(包括色谱柱温、载气流速、固定相种类及填充密度等)也不同,导致文献所查得的校正因子与实际值存在一定的偏差。因此我们利用色谱纯的标样,用面积归一化法算出本实验中的各组分在气相色谱分析中的相对质量校正因子。(以丁醇为参考物质,分别测得乙酸-丁醇、水-丁醇、乙酸丁酯-丁醇的相对校正因子。)
在不同温度下作多次比较实验,可确定反应级数,求得相应温度下的速率常数、平衡常数和活化能,并得出酯化反应随温度变化的规律。
5 结果与讨论
5.1 速率常数
按实验过程进行实验,测定出不同温度下不同催化体系的产物乙酸丁酯的浓度。乙酸和丁醇的初始浓度为c0=6.589(mol·L-1),按式(3)可计算出平衡常数K,由式(1)可计算出k1,再根据式(2)可求出k-1,相关数据和结果列于表1和表2。
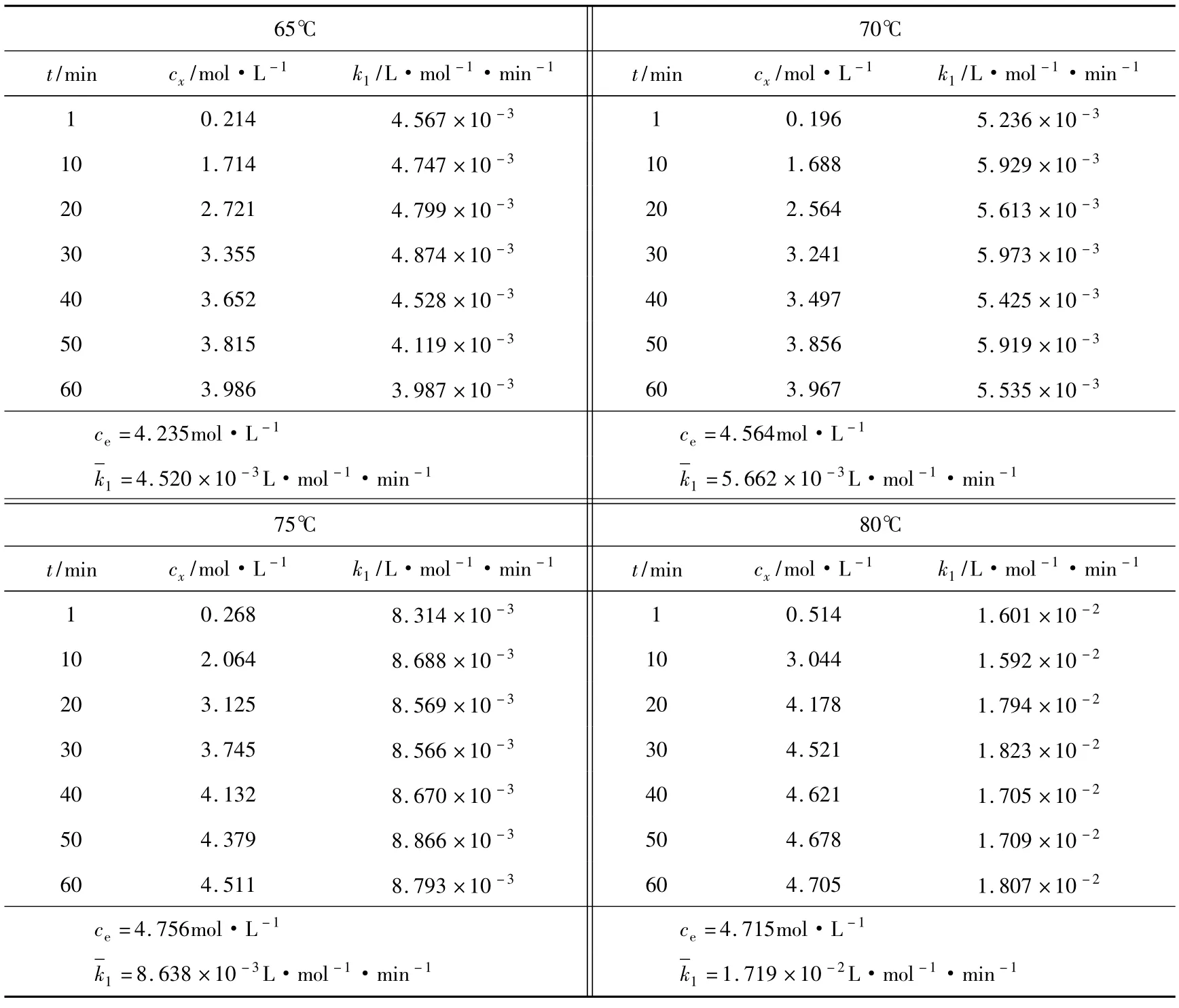
表1 不同温度下离子液体催化合成乙酸丁酯的反应速率常数

表2 不同温度下的正、逆反应速率常数和反应平衡常数
如果式(1)所示的动力学方程正确,则k1t对t作图应为一条直线。直线斜率即反应的正反应速率常数k1,不同温度下k1t对t的变化关系见图1。由图1知,各温度下k1t对t作图均为一条直线,表明实验数据符合拟合模型,从而证明了所得动力学模型可准确地描述反应的特征。
5.2 活化能计算
根据Arrhenius关系式,当温度变化范围不大,Ea可近似看作常数,,以lnk对1/T作图应得一直线,斜率为-Ea/R,则可得出Ea。将温度与正、逆反应的速率常数代入上面关系式,然后用Origin软件将lnk1或lnk-1对1/T作图,可分别求出正逆反应的活化能(图2)。
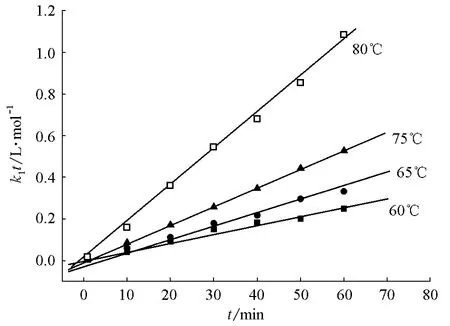
图1 不同温度下k1t对t的变化关系
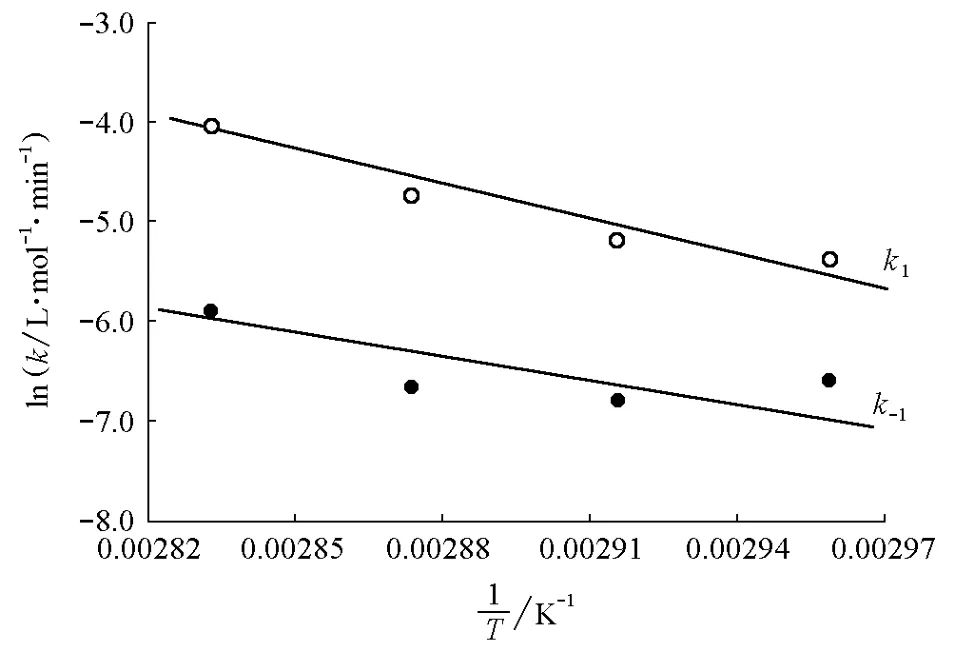
图2 lnk1(或lnk-1)对1/T的变化关系
正反应的直线方程为ln(k1)=25.38-10.28×103/T,线性相关系数R=-0.913,由此求得正反应的活化能=85.49kJ·mol-1,指前因子A1=1.04×1011L·(mol·min)-1;逆反应的直线方程为ln(k-1)=19.24-8.733×103/T,R=-0.851,由此求得逆反应的活化能=72.61kJ·mol-1,指前因子A-1=2.268×108L·(mol·min)-1。反应热效应ΔrHm为正逆反应活化能(E+与E-)之差,即ΔrHm=E+-E-=(85.49-72.61)kJ·mol-1=12.88kJ·mol-1。按文献方法计算得到的该反应的热效应Δr为15.98 kJ·mol-1[7],表明实验值与计算值比较接近。
5.3 反应机理探讨
酯化反应是亲核取代反应,是典型的酸催化反应,催化剂酸的强度对反应会产生较大影响。以乙酸丁酯为例,反应机理为两个阶段:①酸性催化剂质子化乙酸的羰基,并使其吸电子能力进一步增强,更易受到亲核试剂丁醇的进攻,丁醇进攻羰基后,失去一个质子后生成水合乙酸乙酯;②水合乙酸丁酯上的任一羟基质子化,脱去一分子水,再从第二个羟基上失去一个质子生成乙酸丁酯[8]。以上动力学实验结果表明,Br∅nsted酸性离子液体催化该反应的正、逆反应均为二级反应,类似于浓硫酸催化酯化时的动力学。由于Br∅nsted酸性离子液体具有与浓硫酸类似的酸性,在反应中可以理解为以质子酸的形式起催化作用。因此,其催化乙酸/正丁醇的酯化反应机理可认为是Br∅nsted酸性离子液体提供的H+先与乙酸分子中的羰基氧结合,使羧基的碳有更高的亲电性,更有利于亲核试剂丁醇的进攻发生亲核反应;然后质子化了的羧酸分子与醇分子作用后发生质子转移,最后经重排消除水、再消除质子等步骤而转化为酯分子。在研究中也发现,当离子液体用量加大(10%~50%),由于离子液体与产物酯的互溶性不好,反应结束时产物与离子液体可自动分层,酯收率也提高,此时酯化反应动力学将有所不同,其反应机理也会不同[8]。
6 结论
从实验可看出,反应速率常数表现出良好的恒定性,lnk1对1/T作图为直线,lnk-1对1/T作图也为直线,所以可验证假设的速率方程成立,该反应为二级可逆反应。温度升高,速率常数增大。正反应方向的表观活化能为85.49kJ·mol-1;逆反应方向的表观活化能为72.61kJ·mol-1;故反应为吸热反应,且正反应的表观活化能大于逆反应的表观活化能。
7 思考题
①与浓硫酸比较,离子液体催化酯化反应有什么优势?
②催化剂的特征有哪些?催化剂可以改变化学平衡吗?
③根据实验结果写出该反应的动力学方程?
④讨论温度对该反应的平衡及动力学的影响规律。
[1]曾昭琼.有机化学实验.第3版.北京:高等教育出版社,2000
[2]张国安.陈伟红.张剑.化学世界,1993,34(11):542
[3]米远祝.王辉.湖北民族学院学报(自然科学版),2002,20(1):89
[4]邓友全.离子液体——性质、制备与应用.北京:中国石化出版社,2006
[5]Zhang H,Xu F,Zhou X,et al.Green Chemistry,2007,9:1208
[6]胡英.吕瑞东.刘国杰.物理化学(上册).第5版.北京:高等教育出版社,2007
[7]艾尔沃德·芬德利.SI化学数据表.周宁怀译.北京:高等教育出版社,1985
[8]Xu F,Chen H,Zhang H,et al.Journal of Molecular Catalysis A:Chemical,2009,307(1-2):9

