叶酸代谢基因多态性与出生缺陷的关系
罗丽,陈岳明,王贤军
出生缺陷(birth defects)是指婴儿出生前发生的身体结构、功能或代谢异常。随着我国全民医保制度的建立,医疗技术水平的明显提高,孕产妇及新生儿死亡率明显降低,但出生缺陷问题逐渐凸显。卫生部发布的《2012年中国出生缺陷防治报告》指出,我国每年新增出生缺陷人数约90万[1]。叶酸在DNA合成、甲基化、生长发育和基因表达等方面发挥重要作用。现就叶酸来源及代谢途径、代谢相关基因多态性与出生缺陷相关疾病的关系进行系统回顾。
1 叶酸来源及代谢途径
人类食入的叶酸为叶酸多聚谷氨酸,需在空肠黏膜刷状缘被水解为叶酸单聚谷氨酸,方能入血[2]。进入全身循环的5-甲基四氢叶酸单聚谷氨酸在细胞膜还原型叶酸载体-1(reduced folate carrier-1,RFC-1)作用下进入细胞,进行胞内叶酸循环代谢,见图1。由图1可知亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)为胞内叶酸代谢的关键酶,其将5,10-亚甲基四氢叶酸(5,10-methylenetetrahydrofolate,5,10-MTHF) 转化为5-甲基四氢叶酸(5-methyl tetrahydrofolate,5-MTHF),为体内合成代谢提供甲基。在甲硫氨酸合成酶(methionine synthase,MTR)和依赖维生素B12的甲硫氨酸合成还原酶(methionine synthase reductase,MTRR)共同作用下5-MTHF转化为四氢叶酸(tetrahydrofolate,THF),而相应同型半胱氨酸(homocysteine,Hcy)转化为甲硫氨酸(Methionine,Met)。当MTHFR酶活性降低,5-MTHF生成减少,同型半胱氨酸转化率降低,体内同型半胱氨酸堆积;DNA、蛋白质、脂质甲基化不足,染色体不稳定,影响机体合成代谢,导致疾病发生[3]。
2 叶酸代谢酶及其编码基因多态性
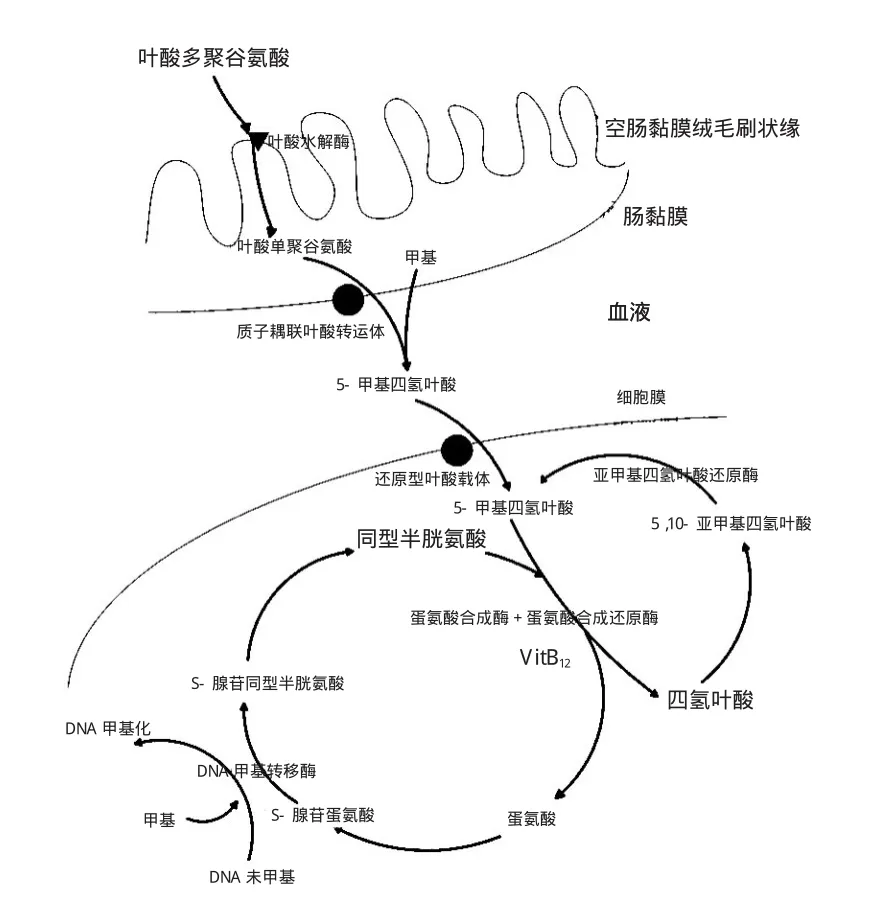
图1 叶酸吸收代谢途径
参与叶酸代谢的酶有RFC-1、MTHFR、MTR、MTRR、FOLH1、PCFT、叶酸受体(folate receptor,FR)、胱硫醚β合酶(cystathionine-beta-synthase,CBS)、转钴氨素蛋白(transcobalamin,TC)等,其途径中某些酶基因位点变异可能会影响循环中叶酸水平。
2.1 MTHFR MTHFR是叶酸代谢的关键酶,基因定位于人类染色体1p36.3处,编码656个氨基酸,相对分子质量45,基因组全长15835 bp,包括11个外显子和10个内含子,外显子长度为99~252 bp,内含子长度为192~981 bp[4]。其氨基酸序列高度保守,90%与鼠MTHFR同源。MTHFR有许多位点变异,研究最多的位点是677C>T和1298A>C变异。MTHFR 677位点位于第4外显子上,该位点变异使胞嘧啶(C)被胸腺嘧啶(T)取代,导致丙氨酸变为缬氨酸。1298位点位于第7外显子,该位点变异使腺嘌呤(A)被C取代,则相应谷氨酸被丙氨酸替换。这些位点变异导致酶活性及热稳定性降低,阻碍5,10-MTHF转化为5-MTHF,体内同型半胱氨酸堆积以致高同型半胱氨酸血症、高同型半胱氨酸尿及低Met血症。同型半胱氨酸转化为Met障碍,使得甲基直接供体S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)生成减少,体内DNA、蛋白质、脂质甲基化不足影响机体合成代谢及造成染色体不稳定。
2.2 MTR MTR是维生素B12依赖性酶,在同型半胱氨酸再甲基化为Met过程中发挥重要作用。基因定位于染色体1q43处,全长105.2 kb,编码1265个氨基酸,mRNA全长7122个核苷酸(nt),有33个外显子和32个内含子[5]。同型半胱氨酸结合在第1~12外显子区域,5-MTHF结合在第13~18外显子区域,维生素B12辅基结合在第19~25外显子区域,26~33外显子区为MTR活性区域。该基因2756位点A被鸟嘌呤(G)替代,导致天冬氨酸转化为甘氨酸。MTR 2756A>G变异致使酶活性降低,同型半胱氨酸转化为Met障碍以及高同型半胱氨酸血症。
2.3MTRR MTRR协同维生素B12维持MTR的还原活性,参与体内同型半胱氨酸-Met循环。此酶基因定位于染色体5p15.2~15.3处,基因组全长32021 kb,mRNA长3274 nt,含15个外显子和14个内含子,编码726个氨基酸。第2外显子上66位点A被G取代,则相应的异亮氨酸转化为Met[6]。MTRR 66A>G变异不能维持MTR活性,可协同MTR 2756A>G阻碍体内同型半胱氨酸转化为Met,致同型半胱氨酸增高。
2.4 RFC-1 RFC-1并不直接参与叶酸代谢,却是5-MTHF转运入细胞内的主要机制。该基因定位于染色体21q22.2~22.3处,其基因组全长22.5 kb,由80~120 ku编码整个膜蛋白。有8个外显子,包括5个原始外显子和3个选择性表达的外显子1(即外显子1a、1b、1c)[7]。RFC-180位点A替换为G,导致精氨酸被组氨酸取代。Dufficy等[8]研究表明叶酸转运入细胞的量与G等位基因呈负相关,RFC-180G等位基因与低叶酸水平一致,但与同型半胱氨酸增高并不完全一致。
3 叶酸缺乏及叶酸代谢基因多态性相关的疾病
3.1 NTD 1993—1995年,在我国开展的“中美预防神经管缺损合作项目”中,通过妊娠前每天补充400 μg叶酸降低了NTD的发生率,可见妊娠前补充叶酸对NTD有明显的预防作用。因此,美国在1998年出台一项公共卫生政策——面粉中强制添加叶酸,用以预防NTD发生。随后加拿大、哥斯达黎加、智利等国也相应出台了添加叶酸预防NTD的政策。我国在参与“中美预防神经管缺损合作项目”后对育龄女性补充叶酸进行广泛宣教及提供叶酸咨询服务等,NTD的发生率已呈明显下降趋势,截至2011年我国NTD的发生率为4.5/万。就4.5/万这一数据而言,似乎已经接近于叶酸预防NTD发生最小值5~6/万[9],但我国人口基数大,发病总人数不容忽视。
多项研究提出,NTD的发生是多基因及基因与环境相互作用的结果。Zhang等[10]的Meta分析指出MTHFR 677C>T与NTD显著相关(OR=1.23,95%CI=1.07~1.42),RFC-180A>G可能是NTD发生的危险因素(OR=1.55,95%CI=1.24~1.92)。得出以上结果的原因在于此篇Meta分析有42篇病例对照研究纳入了MTHFR 677C>T变异,样本量充足(病例组4374例,对照组7232例),而RFC-180A>G仅在4篇含1107例患者和1585例对照的研究中涉及。基因之间的相互作用也在Relton等[11]的研究中得到体现,该研究病例组含219例NTD患儿、211例NTD患儿母亲及100例NTD患儿父亲,对照组含645例健康新生儿母亲、602例健康新生儿。他们指出MTHFR 677C>T是英国北部NTD患儿的危险因素,MTRR 66A>G为保护因素,Logistic回归显示NTD患儿MTHFR 677T与MTRR 66G联合作用增加患病风险(P=0.003);同时母亲与NTD患儿间也存在基因相互作用,子代携带MTHFR 677C>T变异与母亲携带MTRR 66A>G变异使NTD发生率显著增高(P=0.001)。Erdogan等[12]采用与Relton相似的病例对照分组,对土耳其33例NTD患儿、26例NTD患儿母亲、48例健康新生儿母亲进行研究却得到了不同结论,MTHFR 677C>T不能作为NTD发生的危险因素(P>0.05)。以上研究主要从DNA水平分析遗传基因多态性与NTD关系,Hansen等[13]另辟蹊径,从mRNA水平分析MTHFR在NTD形成中的作用,结果表明MTHFR mRNA表达水平低下在小鼠胚胎NTD形成中发挥重要作用。
叶酸代谢途径基因多态性分布具有明显地域或人种差异,针对不同地区、不同民族人群研究结论也不尽相同。此外,多基因以及基因与环境的交互作用与NTD相关性还需进一步深入研究。
3.2 唇裂/腭裂(cleft lip/palate,CL/P) 由于叶酸在预防NTD发生方面的突出作用,有学者推测叶酸同样可以用于预防CL/P发生。
1998年1月,美国在谷物中强化补充叶酸后,发现其对CL/P的预防未见显著成效。加拿大安大略省的一项研究显示,强化补充叶酸前(1994—1997)较补充叶酸后(1998—2000)CL/P的发生率稍高但不显著。智利对比叶酸强化前后差异也未见统计学意义。随后,Wehby等[14]对CL/P组和对照组采取随机双盲试验,通过补充两种不同剂量叶酸(0.4 mg或者4 mg),观察从妊娠前到妊娠后3个月2组体内红细胞叶酸、血清叶酸、血清同型半胱氨酸的变化,并对妊娠结局进行随访。随访发现补充叶酸0.4 mg组和4 mg组CL/P复发率分别为2.9%和2.5%,相比未强化补充前的复发率(6.3%)显著下降(P=0.0009)。
目前叶酸代谢基因多态性与CL/P的关联尚未得出一致结论。Estandia-Ortega等[15]对墨西哥城132例CL/P患者和370非CL/P患者的研究指出,母亲摄入叶酸能降低CL/P发生率,同时指出个体携带MTHFR 677TT基因型CL/P发生率降低。MTHFR 677TT型个体体内活性5-MTHF水平低,将使CL/P发生率增高,Estandia-Ortega等MTHFR 677TT使CL/P风险降低的说法尚需进一步探讨。Brandalize等[16]对巴西南部114例CL患儿、110例患儿母亲和100例非CL患儿及母亲的配对研究认为MTHFR、MTR及MTRR基因多态性均不是CL/P的危险因素。
由于美国、加拿大、智利等国谷物中添加叶酸后CL/P发生没有明显下降,选取研究的病例对照人群中尚未发现MTHFR 677C>T使CL/P发生风险增加,因此MTHFR 677C>T尚不能作为导致CL/P发生的独立风险因素。
3.3 先天性心脏病(congenital heart disease,CHD)CHD发生率远高于NTD,鉴于叶酸在预防NTD发生中的重要作用,有研究认为妊娠期补充叶酸对CHD也有同样的预防作用。Li等[17]的Meta分析(19篇含4219例病例和20123例对照)指出,MTHFR 677C>T多态性是CHD发生的风险因素(OR=1.26,95%CI:1.06~1.51,P=0.009)。Huang等[18]通过对法乐四联症(tetralogy of Fallot,TOF)患者进行病例对照研究指出MTHFR 677TT纯合基因型是TOF的危险因素(OR=1.81,95%CI:1.15~2.84,P=0.010)。 有学者推测,意外妊娠者由于妊娠前未补充叶酸等多种维生素,可能导致胎儿心脏、神经系统发育异常。意外妊娠占女性正常妊娠的50%,其可能导致出生缺陷发生的数量不可忽视。补充叶酸能预防由乙醇、高同型半胱氨酸等引起的CHD。有CHD家族史者建议在妊娠前即服用大剂量叶酸预防CHD发生[19]。
由此可见,叶酸及MTHFR 677C>T多态性在CHD发生的作用已较为明确,建议将MTHFR 677TT作为CHD的遗传危险因素,有CHD史妊娠妇女可通过大剂量补充叶酸提高体内叶酸水平,促进体内合成代谢,促进心脏系统发育完善。
3.4 唐氏综合征(Down′s syndrome,DS) 叶酸缺乏导致体内活性5-MTHF水平低下,甲基直接供体S-腺苷同型半胱氨酸生成减少,DNA、蛋白质、脂质等甲基化障碍,染色体不稳定性增加。有研究表明低叶酸水平在DS的发生中发挥重要作用。
单基因为DS发生的独立危险因素在Wu等[20]的Meta分析(28篇病例对照研究包含2806个病例和4597个对照)中得到体现,分析指出亚洲妇女携带MTHFR 677T等位基因增加DS患病风险(OR=1.75,95%CI:1.084 ~2.824,P=0.022), 而 MTHFR 1298A>C与DS发生无关。而Coppedè等[21]找到了另一个相关基因,即DS儿母亲携带RFC-180G等位基因,尤其是RFC-180GG纯合型母亲生育DS患儿的风险明显增加(OR=1.14,95%CI:1.01~1.30,P=0.03;OR=1.27,95%CI:1.04~1.57,P=0.02)。Coppedè等[22]还指出了MTHFR 677TT/RFC-180GG两者联合作用增加DS患病风险的可能性(OR=6.0,95%CI=1.0~35.9,P=0.05)。叶酸代谢通路中单基因在DS发生中的作用在以上2篇Meta分析中有较为肯定的结论,多基因联合作用增加DS发生风险尚需进一步深入研究。
4 结语
综上所述,叶酸在预防NTD、CHD、DS方面的作用较明确,叶酸代谢基因MTHFR 677C>T可能是NTD、CHD、DS发生的危险因素之一,但叶酸在CL/P发病方面的作用尚未取得一致结论,原因可能在于研究样本大小差异、样本人群所代表的区域及不同民族基因型分布差异。就我国而言,南北方饮食差异大,人体叶酸代谢基因多态性分布差异也大。叶酸不足或缺乏及叶酸代谢基因多态性只能解释部分出生缺陷相关疾病的发生,尚需在环境与个体基因多态性交互作用上综合分析致病因素。此外,目前大多数研究集中于关注叶酸代谢关键酶——MTHFR的基因多态性,忽视了对叶酸代谢途径其他代谢酶基因多态性的相关性研究。因此,基于代谢途径上多个酶基因多态性位点的交互作用研究对出生缺陷的分子遗传学诊断可能更有指导意义。
[1] 中华人民共和国卫生部.中国出生缺陷防治报告[R].北京:中华人民共和国卫生部,2012.
[2] OppeneerSJ,RossJA,Koh WP,etal.Geneticvariation in folylpolyglutamate synthase and gamma-glutamyl hydrolase and plasma homocysteine levels in the Singapore Chinese Health Study[J].Mol Genet Metab,2012,105(1):73-78.
[3] Frosst P,Blom HJ,Milos R,et al.A candidate genetic risk factor for vascular disease:a common mutation in methylenetetrahydrofolate reductase[J].Nat Genet,1995,10(1):111-113.
[4] Goyette P,Sumner JS,Milos R,et al.Human methylenetetrahydrofolate reductase:isolation of cDNA mapping and mutation identification[J].Nat Genet,1994,7(2):195-200.
[5] LeclercD,CampeauE,GoyetteP,etal.Human methionine synthase:cDNA cloning and identification of mutations in patients of the cblG complementation group of folate/cobalamin disorders[J].Hum Mol Genet,1996,5(12):1867-1874.
[6] Olteanu H,Banerjee R.Human methionine synthase reductase,a soluble P-450 reductase-like dual flavoprotein,is sufficient for NADPH-dependent methionine synthase activation [J].J Biol Chem,2001,276(38):35558-35563.
[7] Tolner B,Roy K,Sirotnak FM.Structural analysis of the human RFC-1 gene encoding a folate transporter reveals multiple promotersand alternativelyspliced transcriptswith 5′end heterogeneity[J].Gene,1998,211(2):331-341.
[8] Dufficy L,Naumovski N,Ng X,et al.G80A reduced folate carrier SNP influences the absorption and cellular translocation of dietary folate and its association with blood pressure in an elderly population[J].Life Sci,2006,79(10):957-966.
[9] Centers for Disease Control and Prevention (CDC).CDC Grand Rounds:additional opportunities to prevent neural tube defects with folic acid fortification[J].MMWR Morb Mortal Wkly Rep,2010,59(31):980-984.
[10] Zhang T,Lou J,Zhong R,et al.Genetic variants in the folate pathway and the risk of neural tube defects:a meta-analysis of the published literature[J].PLoS One,2013,8(4):e59570.
[11] Relton CL,Wilding CS,Pearce MS,et al.Gene-gene interaction in folate-related genes and risk of neural tube defects in a UK population[J].J Med Genet,2004,41(4):256-260.
[12] Erdogan MO,Yildiz SH,Solak M,et al.C677T polymorphism of the methylenetetrahydrofolate reductase gene does not affect folic acid,vitamin B12,and homocysteine serum levels in Turkish children with neural tube defects[J].Genet Mol Res,2010,9 (2):1197-1203.
[13] Hansen DK,Barbee SA,Grafton TF,et al.Antisense modulation of 5,10-methylenetetrahydrofolate reductase expression produces neural tube defects in mouse embryos[J].Reprod Toxicol,2001,15(1):21-29.
[14] Wehby GL,Félix TM,Goco N,et al.High dosage folic acid supplementation,oral cleft recurrence and fetal growth.[J].Int J Environ Res Public Health,2013,10(2):590-605.
[15] Estandia-Ortega B,Velázquez-Aragón JA,Alcántara-Ortigoza MA,etal.5,10-Methylenetetrahydrofolate reductase single nucleotidepolymorphismsand gene-environmentinteraction analysis in non-syndromic cleft lip/palate [J].Eur J Oral Sci,2014,122(2):109-113.
[16] Brandalize AP,Bandinelli E,Borba JB,et al.Polymorphisms in genes MTHFR,MTR and MTRR are not risk factors for cleft lip/palate in South Brazil[J].Braz J Med Biol Res,2007,40(6):787-791.
[17] Li Z,Jun Y,Zhong-Bao R,et al.Association between MTHFR C677T polymorphism and congenital heart disease:A family-based meta-analysis[J].Herz,2015,40(Suppl 2):160-167.
[18] Huang J,Mei J,Jiang L,et al.MTHFR rs1801133C>T polymorphism is associated with an increased risk of tetralogy of Fallot[J].Biomed Rep,2014,2(2):172-176.
[19] Huhta JC,Linask K.When should we prescribe high-dose folic acid to prevent congenital heart defects?[J].Curr Opin Cardiol,2015,30(1):125-131.
[20] Wu X,Wang X,Chan Y,etal.Folate metabolism gene polymorphisms MTHFR C677T and A1298C and risk for Down syndrome offspring:a meta-analysis [J].Eur J Obstet Gynecol Reprod Biol,2013,167(2):154-159.
[21] Coppedè F,Lorenzoni V,Migliore L.The reduced folate carrier(RFC-1)80A>G polymorphism and maternal risk of having a child with Down syndrome:a meta-analysis[J].Nutrients,2013,5(7):2551-2563.
[22] Coppedè F,Marini G,Bargagna S,et al.Folate gene polymorphisms and the risk of Down syndrome pregnancies in young Italian women[J].Am J Med Genet A,2006,140(10):1083-1091.

