生物补片在女性盆底重建术中的应用进展
邱成丽,鲁永鲜
随着人口老龄化的加速及人们对生活质量要求的提高,女性盆底功能障碍性疾病(pelvic floor dysfunction,PFD)的发病率和就诊率逐年增高。据国外相关流行病学调查显示,老年女性人群的PFD发病率为18%~33%,但国内尚无流行病学方面的资料[1]。随着盆底重建手术的日渐成熟,生物补片技术也在近年得到进一步发展。尤其是在美国食品和药品管理局(FDA)连续两次就经阴道网片侵蚀等问题发出警告,并对其使用的安全性提出质疑后,学者们开始考虑是否可以将生物相容性更好、不易发生侵蚀的生物补片作为盆底重建材料的另一选择。综述生物补片在女性盆底重建术中的应用进展。
1 生物材料的定义及分类
生物材料主要包括三大类:自体组织、同种异体移植物和异种移植物。其中自体组织指来源于患者自身的组织,如腹直肌筋膜或大腿阔筋膜等;同种异体移植物是指来源于人类供体或者尸体的真皮及筋膜;异种移植物则来源于其他物种,如牛心包膜、猪真皮及小肠黏膜下层等[2]。而同种异体和异种移植物因存在免疫排斥和疾病传播的可能,如感染人类免疫缺陷病毒(HIV)、细菌、朊病毒等,多需经过脱细胞、消毒、灭菌等技术进行处理,保留其完整的细胞外基质(extracellular matrix,ECM)和三维框架结构。其优势是不含细胞表面受体的特异识别位点,不易引发受体的免疫排斥反应,增加了组织相容性,减少了感染概率,且处理后的移植物仍具有生物活性并能用于人体软组织的修复。据资料显示,同种移植物虽经脱细胞、消毒等技术处理,但仍有1/1670000感染HIV的风险[3],且材料获取来源有限,同时涉及伦理道德等问题。目前临床上多采用异种脱细胞生物补片,如猪、牛、马等的脱细胞组织,如猪真皮和小肠黏膜下层等,其优点在于猪和人类胶原分子之间的种间差异小[4],供源丰富,较易获得,利用性高,且人类病毒的传播性低。近年来,这类生物补片也被用于盆底修补术中。根据生物补片在制备过程中是否进行交联处理,可将其分为交联与非交联补片。目前商业应用和常用的同种异体生物补片见表1[5]。
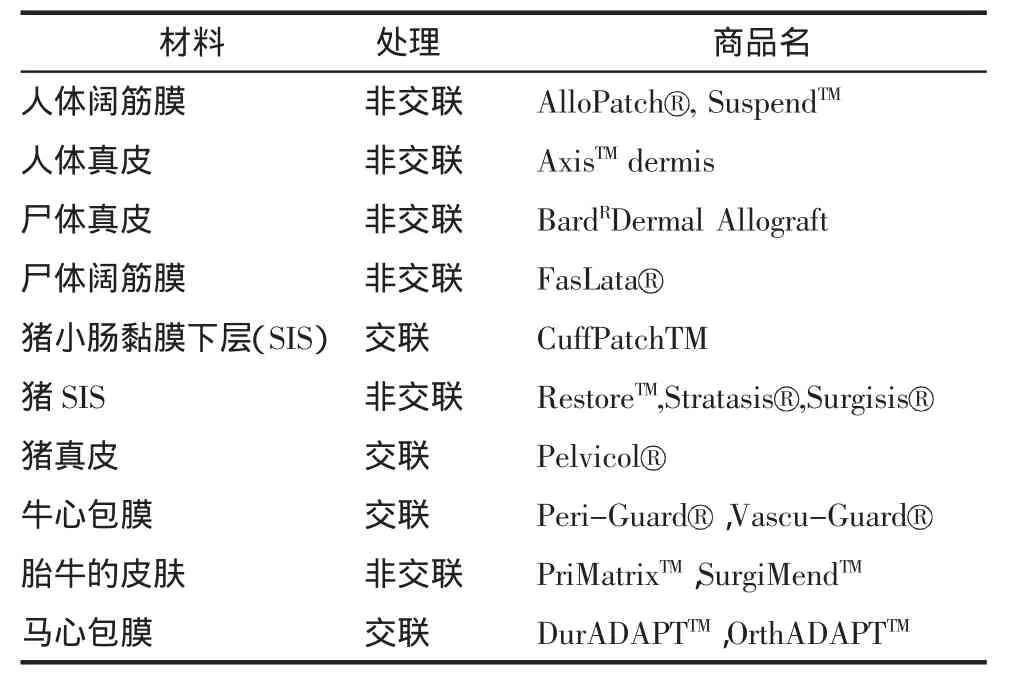
表1 目前商业应用的生物补片种类
2 生物补片的成分及在组织修补过程中的作用机制
2.1 生物补片的成分及作用 生物补片的成分主要为ECM,包括多种蛋白质、黏多糖(glycosaminoglycans,GAGs)及细胞因子等,均由细胞分泌而来,并以一种独特的、组织特异的结构排列,因而不同来源的ECM的成分及其含量会有所不同。有人把ECM比作活性的代谢单元,在细胞与基质之间起着动态平衡的作用。细胞分泌并编排ECM,而ECM又可反过来作用于细胞并控制其行为[6]。这种动态平衡作用使生物补片与宿主细胞之间产生一种反馈调节机制,控制宿主细胞的生长、增殖、迁移和分化。以下就猪SIS在盆底重建术中的应用为例作进一步的说明。
SIS-ECM中的蛋白质包括胶原蛋白、纤维连接蛋白、层黏连蛋白和整合素等,而每一种蛋白的含量不同,且具有其各自独特的功能。其中胶原蛋白占绝大多数,其是一种结构蛋白,以Ⅰ型胶原为主,富于弹性,在胶原分子内和分子间含有大量的共价键(氢键),使胶原蛋白变成非常强大的分子,具有很强的抗张力,这为生物补片支撑阴道壁的早期修补提供了良好的基础。因蛋白质呈电中性,可以折叠成三级和四级空间结构,为ECM创造了一个良好的骨架结构,以支撑整个基质,并能为组织中的细胞和其他ECM提供受体结合位点或黏附位点。而ECM中的纤维连接蛋白不仅具有成纤维细胞的表面膜受体,也是许多ECM的配体,例如与Ⅰ型胶原蛋白结合可以将黏附的细胞稳固到纤维框架中,与特定的GAGs(类似于凝胶)结合,可使纤维框架更加牢固、稳定。若缺少纤维连接蛋白,生物补片就不能很好地平衡外界的张力及维持体积的持久性。ECM中的整合素是一种跨膜糖蛋白,在细胞与ECM间起着信息传递的作用,当细胞外的信号传递到细胞内,可通过改变基因的表达来适应特定场合的需要,如趋化因子传递到细胞内会使巨噬细胞迁移至特定部位。从细胞内到细胞外信号的传递又能使成纤维细胞与被拉伸的方向一致,从而可协调胶原纤维的定向,并能增加Ⅰ型胶原纤维的分泌,进一步提高新生组织的强度。上述蛋白的作用解释了为什么生物补片可用于盆底修补手术,并能产生比自体组织更强的组织。
SIS-ECM中的黏多糖GAGs是一种结构性多糖,分子质量大、质地脆弱,不易折叠,易占空间,其内含有大量的负电荷,可以吸引大量的阳离子(如钠离子),后者反过来又可吸引组织中大量的水分,使细胞间隙高度膨胀、具有黏性,从而起到缓冲的作用。生物补片这种既能抵抗外界挤压又具有良好的抗张作用力的特点,很好地满足了阴道壁柔软且富于弹性的功能。
SIS-ECM中的细胞因子包括趋化因子、白细胞介素、干扰素和生长因子等,其中生长因子又分为成纤维细胞生长因子、转化生长因子、血管内皮生长因子等,这些因子能与细胞表面受体结合,从而激活相应的细胞,使之迁移、增殖和分化,同时还可调节免疫,通过旁分泌、自分泌的方式发挥其作用。生物补片的降解有利于此类因子的释放,为阴道壁组织重塑创造条件,同时又具有抗感染的作用。
2.2 生物补片自身的力学强度及其在体内降解过程中的力学变化 目前生物补片已用于临床各个领域,如腹壁疝、心血管、肠瘘、尿道、阴道乃至盆底的重建。但对生物补片的力学强度能否足够支撑各种缺陷部位的修补仍不甚了解。有文献采用球爆破试验对不同的生物补片及同种生物补片不同层数间的力学强度进行了分析,结果表明,同样是两层的,则胃黏膜最强,平均球爆破的强度为(262±60)N,其次是膀胱黏膜和膀胱基质的混合层,为(127±48)N,而膀胱黏膜和SIS的强度相似,分别为(61±15)N和(42±9)N,但都比膀胱基质强,后者为(19±7)N。而4层的SIS、膀胱黏膜、膀胱黏膜+膀胱基质和胃黏膜具有相似的力学强度,从(130±29)N 到(211±65)N不等,而膀胱基质最弱为(35±2)N。同种补片不同层数间相比,8层的SIS的强度为(325±53)N,约为4层的3倍,4层的SIS、膀胱黏膜和膀胱基质均较2层的力学强度更强,但2层的膀胱黏膜+膀胱基质和4层的相差无几,且2层的胃黏膜比4层的更强,具体原因尚不明确[7-8]。目前用于盆底重建的生物补片多为4层的SIS,据资料显示这种补片的力学强度既可达到支撑盆底组织早期修补的作用,又能同时兼顾阴道壁柔软度且富于弹性的特点。
在生物补片作为盆底重建材料,植入阴道壁内的同时会引发固有免疫和特异性免疫反应,这是生物补片降解的重要原因。但因生物补片经过去细胞、消毒、灭菌等处理,在很大程度上避免了特异性免疫反应所带来的不良影响。而固有免疫是阴道壁组织重塑所必需的,也是不能避免的。其中巨噬细胞是固有免疫反应的重要成分,由单核细胞分化而来,其可调节损伤反应和伤口愈合。巨噬细胞在不同的细胞因子作用下可分化为两种不同的表型,即M1型和M2型,前者有促炎性和细胞毒性的作用,达到灭菌和吞噬异物的目的,引发一种慢性炎症反应,而后者可促进免疫调节,达到组织修复和结构重塑的目的[9]。两者间是否存在转化关系以及M2型是如何调节免疫的,目前尚无确切的定论。但相关文献对SIS-ECM补片所引发的免疫反应进行了研究,结果表明在整个过程中均以M2型巨噬细胞为主,最终都达到了良好的组织结构重塑[9-10],说明M2型对宿主组织结构的重塑起着非常重要的作用。因此可以看出,生物补片在盆底重建的过程中,虽然会被降解,但却能进行良好的组织结构重塑,同时又避免了补片暴露、侵蚀的风险。
由于生物补片在体内的可降解性,使人们不得不对其修补的组织远期牢固性提出质疑。为此也进行了相应的研究,结果显示生物补片的降解与宿主组织结构重塑之间存在一种力学平衡关系,如图1所示[6]。从图中可以看出在组织恢复的早期生物补片的力学强度占主导作用,随着生物补片的降解,其力学强度随之下降,30 d左右其力学强度降为原来的50%,而随着新生宿主组织的重塑及其力学强度的增加,到45 d左右,两者达到力学平衡,之后生物支架继续降解,其力学强度进一步下降,而新生宿主组织的力学强度进一步增强,并且占主导地位。90 d左右生物支架完全降解,由新生的宿主组织完全替代。

图1 随着时间的延长补片与新生宿主组织之间的力学变化
3 生物补片在体内诱导形成新生组织的力学强度
目前对于生物补片诱导形成的新生组织的强度已进行了较多的动物实验研究。如Badylak等[11]将SIS补片(8层)植入犬的腹壁缺损处,植入时材料的强度大约为18 N,30 d时植入部位强度迅速下降至12 N,之后又逐渐增加,到24个月时约为40 N(P<0.05)。结果表明SIS植入动物体内后能在一定时间内降解,并重塑为超过自体组织强度的组织,如图2、3所示。从图3可以看出早期生物补片的力学强度约为腹壁的2倍,当补片的降解与新生组织的形成之间未达到平衡时,缺陷部位的力学强度则有明显下降,但当两者达到平衡即图最低点时,其力学强度仍高于腹壁,随着新生组织的长入,缺陷部位的力学强度又开始增加,到新生组织完全替代生物补片时,其强度可达到腹壁的4倍。Valentin等[12]在小鼠腹壁模型中对SIS、碳二亚胺交联的SIS、自体组织及聚丙烯(polypropylene,PP)等5种不同的移植物诱导形成的新生组织的最大收缩力及抗疲劳程度进行了比较,结果表明,术后6个月,SIS-ECM补片完全被新生的骨骼肌所替代,这些新生的骨骼肌产生的最大收缩力虽与自体组织相似,但其抗疲劳程度更强,而自体组织移植物被胶原结缔组织、脂肪组织及少量的骨骼肌成分构成的混合物所取代,其抗疲劳程度与自体组织相似,而碳二亚胺交联的SIS-ECM和聚丙烯却呈现出一种慢性的炎症反应,所形成的组织收缩力极小甚至不能被量化。以上实验表明生物补片诱导形成的新生组织有足够的张力去支撑动物的腹壁缺陷部位。

图2 SIS(8层)修补8 cm×12 cm的犬腹壁缺陷示意图

图3 犬腹壁缺陷部位的力学强度的变化
4 生物补片在盆底重建术中的应用研究
受外科腹壁疝生物补片成功应用的启发,近年来也有学者陆续将生物补片用于盆底重建手术,这在一定程度上克服了PP网片阴道侵蚀及阴道壁僵硬的问题。但基于生物补片的力学性能及可降解特性,不是所有盆底重建部位都能用生物补片来进行修补,如在持续抗拉强度占主导地位部位的重建——穹窿骶骨固定,合成网片可能会提供一个更好的解剖效果。近期一篇文献综述总结到,在骶骨固定术和重度膀胱膨出修补术中,合成网片较生物补片能提供更好的解剖效果,而在治疗压力性尿失禁的手术中,两者的成功率相当[13]。但因缺乏生物补片抗尿失禁的长期随访结果,且目前PP吊带已成为抗尿失禁的一线首选治疗方案,网片侵蚀的报道也相当少见,故生物补片尚不能取而代之。但在阴道壁修补方面,对于性生活活跃的患者,尤其是年轻女性,除了恢复阴道壁的正常解剖结构外,还应保留其柔软且富于弹性的功能。生物补片在这些方面有其独特的优势,是PP网片所不具备的。既往在盆底重建术中多采用猪真皮植入,但由于其被交联处理,使补片周围炎症持续存在,最终因瘢痕形成而导致高复发率[14-15],目前多采用非交联的SIS补片,其客观治愈率可达80%~100%。以下是近年来国外生物补片用于阴道壁修补的相关文献报道。
4.1 阴道壁膨出的初次修补
4.1.1 前壁修补 近期一篇文献就辅助材料用于治疗阴道前壁膨出的疗效及安全性进行了Meta分析,结果认为生物补片不仅较自体组织修补解剖复发率低而且在安全性上同自体组织相当并优于合成网片[16]。Feldner等[17]通过随机对照研究比较了4层SIS(n=29)与传统折叠缝合术(n=27)用于治疗阴道前壁膨出Ⅱ度及以上患者的疗效,12个月的随访结果表明,两者的主观治愈率相当,而客观治愈率分别为86.2%和59.3%,结果表明SIS很好地改善了阴道前壁的膨出,且无感染及补片侵蚀的发生,说明4层SIS生物补片疗效优于自体组织折叠缝合修补术。Reid等[18]采用回顾性队列研究比较自体组织、PP网片和Surgis补片在阴道旁修补中的疗效,4年的随访结果显示,三者的客观治愈率分别为69.49%(41/59)、84.21%(16/19)和 91.11%(82/89),表明 Surgisis补片在阴道旁修补中的疗效优于自体组织和PP网片。Chaliha等[19]的一项病例-对照研究显示SIS在前壁修补中可明显提高盆底重建手术的成功率,并可以降低复发率,且对性生活无不良影响。
4.1.2 后壁修补 由于后壁膨出多采用自体组织折叠缝合修补,单纯生物补片进行后壁修补的文献报道相对较少。Armitage等[20]通过回顾性研究观察了65例利用4层的Surgisis补片进行阴道前后壁修补的患者,平均年龄66岁,术前POP-Q分期,Ⅱ期36例,Ⅲ期28例,Ⅳ期1例,其中前壁膨出为主者10例,后壁膨出为主者16例,前后壁同时膨出39例,平均随访1年半,前壁、后壁客观治愈率分别为75.51%(37/49)和 98.19%(1/55),主观满意率 92%,无远期并发症。从中可以看出生物补片在阴道后壁膨出修补中疗效更好。
4.2 复发性膀胱膨出的修补 Natale等[21]采用了前瞻性随机对照研究比较了PP网片和猪真皮移植物(Pelvico)治疗复发性膀胱膨出的疗效,其中使用PP网片与生物补片者分别为96例和94例,24个月的随访结果显示,两者的客观治愈率分别为71.9%和56.4%,PP网片较生物补片客观治愈率高15.4%。Dahlgren等[22]采用多中心随机对照试验比较了PelvicolTM与传统修补术在治疗复发性盆腔器官脱垂的长期疗效,3年随访结果表明,两者的复发率相当,分别为58%(38/65)和67%(41/61),术后症状改善率分别为84%和85%,主客观治愈率并无差异。说明在复发性膀胱膨出的患者中自体组织与生物补片修补均不能很好地改善解剖复发率,可考虑选择PP网片进行加固。
以上结果表明生物补片可用于修补阴道前后壁的膨出,且取得了一定的疗效。目前国内也有少量临床研究[23],但鉴于研究的例数尚少,随访时间亦短,其手术适应证尚不能得出较肯定的结论。考虑到生物补片的强度不如PP网片,客观治愈率低于PP网片,但高于自体组织,故合理的手术适应证用在年轻女性、阴道壁中度膨出的患者中似乎收益更大,既增加了手术修补效果,又避免了PP网片的相关并发症。
5 影响生物补片组织修补疗效的因素
由于生物补片种类较多,不同的来源和处理方式所获得脱细胞生物补片,在三维结构、亲水性能、基质降解、力学性能、免疫反应及细胞黏附能力等方面有显著的不同[24],因而其在临床应用中的疗效也会有所差别。纵观生物补片在盆底重建术中的临床疗效,客观治愈率在50%~100%不等[13-23,25-30]。因此为了充分掌握并避免这些不利因素,更好地实现生物补片在盆底重建术中的临床应用价值,现将生物补片的主要影响因素分述如下。
5.1 脱细胞技术 由于异体细胞产物(如Gal抗原决定基和残留DNA)会引发一种促炎性反应[8],因此去细胞程度在很大程度上决定着宿主的免疫反应。有文献对同种来源但去细胞程度不同的ECM支架所引发的宿主免疫反应进行了比较,结果表明细胞残留物越多,引发的促炎性反应越强烈,越不利于组织结构的重塑[31]。而完全去除组织中所有的细胞成分目前是不可能的,且过分的去细胞试剂在去除细胞的同时也会破坏细胞基质成分及其结构的完整性,因此在保留完整的ECM基础上尽可能多地去除细胞残留物对宿主组织结构重塑有着重要的意义。
5.2 交联处理 很多文献指出交联处理能够延缓生物补片在体内的降解过程,并能提高其抗张强度,但因其改变了生物补片的拓扑结构,使邻近的细胞不能很好地渗透,加之生物补片降解缓慢,细胞因子不能有效释放,反而阻碍了宿主组织结构的重塑。有文献对交联与非交联的猪生物补片进行了比较,结果显示交联的生物补片能引起一种持久的慢性炎症反应,最终形成纤维包裹,即瘢痕形成[32]。
5.3 材料来源 目前生物补片的来源较多,包括不同物种、同种不同组织或器官甚至不同年龄段的动物,而不同来源的生物补片所含的基质成分及含量也不尽相同,生物学特性也不完全一致,以致所诱导形成的新生组织强弱程度也会有差别。Vandevord等[33]对猪SIS、尸体阔筋膜、尸体真皮和猪真皮4种不同来源的生物补片进行了比较,包括胶原沉积、细胞量、细胞形态及血管形成等,最终数据表明SIS的生物学特性总体优于其余3种组织。Liu等[24]则对Bama小型猪中所获取的SIS、膀胱基质、脱细胞真皮、胆囊派生的ECM及脱细胞心包膜等5种脱细胞补片进行了比较研究,结果表明猪膀胱基质在亲水性、抗感染及促细胞增殖等方面有更优越的生物学特性,在将来可能成为盆底重建材料中的理想生物补片。Sicari等[34]比较了获得的不同年龄段猪的SIS-ECM在活体内所产生的宿主免疫反应及新生组织结构重塑的效果,结果表明不同年龄段的动物所诱导的组织重塑的特点有显著的差异,猪越年轻其SIS-ECM结构重塑效果越好,原因在于偏年轻的动物ECM中内部的交联结构未完全形成,利于补片的降解,进而促进组织结构的重塑。
作为一种新兴材料,生物补片在盆底重建术中的应用尚处于探索阶段。近年来对生物补片的性质和功能逐渐有所了解,其应用范围日益拓展。生物补片要想在盆底重建术中得到更好的推广及应用,需进一步解决如下问题:①在制作过程中,尽可能多去除细胞及其残余物,尽可能保留ECM成分维持其结构的完整性,取消交联处理。②对不同的生物补片进行更多的体外对照实验及临床研究,进一步了解各种生物材料的强度及其在体内完全降解所需的时间,明确其中的免疫调节机制及新生组织成分及强弱,以获得最佳的补片材料。③生物补片供应量有限,价格较贵,近20000元,保存、运输和消毒均较复杂,有待进一步解决。相信随着盆底器官脱垂患者的年轻化,生物补片在女性盆底重建术中仍有较大的发展空间。
[1] 王佳,鲁永鲜.经阴道网片盆底重建手术的历史及应用现状与争论[J].中华妇产科杂志,2013,48(7):554-556.
[2] 李琦,王建六.生物源性补片在女性盆底重建外科中的应用与研究进展[J].中国妇产科临床杂志,2013,14(2):182-185.
[3] Peppas G,Gkegkes ID,Makris MC,et al.Biological mesh in hernia repair,abdominal wall defects,and reconstruction and treatment of pelvic organ prolapse:A Review of the Clinical Evidence[J].Am Surg,2010,76(11):1290-1299.
[4] Williams D.Collagen:ubiquitous in nature,multifunctional in devices[J].Med Device Technol,1998,9(6):10-13.
[5] Badylak SF,Freytes DO,Gilbert TW.Extracellular matrix as a biological scaffold material:Structure and function [J].Acta Biomater,2009,5(1):1-13.
[6] Reid RI.A Comparative Analysis of Biomaterials Currently Used in Pelvic Reconstruc tive Surgery[M]//von Theobold P,Zimmerman CW,Davila GW.New Techniques in Genital Prolapse Surgery.London:Springer London Ltd,2011:105-133.
[7] Freytes DO,Badylak SF,Webster TJ,et al.Biaxial strength of multilaminated extracellular matrix scaffolds[J].Biomaterials,2004,25(12):2353-2361.
[8] Freytes DO,Rundell AE,Vande Geest J,et al.Analytically derived material properties of multilaminated extracellular matrix devices using the ball-burst test[J].Biomaterials,2005,26(27):5518-5531.
[9] Badylak SF,Gilbert TW.Immune response to biologic scaffold materials[J].Semin immunol,2008,20(2):109-116.
[10] Badylak SF, Valentin JE, Ravindra AK,et al.Macrophage phenotype as a determinant of biologic scaffold remodeling[J].Tissue Eng Part A,2008,14(11):1835-1842.
[11] Badylak S,Kokini K,Tullius B,et al.Strength over time of a resorbable bioscaffold for body wall repair in a dog model[J].J Surg Res,2001,99(2):282-287.
[12] Valentin JE,Turner NJ,Gilbert TW,et al.Functional skeletal muscle formation with a biologic scaffold[J].Biomaterials,2010 ,31(29):7475-7484.
[13] Yuteri-Kaplan LA,Gutman RE.The use of biological materials in urogynecologic reconstruction:a systematic review[J].Plast Reconstr Surg,2012,130(5 Suppl 2):242S-253S.
[14] Ross JW.Porcine dermal hammock for repair of anterior and posterior vaginal wall prolapse:5-year outcome[J].J Minim Invasive Gynecol,2008,15(4):459-465.
[15] Wheeler TL,Richter HE,Duke AG,et al.Outcomes with porcine graft placement in the anterior vaginal compartment in patients who undergo high vaginal uterosacral suspension and cystocele repair[J].Am J Obstet Gynecol,2006,194(5):1486-1491.
[16] Min H,Li H,Bingshu L,et al.Meta-analysis of the efficacy and safety of the application of adjuvant material in the repair of anterior vaginal wall prolapsed[J].Arch Gynecol Obstet,2013,287(5):919-936.
[17] Feldner PC,Castro RA,Cipolotti LA,et al.Anterior vaginal wall prolapse:a randomized controlled trial of SIS graft versus traditional colporrhaphy[J].Int Urogynecol J,2010,21(9):1057-1063.
[18] Reid RI,Luo K.Site-specific prolapse surgery.II.Vaginal paravaginalrepairaugmented with eithersyntheticmesh or remodelling xenograft[J].Int Urogynecol J,2011,22(5):601-609.
[19] Chaliha C,Khalid U,Campagna L,et al.SIS graft for anterior vaginal wall prolapse repair—a case-controlled study [J].Int Urogynecol J Pelvic Floor Dysfunct,2006,17(5):492-497.
[20] Armitage S,Seman EI,Keirse MJ.Use of surgisis for treatment of anterior and posterior vaginal prolapse[J].Obstet Gynecol Int,2012,2012:376251.
[21] Natale F,La Penna C,Padoa A,et al.A prospective,randomized,controlled study comparing Gynemesh,a synthetic mesh,and Pelvicol,a biologic graft,in the surgical treatment of recurrent cystocele[J].Int Urogynecol J Pelvic Floor Dysfunct,2009,20(1):75-81.
[22] Dahlgren E,Kj覬lhede P,PROP-PELVICOL Study Group.Long-term outcome of porcine skin graft in surgical treatment of recurrent pelvic organ prolapse.An open randomized controlled multicenter study[J].Acta Obstet Gynecol Scand,2011,90(12):1393-1401.
[23] 孙秀丽,杨欣,耿京,等.猪小肠黏膜下层生物补片在盆腔器官脱垂手术治疗中应用的初步观察[J].中华妇产科杂志,2013,48(8):575-578.
[24] Liu L,Li D,Wang Y,et al.Evaluation of the biocompatibility and mechanical properties of xenogeneic (porcine)extracellular matrix(ECM)scaffold for pelvic reconstruction [J].Int Urogynecol J,2011,22(2):221-227.
[25] Mouritsen L,Kronschnabl M,Lose G.Long-term results of vaginal repairs with and without xenograft reinforcement[J].Int Urogynecol J,2010,21(4):467-473.
[26] Nieuwoudt A,Jeffery S.Anatomical and functional outcomes of a subintestinal submucosa(surgisis)graft to augment anterior repair:a prospective observational study[J].Int Urogynecol J,2011,22(12):1541-1542.
[27] Maher C,Feiner B,Baessler K,et al.Surgical management of pelvic organ prolapse in women[J].Cochrane Database Syst Rev,2013,4:CD004014.
[28] Meschia M,Pifarotti P,Bernasconi F,et al.Porcine skin collagen implants to prevent anterior vaginal wall prolapse recurrence:a multicenter,randomized study[J].J Urol,2007,177(1):192-195.
[29] Altman D,Zetterstr觟m J,Mellgren A,et al.A three-year prospective assessment of rectocele repair using porcine xenograft[J].Obstet Gynecol,2006,107(1):59-65.
[30] 杨俊芳,韩劲松.猪小肠黏膜下层补片在盆底重建手术中的应用进展[J].现代妇产科进展,2012,21(11):896-898.
[31] Balaklava SF.Decellularized allogeneic and xenogeneic tissue as a bioscaffold for regenerative medicine:factors that influence the host response[J].Ann Biomed Eng,2014,42(7):1517-1527.
[32] Orenstein SB,QiaoY,Klueh U,etal.Activation ofhuman mononuclear cells by porcine biologic meshes in vitro[J].Hernia,2010,14(4):401-407.
[33] Vandevord PJ,Broadrick KM,Krishnamurthy B,et al.A comparative study evaluating the in vivo incorporation of biological sling materials[J].Urology ,2010,75(5):1228-1233.
[34] Sicari BM,Johnson SA,Siu BF,et al.The effect of source animal age upon the in vivo remodeling characteristics of an extracellular matrix scaffold[J].Biomaterials ,2012,33(22):5524-5533.

