γ-分泌酶抑制剂DAPT通过下调NOTCH1信号通路抑制结肠癌HCT116细胞增殖的实验研究*
尹鹏 胡君 储著凌 霍中华 侯乐伟 吕盛 栾荣刚 胡国强
(解放军第四五四医院普外烧伤整形外科,南京 江苏 210002)
由于我国人口饮食结构以及生活方式的改变,结肠癌(colon cancer)的发病率呈明显上升趋势,以每年4%到5%的速度递增[1-5]。临床研究和流行病学调查数据显示目前结肠癌已成为发病率第三位的恶性肿瘤性疾病[1-5]。研究表明在正常生理状态下NOTCH1信号通路对于调节细胞分化(cell differentiation)和组织器官生成发育(development)有重要的价值[6-9]。进一步的研究显示NOTCH1信号通路还在肿瘤的增殖分化、浸润、转移及凋亡过程中均扮演着重要的角色[10-12]。研究证实抑制和下调NOTCH1信号通路的活性可以有效抑制肺腺癌A549细胞、鼻咽癌5-8F细胞和CNE-1细胞以及卵巢癌A2780细胞等多种肿瘤的增殖和分化[13-15]。同时大量研究显示γ-分泌酶抑制剂(γ-secretase inhibitor)DAPT 对NOTCH1信号通路有显著抑制作用[13,14,16]。本研究旨在探讨γ-分泌酶抑制剂DAPT 能否通过下调NOTCH1信号通路抑制结肠癌HCT116细胞增殖,以及对NOTCH1信号通路下游分子Hes1表达的影响。
1 材料和方法
1.1 主要试剂和材料 结肠癌HCT116细胞购买于从中国科学院上海细胞库;PCR 试剂盒购自宝生物工程有限公司;鼠抗人NOTCH1抗体、鼠抗人Hes1抗体和鼠抗人β-actin 抗体购于美国Cell Signaling 公司;γ-分泌酶抑制剂DAPT 购买于德国Merck公司;DMEM 培养基购买于美国Gibco公司;小牛血清购买于杭州四季清公司;MTT 试剂盒购买于美国Promega公司;超纯水,其余试剂均为分析纯。
1.2 细胞培养 结肠癌HCT116细胞常规接种在含10%FBS、100g/L 青霉素、100g/L 链霉素的RPMI 1640培养液中,置于37°C、95%空气、5% CO2孵箱内培养。每48h换液、传代1次,取对数生长期细胞用于实验。
1.3 细胞活性检测 取对数生长期细胞消化制成单细胞悬液,接种于96孔培养板中,每孔接种100μL约含5×103个细胞。贴壁后无血清培养细胞16h 至24h,使细胞同步化。加入不同终浓度(0μM、1μM 和10μM)的DAPT,在37℃,5% CO2条件下培养细胞,0μM DAPT 干预组细胞作为对照组(Control组)。使用MTT 比色试验对不同时间点(0h、24h和48h)的细胞生长状态进行测定,实验重复4次。对应时间点的细胞活性(%)=(OD 干预组/OD 对照组)×100(%)[2]。
1.4 细胞NOTCH1和Hes1 mRNA 表达检测 按照RT-PCR 试剂盒说明书提取细胞总RNA。以2μg总RNA 为模板,用Oligo(dT)18作为引物,按照试剂盒说明书介绍要求合成cDNA 第1链。NOTCH1正 义5′-GCAAGAAGAAGCGGAGAG-3′,反 义5′-AGCTGGCACCCTGATAGATG-3′;Hes1 正 义5′-GCAGCAGCAGTTGCAAGCTC-3′,反 义5′-TCTTGTCATCTTTTATTGCC-3′;β-actin 正 义:5′-CTCCATCCTGGCCTCGCTGT-3′,反 义:5′-GCTGTCACCTTCACCGTTCC-3′,PCR 反应体系如下:2μL逆转录产物模板、PCR Master Mix(2×)25μL、正反引物各2μL,以超纯水补充至50μL。PCR 反应条件为:95℃5min;91℃30s,55℃60s,73℃60s,循环35轮,最后74℃延伸10min。PCR 产物8μL 与5×loading buffer 2 μl 混匀后,1.2% 琼脂糖凝 胶20V/cm电压进行电泳约30min。应用凝胶成像系统(Bio-rad)摄影,Quantity One软件对目的条带进行扫描分析。用与β-actin PCR 产物条带灰度比值作为TIMP-1和PPAR-γmRNA 的相对表达量。
1.5 Western blot法检测细胞中NOTCH1和Hes1蛋白表达 按照试剂盒操作要求,首先提取细胞总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1h,分别加入鼠抗人单克隆抗体NOTCH1(1∶1000)、Hes1(1∶1000)和β-actin(1∶1500),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶2000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.6 统计学方法 计量资料以均数±标准差表示。采用SPSS17.0进行单因素方差分析,两样本均数多重比较采用LSD 法,P<0.05为差异有统计学意义。
2 结果
2.1 MTT 法结果分析 在不同浓度(0μM、1μM 和10μM)的DAPT 干预后,使用MTT 法对不同时间点(0h、24h 和48h)结肠癌HCT116 细胞活性进行测定。发现给予DAPT 干预后HCT116细胞活性呈浓度依赖性和时间依赖性下降,差异均存在显著统计学意义(P 均<0.05),见表1。

表1 MTT比色法测定HCT116细胞活性[n(×10-2)]Table 1 Cell viabilities of HCT116cells in different time points(0h,24h,and 48h)
2.2 NOTCH1 mRNA 和蛋白的表达 在给予HCT116细胞不同浓度(0μM、1μM 和10μM)DAPT干预48h后,使用RT-PCR 和western blot法对细胞NOTCH1mRNA 和蛋白的表达进行分析。发现给予DAPT 干预后NOTCH1 mRNA 和蛋白表达水平呈浓度依赖性降低,差异均存在显著统计学意义(P均<0.05),见表2,图1。
表2 HCT116细胞NOTCH1和Hes1 mRNA 和蛋白表达水平(n=4,)Table 2 The mRNA and protein expression levels of NOTCH1and Hes1 in HCT116cells

表2 HCT116细胞NOTCH1和Hes1 mRNA 和蛋白表达水平(n=4,)Table 2 The mRNA and protein expression levels of NOTCH1and Hes1 in HCT116cells
注:与0μM 相比较①P<0.05,与1μM 相比较②P<0.05。
2.3 Hes1mRNA 和蛋白的表达 在给予HCT116细胞不同浓度(0μM、1μM 和10μM)DAPT 干预48h后,使 用RT-PCR 和western blot 法对细胞Hes1 mRNA 和蛋白的表达进行分析。发现给予DAPT 干预后Hes1mRNA 和蛋白表达水平呈浓度依赖性降低,差异均存在显著统计学意义(P 均<0.05),见图2,表2。

图1 HCT116细胞NOTCH1mRNA和蛋白的表达(n=4)Figure 1 The mRNA and protein expression of NOTCH1in HCT116cells(n=4).
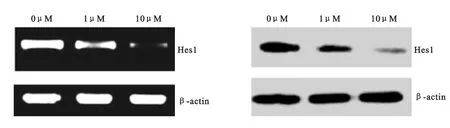
图2 HCT116细胞Hes1mRNA和蛋白的表达(n=4)Figure 2 The mRNA and protein expression of Hes1in HCT116cells
3 讨论
结肠癌(colon cancer)是人类最常见的消化道恶性肿瘤之一,目前临床研究和流行病学调查发现由于人口老龄化的加剧、饮食结构和生活习惯的的改变导致结肠癌的发病率呈逐年上升趋势,据统计结肠癌的发病率呈每年4%~5%的速度递增[1-5]。数据显示目前在我国结肠癌已成为发病率第三位的恶性肿瘤性疾病[1-5]。寻求新的治疗药物和方法刻不容缓。
NOTCH 基因及其信号通路首先在果蝇体内发现,进一步研究表明NOTCH 信号通路广泛存在于低等及高等动 物,在进化上 高度保守[6-10]。完整的NOTCH 信号通路主要是由NOTCH 受体(NOTCH receptors)、NOTCH 配 体(NOTCH ligands)、CSLDNA 结合蛋白(CSL-DNA binding proteins)及NOTCH 调节分子(NOTCH regulators)等构成,其中NOTCH 受体包括NOTCH1到NOCTH4共4个亚型,目前对NOTCH1的研究较为深入[6-10]。生理状态下NOTCH1信号通路对胚胎的生长发育、组织器官的生成、细胞的增殖和分化等均具有关键的调节作用[6-9]。张树君等 研究发现 在主动脉-性 腺-中 肾(aorta-gonad-mesonephros,AGM)区NOTCH1信号通路在造血祖细胞的增殖和分化过程中扮演着重要的角色[17]。肖迎等的研究发现NOTCH1 信号通路顺序开放和激活是调节胚胎干细胞向神经细胞的特异性分化的重要因素[18]。朱英等人的研究证实在牙根的发育过程中NOTCH1信号通路对于牙髓牙本质复合体的发育和成熟具有关键的调节作用[19]。同时进一步的研究表明NOTCH1信号通路对肿瘤的增殖和分化、肿瘤血管生成、肿瘤的浸润和转移以及炎症反应等多种病理生理过程也有重要的调节作用[10-15]。吴利英等的研究发现γ-分泌酶抑制剂DAPT 可以通过抑制NOTCH1及下游分子Hes1的表达使人卵巢癌A2780细胞的细胞周期停滞在G1期,从而抑制肿瘤细胞的增殖和分化[14]。陈始明等的研究证实抑制NOTCH1信号通路可以有效地抑制人鼻咽癌5-8F细胞和CNE-1细胞的增殖和分化[15]。大量的研究证实γ-分泌酶抑制剂DAPT 可以特异性的有效抑制NOTCH1 的表达,从而抑制 NOTCH1 信号通路[13,14,16]。在本实验中我们发现在使用不同浓度的(0μM、1μM 和10μM)DAPT 干预后结肠癌HCT116细胞活性呈浓度依赖性和时间依赖性下降,差异均存在显著统计学意义(P 均<0.05)。该结果表明γ-分泌酶抑制剂DAPT 对结肠癌HCT116细胞的增殖和分化有显著的抑制作用。
Hes1是NOTCH1信号通路的重要靶蛋白,是参与NOTCH1信号通路生物活性的关键分子[18-20]。本实验中我们使用RT-PCR 和western blot法对结肠癌HCT116细胞NOTCH1和Hes1mRNA 和蛋白的表达水平进行检测。结果表明在给予不同浓度(0μM、1μM 和10μM)γ-分泌酶抑制剂DAPT 干预后HCT116细胞NOTCH1和Hes1mRNA 和蛋白的表达水平呈浓度依赖性降低。该结果表明γ-分泌酶抑制剂DAPT 对结肠癌HCT116 细胞NOTCH1 和Hes1基因的表达有明显的抑制作用。
4 结论
γ-分泌酶抑制剂DAPT 可以通过下调NOTCH1信号通路,抑制结肠癌HCT116细胞增殖。γ-分泌酶抑制剂具有成为治疗结肠癌等恶性肿瘤药物的潜在可能。
[1]张明,臧健.艾迪注射液联合FOLFOX4方案治疗结肠癌的临床观察[J].西部医学,2009,21(4):596-597.
[2]尹鹏,胡君,储著凌,霍中华,等.替米沙坦通过上调PPAR-γ促进结肠癌SW480细胞TIMP-1表达的实验研究[J].西部医学,2014,26(2):160-162.
[3]陈善泽,邓璐霞,黄宁,等.LPS刺激对人结肠癌SW480、肺癌A549细胞HMGB1 以及HBD-1 表达的影响[J].西部医学,2010,22(5):785-787.
[4]王跃,刘为青,陈明清,等.BALB/c小鼠结肠癌肝转移模型建立[J].西部医学,2012,24(9):1658-1660.
[5]杨庆强,唐春燕.反义寡核苷酸对微缺氧下人结肠癌细胞HT-29骨桥蛋白表达的影响[J].西部医学,2011,23(2):216-219.
[6]Wu ZQ,Rowe RG,Lim KC,et al.A Snail1/Notch1signaling axis controls embryonic vascular development[J].Nat Commun,2014,5:3998.
[7]梁洁,韩骅.Notch信号通路与血管发育[J].细胞与分子免疫学杂志,2008,24(12):1225-1226.
[8]王莉,刘向东,赵星成,等.Notch信号途径在血管形成和内皮细胞中的作用[J].细胞与分子免疫学杂志,2012,28(8):888-891.
[9]Kang JA,Kim WS,Park SG.Notch1is an important mediator for enhancing of B-cell activation and antibody secretion by Notch ligand[J].Immunology,2014,143(4):550-559.
[10]Wael H,Yoshida R,Kudoh S,et al.Notch1signaling controls cell proliferation,apoptosis and differentiation in lung carcinoma[J].Lung Cancer,2014,85(2):131-140.
[11]Zhang L,Dong Y,Zhu N,et al.microRNA-139-5p exerts tumor suppressor function by targeting NOTCH1in colorectal cancer[J].Mol Cancer,2014,13:124.
[12]Hu YJ,Li HY,Qiu KJ,et al.Downregulation of Notch1inhibits the invasion of human hepatocellular carcinoma HepG2and MHCC97Hcells through the regulation of PTEN and FAK[J].Int J Mol Med,2014,34(4):1081-1086.
[13]周敏,范志文,韩瑞超.γ分泌酶抑制剂阻断Notch信号通路对肺腺癌细胞A549增殖的影响[J].上海交通大学学报医学版,2012,32(8):1024-1028.
[14]吴利英,王明义,辛晓燕.γ分泌酶抑制剂对人卵巢癌细胞生长的抑制作用及其机制[J].现代肿瘤医学,2010,18(4):647-649.
[15]陈始明,丁永军,华清泉,等.Notch信号阻断剂抑制鼻咽癌细胞增殖的作用及机制[J].肿瘤防治研究,2012,38(12):1341-1345.
[16]杨阳,梁振兴,王宁,等.γ-分泌酶抑制剂对血管内皮细胞抗过氧化氢损伤的保护作用及其机制[J].中华实验外科杂志,2013,30(5):887-890.
[17]张树君,陈建斌,杨春秀,等.Notch1信号在小鼠胚胎早期造血发育阶段的表达[J].中国生物制品学杂志,2011,24(9):1061-1063.
[18]肖迎,王琪,唐仕波,等.Notch1 蛋白在胚胎干细胞向神经细胞诱导分化过程中的表达[J].中国组织工程研究与临床康复,2008,12(25):4967-4970.
[19]朱英,陈旭.Notch1在牙根发育不同阶段牙髓中的表达[J].口腔医学,2012,32(11):643-645.
[20]D'Altri T,Gonzalez J,Aifantis I,et al.Hes1expression and CYLD repression are essential events downstream of Notch1in T-cell leukemia[J].Cell Cycle,2011,10(7):1031-1036.

