Hrs对结肠癌细胞凋亡及增殖作用的研究
孙建秀,李璇
(中国医科大学附属第一医院血管/甲状腺外科,沈阳 110001)
·论著·
Hrs对结肠癌细胞凋亡及增殖作用的研究
孙建秀,李璇
(中国医科大学附属第一医院血管/甲状腺外科,沈阳 110001)
目的研究在结肠癌细胞系中Hrs与凋亡及增殖的关系。方法在结肠癌细胞系HCT-116和SW-480中下调Hrs蛋白表达,通过Incucyte、MTT法、软琼脂试验、FACS检测细胞凋亡与增殖情况。结果下调Hrs表达后,结肠癌细胞系HCT-116和SW-480凋亡明显增加,增殖及细胞活性均显著受到抑制。结论Hrs与结肠癌细胞凋亡密切相关。
Hrs;结肠癌;凋亡;增殖
结肠癌是常见的消化系统恶性肿瘤。近年来,其发病率不断上升,虽然手术治疗技术较为成熟,但5年生存率仅为50%~55%[1,2]。肝细胞生长因子调节酪氨酸激酶底物(hepatocyte growth factor regulated tyrosine kinase substrate,Hrs)与STAM(signal transducing adaptor molecule)共同组成内吞体分选转运复合体(endosomal-sorting proteins required for transport,ESCRT)。Hrs与溶酶体转运及膜蛋白的泛素化降解相关,但其与结肠癌细胞凋亡的关系尚不明确。本研究通过在结肠癌细胞系中下调Hrs蛋白的表达,检测细胞凋亡及增殖的变化,旨在探讨Hrs对结肠癌细胞凋亡的影响。
1 材料与方法
1.1 细胞培养
结肠癌细胞系HCT-116与SW-480购自美国模式菌种收集中心(ATCC)。用含50 IU青霉素/链霉素、2 mmol/L L-glutamine及10%胎牛血清的DMEM培养基于37℃、5%CO2条件下培养,3~5 d传代1次。
1.2 质粒及慢病毒制备及转染
采用pLKO.1慢病毒RNAi表达系统构建慢病毒shRNA。本研究中所用shRNA如下:shHrs1,5′-CC GGTCGACAAGAACCCACACGTCCTCGAGGACGTG TGGGTTCTTGTCGTTTTTT-3′;shHrs2,5′-CCGGTG CACGTCTTTCCAGAATTCAACTCGAGTTGAATTCT GGAAAGACGTGCTTTTTT-3′;shGFP,5′-CCGGTAC GTCTATATCATGGCCGACAACTAGTTGTCGGCCAT GATATAGACGTTTTTTG-3′。shGFP在本研究中用做对照。
病毒包装:将目的质粒与pCMV-dR8.91、pCMVVSV-G通过钙磷法共转染于HEK293T细胞中,比例为10∶5∶5 μg(10 cm培养皿)。6 h后换液。48 h后收集含病毒的培养基,19 400 g离心2 h。将沉淀的病毒再悬浮,保存于-80℃。用这些病毒感染细胞48 h后进行实验。
1.3 流式细胞术检测细胞凋亡
细胞凋亡的计量使用流式细胞术(FACS)进行分析,细胞经Annexin V-FITC(BD Biosciences公司)和propidium iodide(Sigma公司)染色后,采用流式细胞仪检测分析。
1.4 细胞活性检测
MTT检测:将MTT溶于PBS中(5 mg/mL)保存。感染后细胞铺于96孔板,培养48 h后加入0.5 mg/mL MTT溶液,37°C、5%CO2培养箱中培养4 h,弃MTT,每孔加入200 μL DMSO,酶标仪测定490 nm处吸光度值。
软琼脂生长实验:在6孔板中,将含有104个细胞的0.35%的软琼脂铺于0.6%的底层琼脂之上,细胞培养3~4周后,计数形成的集落数量。
Incucyte系统(时间动态活细胞成像及数据分析系统):将细胞按每孔5 000个铺于96孔版中,仪器放置在培养箱中,中间放置标准培养容器,通过下方的显微成像装置进行全自动拍照。由系统软件自动依据饱和度和计数分析生成的基于图像的饱和度—时间图表。
1.5 Western blot
收集处理后的细胞,PBS清洗2次,用裂解液(150 mmol/L sodium chloride,1.0%NP-40 or Triton X-100,0.5%sodium deoxycholate,0.1%SDS,50 mmol/L Tris,pH8.0)裂解。经SDS-PAGE电泳,稳流冰浴电转膜,应用Li-Cor Odyssey image reader进行Western blot检测。所用Hrs单克隆抗体购自美国Santa Cruz公司。
1.6 统计学分析
采用SPSS 13.0软件系统进行统计分析。计量资料采用表示,计数资料采用率表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 下调Hrs蛋白表达抑制HCT-116细胞生长曲线
Wetern blot结果显示:shHrs2可有效下调Hrs蛋白表达,而shHrs1未能成功下调蛋白表达(图1A)。有效下调Hrs表达后,HCT-116生长曲线(Incucyte生成饱和度—时间曲线)明显受到抑制(图1B)(P<0.05)。

图1 慢病毒感染shHrs后Wetern blot检测Hrs蛋白表达情况及HCT-116细胞生长曲线测定Fig.1 Knocking down of Hrs expression inhibits cell growth curve of HCT-116
2.2 下调Hrs表达后HCT-116细胞凋亡增加且集落形成能力降低。
在HCT-116细胞系中,感染shHrs2病毒后细胞可稳定低表达Hrs蛋白,应用FACS检测细胞凋亡,结果显示其凋亡明显高于对照组(P<0.01)(图2A)。软琼脂实验结果显示细胞克隆数明显减少(P<0.01)(图2B)。差异均具有统计学意义(P<0.01)。
2.3 下调Hrs表达后SW-480细胞凋亡增加且细胞活性减低。
在SW-480细胞系中稳定低表达Hrs蛋白后,其凋亡比例明显升高(P<0.01)(图3A),MTT法检测细胞活性可见其活性较对照组明显下降(P<0.01)(图3B)。
3 讨论
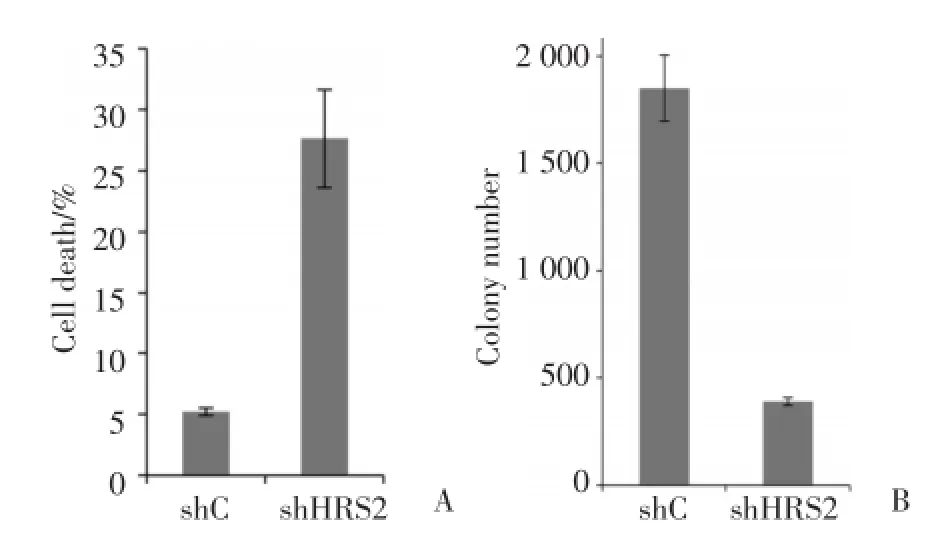
图2 下调Hrs表达后HCT-116细胞凋亡情况及细胞集落形成情况Fig.2 Apoptosis and cell colony formation change in HCT116 after knocking down of Hrs

图3 Hrs表达下调后SW-480细胞凋亡情况及细胞活性改变Fig.3 Apoptosis and cell viability change in SW-480 after knocking down of Hrs
吞噬细胞将微生物吞噬固定之后,形成的吞噬小泡会与溶酶体融合,随后被降解,这是机体天然免疫系统里非常重要的自我保护机制。2001年Katzmann等[3]发现了ESCRT复合体,Hrs和STAM的作用也开始被研究者关注。目前认为,在细胞正常的代谢过程中,Hrs在膜蛋白泛素化后转运至溶酶体降解,在识别错误折叠蛋白、细胞因子受体、膜蛋白分选及转运等过程中意义重大[4]。
ESCRT复合体保守存在于真核生物中,哺乳动物细胞中ESCRT系统由ESCRT-0、Ⅰ、Ⅱ、Ⅲ及VPS4这5种复合物及一些辅助蛋白构成。Hrs存在于ESCRT-0中,其FIVE模序在笼形蛋白聚合中起重要作用,对泛素化的膜蛋白进行识别和分选[5,6]。
ESCRT复合体中,Tsg101、Vps37A和Did2都是抑癌因子。研究表明,敲除小鼠的Tsg101基因,就不会表现出抑癌活性,但在黑腹果蝇(Drosophila melanogaster)体内,ESCRT-Ⅰ复合体和ESCRT-Ⅱ复合体也起抑制肿瘤的作用。表达突变型ESCRT-Ⅰ复合体或ESCRT-Ⅱ复合体可诱发肿瘤形成,这可能与突变细胞产生了过量的细胞因子有关,细胞增殖受到了持续的刺激所致[7]。
本研究通过下调结肠癌细胞系中Hrs的表达,检测细胞增殖和凋亡情况,发现Hrs可以抑制结肠癌细胞的生长曲线,抑制其增殖和活性,增加其凋亡,证明Hrs与结肠癌细胞的凋亡和增殖过程密切相关。证明低表达Hrs影响了ESCRT-0复合体对泛素化膜蛋白的分选功能,影响了其循环途径,致使其不能回到质膜或胞质中。同时,Hrs的低表达影响了ESCRT-0的功能,影响了对ESCRT-Ⅰ的招募,进而影响了ESCRT-Ⅱ的招募,影响内体膜的内陷与质膜的裂解。这些过程均与肿瘤细胞的增殖相关,Hrs可能通过该机制影响了其增殖与细胞活性,对凋亡产生影响。但该机制具体的信号路径尚须进一步研究细化,以期得到详细的分子机制。
[1]Nahas SC,Nahas CS,Bustamante-Lopez LA,et al.Prognostic factors of surgically-treated patients with cancer of the right colon:a ten years'experience of a single universitary institution[J].Arq Bras Cir Dig,2015,28(1):3-7.
[2]Halwani Y,Kojic LD,Chan SK,et al.Prognostic significance of autocrine motility factor receptor expression by colorectal cancer and lymph node metastases[J].Am J Surg,2015,209(5):884-889.
[3]Katzmann DJ,Babst M,Emr SD.Ubiquitin-dependent sorting into the multivesicular body pathway requires the function of a conserved endosomal protein sorting complex,ESCRT-I[J].Cell,2001,106(2):145-155.
[4]Edgar JR,Eden ER,Futter CE.Hrs-and CD63-dependent competing mechanisms make different sized endosomal intraluminal vesicles[J].Traffic,2014,15(2):197-211.
[5]Goliand I,Nachmias D,Gershony O,et al.Inhibition of ESCRT-Ⅱ-CHMP6 interactions impedes cytokinetic abscission and leads to cell death[J].Mol Biol Cell,2014,25(23):3740-3748.
[6]Adell MA,Vogel GF,Pakdel M,et al.Coordinated binding of Vps4 to ESCRT-III drives membrane neck constriction during MVB vesicle formation[J].J Cell Biol,2014,205(1):33-49.
[7]Raiborg C,Stenmark H.The ESCRT machinery in endosomal sorting of ubiquitylated membrane proteins[J].Nature,2009,458(7237):445-452.
(编辑 王又冬)
EffectsofHrson Apoptosisand CellProliferation in Colon Cancer CellLines
SUNJian-xiu,LIXuan
(DepartmentofVascularand Thyroid Surgery,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo study the effects of Hrs on apoptosis and cell proliferation in colon cancer cell lines HCT-116 and SW-480.MethodsThe expression of Hrs in HCT-116 and SW-480 was knocking down by shRNA.Cell apoptosis was detected by FACS and cell proliferation was determined by MTT,incucyte and soft agar.ResultsThe apoptosis was significantly increased after Hrs knocking down in both HCT-116 and SW-480,and the cellproliferation was inhibited.ConclusionHrs isinvolved in the apoptosis and proliferation ofcolon cancercells.
Hrs;colon cancer cell;apoptosis;proliferation
R735
A
0258-4646(2015)07-0585-03
国家自然科学基金(81170295)
孙建秀(1980-),女,护师,本科.
李璇,E-mail:lxaozhsh@163.com
2015-02-22
网络出版时间:

