支原体肺炎患儿心肌损害与支原体抗体滴度的相关性分析
柴玲彦,赵 红,刘连凤,刘彦霞,杨秀丽
(河北省石家庄市第六医院,河北 石家庄 050000)
支原体肺炎患儿心肌损害与支原体抗体滴度的相关性分析
柴玲彦,赵 红,刘连凤,刘彦霞,杨秀丽
(河北省石家庄市第六医院,河北 石家庄 050000)
目的 探讨心肌损害与肺炎支原体抗体滴度的关系。方法 将100例肺炎支原体肺炎患儿分成2组,肺炎支原体抗体滴度>1∶160为观察组,肺炎支原体抗体滴度≤1∶160为对照组,比较2组患儿心肌酶谱检测结果及心电图情况。结果 观察组心肌酶谱异常例数及数值、心电图异常例数均明显高于对照组(P均<0.05)。结论 肺炎支原体肺炎抗体滴度高的患儿应及早行心肌酶谱及心电图检测,警惕心肌损害的发生。
肺炎支原体肺炎;支原体抗体滴度;心肌损害
肺炎支原体肺炎发病率近几年呈增高趋势,常见于儿童和青少年,近年发现婴幼儿发病明显增多。该病全年均可发生,秋、冬多见,缓慢起病,潜伏期2~3周,病初可有乏力、头痛等症状,后出现发热,多为高热,咳嗽明显,病初干咳,后转为顽固性剧烈咳嗽,有痰,少数患儿可有类百日咳样痉挛样咳嗽,肺部体征不明显,故体征与高热、剧咳等临床表现不一致是本病的重要特征之一。该病的另一特征是X射线示肺部阴影多变,呈游走性浸润或云雾状浸润影。婴幼儿多急性起病,病情重,病程长,治疗困难,可有脑膜炎、肾炎、溶血性贫血、心肌炎、格林-巴利综合征肺外表现。其肺外并发症对患儿健康影响极大,已逐渐引起临床医生关注。心肌损害是常见的肺外并发症,常见症状为长叹气、气短,部分年长儿可诉心前区不适、胸闷,活动后疲乏或无症状,没有明显阳性体征,部分可有心动过速或心动过缓、早搏。实验室检查血清心肌酶、肌钙蛋白可升高,心电图异常等。如不及时治疗可发生严重心律失常、心力衰竭、心源性休克甚至猝死等,严重影响患儿身心健康。然而支原体肺炎心肌损害与支原体抗体滴度高低的相关性有待进一步研究。本研究对支原体肺炎患儿进行支原体抗体滴度、心肌酶谱检测及心电图检查,旨在探讨支原体抗体滴度和心肌损害的关系,为治疗提供可靠依据。
1 临床资料
1.1 一般资料 选择2012年12月—2014年12月我院儿科收治的支原体肺炎患儿100例 ,均符合《诸福棠实用儿科学》支原体肺炎诊断标准[1]。其中男48例,女52例;年龄4个月~3岁33例,>3岁~13岁67例。心肌损害情况根据1999年全国小儿心肌炎,心肌病学术会议制定的小儿病毒性心肌炎诊断标准[2],不符合心肌炎诊断标准,但有下列指标异常之一者诊断为心肌损害:①血清心肌酶升高,肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、α-羟丁酸脱氢酶(HBDH)急性期均可升高;②肌钙蛋白升高;③心电图异常,可出现各种类型的心电图异常表现,常见轻微T波改变、ST段偏移、QRS低电压、心律失常(如早搏、房室传导阻滞等)。剔除先天性心脏病、中毒性心肌炎、风湿性心肌炎、原发性心肌病、先天性房室传导阻滞、原发性心内膜弹力纤维增生症、心脏自主神经功能异常、支气管肺发育不良、中度以上贫血、严重佝偻病或免疫缺陷等疾病者。将患儿按肺炎支原体抗体滴度分成2组:肺炎支原体抗体滴度>1∶160的52例为观察组,其中男25例,女27例;年龄5个月~13岁;肺炎支原体抗体滴度≥1∶1 280者18例, 1∶640者26例,1∶320者8例。肺炎支原体抗体滴度≤1∶160的48例为对照组,男23例,女25例;年龄4个月~11岁;肺炎支原体抗体滴度1∶160者25例,肺炎支原体抗体滴度1:80者23例。
1.2 方法 住院患儿均于入院第2天取静脉血行心肌酶谱检测,病程第7—10天行肺炎支原体抗体滴度检测,治疗10d后复查。所有标本均在同一台全自动生化仪上进行分析检测,应用荷兰威图Selectra-XL全自动生化仪,LDH、HBDH、CK采用速率法检测,CK-MB采用免疫抑制法检测。特异性免疫凝集试验检测患儿微量外周血清IgM抗体,试剂为湖南永和阳光科技有限责任公司生产。正常参考值为CK0.5~192IU/L,CK-MB0~25IU/L,LDH80~285IU/L,HBDH72~182IU/L,肺炎支原体抗体滴度>1∶80为阳性。从开始就诊连续3d描记心电图,以后每周1次,由专人操作。

2 结 果
2.1 2组心肌酶异常例数比较 观察组心肌酶异常例数显著高于对照组(P<0.01)。见表1。
2.2 2组血清心肌酶检测结果比较 观察组血清心肌酶谱检测数值明显高于对照组(P<0.001)。见表2。
2.3 2组心电图检测情况比较 观察组心电图异常23例(44%),其中ST—T改变11例,窦性心动过速9例,室性早搏3例;对照组心电图异常8例(10%),其中ST—T改变3例,窦性心动过速4例,Ⅰ度房室传导阻滞1例。观察组心电图异常率高于对照组(P<0.05)。
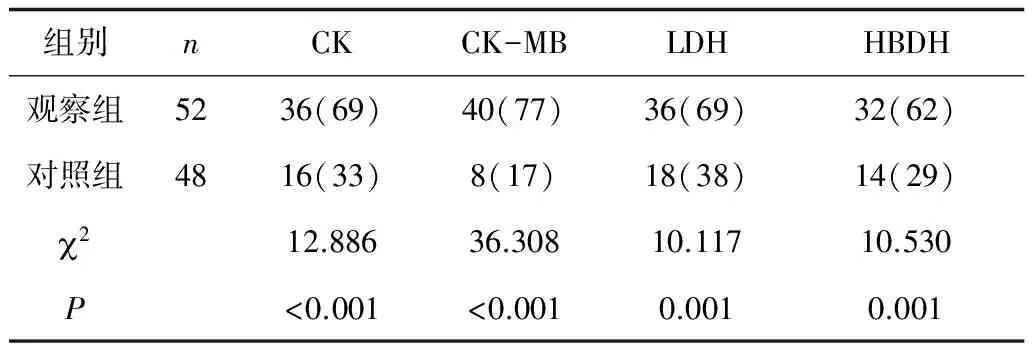
表1 2组心肌酶异常例数比较 例(%)

表2 2组血清心肌酶检测结果比较
3 讨 论
肺炎支原体是一种介于细菌和病毒之间的病原微生物,无细胞壁结构,兼性厌氧,能独立生存并进行自我复制,呈球形、丝状杆状等多种形态,革兰染色阴性,是儿童社区获得性肺炎的常见病原。肺炎支原体肺炎由肺炎支原体引起,多由口、鼻分泌物经空气进行传播,可引起散发和小流行。病原体通常存在于呼吸道纤毛上皮之间,不侵入肺实质,通过细胞膜上的神经氨酸受体位点吸附于宿主呼吸道上皮细胞表面,抑制纤毛活动并破坏上皮细胞。该病的症状轻重不一,有些患者可无显著病状而在体检时发现。多数患者除全身一般感染性症状外,常伴头痛、刺激性咳嗽等,经有效治疗多在2周左右临床痊愈。部分肺炎支原体感染可导致毛细支气管炎,其所致感染占毛细支气管炎的29%[3]。国内资料统计支原体肺炎的发病率占社区获得性肺炎的10%~30%,且逐年上升,国外文献报道为50%[4]。它不但引起肺部感染,而且引起肺外表现,导致机体多脏器的损伤,心肌损害是其常见的并发症,约占肺外并发症的26.4%[5]。
目前,支原体肺炎发病机制倾向于免疫学机制、上皮细胞吸附与直接损害。肺炎支原体抗原与人体多种组织器官存在部分共同抗原,在感染过程中可产生肺、脑、心肌细胞等的自身抗体,抗原抗体反应可引起靶器官病变而出现相应的症状;肺炎支原体通过其顶端的特殊结构尤其是P1黏附蛋白和呼吸道上皮细胞表面的受体紧密结合,吸附在宿主细胞表面,避免吞噬细胞的吞噬和黏膜纤毛的清除。在吸附过程中,肺炎支原体增殖时产生的神经毒素、磷脂酶、过氧化物、超氧离子使气道黏膜的完整性遭到破坏,纤毛运动受抑制,使宿主细胞受损、坏死及脱落,呼吸道清理功能受影响。肺外损伤机制不明,但可以明确的是,所有肺外表现的发病机制不可能用单一的病因解释。可能存在的3条途径为细胞因子、免疫调节以及血管闭塞[6-7],其中起重要作用的是免疫学发病机制。多项研究表明细胞免疫及体液免疫在肺炎支原体肺炎的肺外并发症中起重要作用,支原体肺炎患儿为有多系统并发症者,血清中免疫活性物质如IgG、IgA、IgM持续增高,CD4细胞降低,而CD8细胞显著升高,IL-2、IL-6、IL-10、TNF-α、γ-干扰素在体内含量增多,由此导致免疫紊乱,心肌细胞膜受损,酶释放增多[8-10]。除此之外,肺炎时缺氧缺血造成心肌细胞膜损伤,心肌酶逸出,导致血清中心肌酶活性升高;病原体释放的毒素直接或间接损伤细胞结构,使心肌细胞酶的释放增多;支原体肺炎患儿体内超氧化物歧化酶活性减低,清除能力下降,致使自由基参与到其病理过程之中,造成细胞损伤线粒体氧化磷酸化作用发生改变,心肌酶释放增加。心肌酶属于胞浆酶,CK敏感性高特异性差,CK-MB对判断是否心肌损害有高度特异性,它在心肌中有很高的含量,几乎不存在于其他组织中,能占到心肌总CK的14%[11],血清CK-MB正常时不超过总活性的5%,当心肌受到损害时在6h内可急剧上升,持续24h以上。LDH、HBDH存在于许多组织器官中,临床上多种疾病都可检测到这些酶升高,因此,仅有LDH、HBDH单独升高不能说明心肌损害,而以CK-MB为主要指标。
轻症肺炎支原体感染有一定的自限性,但随着小婴儿发病率增高和重症支原体肺炎的增多,应及时进行有效的抗支原体治疗。常用的抗生素包括大环内酯类、四环素类、氨基糖苷类、喹诺酮类,因明显的耳肾毒性,氨基糖苷类儿童应避免使用。喹诺酮类因影响骨骼发育,生长发育期的患儿不宜应用。8岁以下的儿童禁用四环素类抗生素,因为其可引起牙齿黄染和牙釉质发育不全。因此治疗支原体肺炎常以大环内酯类为主,常用红霉素和阿奇霉素。阿奇霉素作为新一代的大环内酯类抗生素,具有抗菌谱广、耐受性与依从性好的特点,已作为治疗支原体感染的首选用药。目前已合成了对耐药菌有效的第三代大环内酯类抗生素,如酮内酯类的泰利霉素、噻霉素,但尚无儿童应用的报道。对合并心肌损害的患儿常用磷酸肌酸治疗,磷酸肌酸是一种新型的心肌保护剂,可为机体直接提供能量[12]; 保护细胞膜免受损伤;可为心肌细胞提供化学能源储备,保护缺血心肌,增强心肌收缩力,维持正常血压,但对于重症患儿应用丙种球蛋白可缩短病程,提高疗效,促进患儿早日康复[13]。
本研究中,观察组血清CK、CK-MB、LDH、HBDH异常率及数值均明显高于对照组,心电图异常数高于对照组。说明支原体肺炎患儿易出现不同程度的心肌酶升高,心电图异常,并且心肌酶值升高、心电图异常数和支原体抗体滴度成正相关。所以,临床中对支原体肺炎抗体滴度高的患儿应及早行心肌酶、心电图检查,以便早发现早治疗,减少心肌损害的发生。
[1] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:1204-1205
[2] 范毅敏,覃丽君,甄宇峰.磷酸肌酸钠治疗小儿肺炎支原体感染心肌损害的疗效观察[J].广东医学,2009,30(4):619
[3] 崔雁,毛金龙.肺炎支原体感染致毛细支气管28例分析[J].现代中西医结合杂志,2010,19(32):4155-4156
[4] 沈小明,王卫平.儿科学[M].7版.北京:人民卫生出版社,2008:280
[5] 刘金美.小儿支原体肺炎106例临床分析[J].实用医技杂志,2006,13(1):112-113
[6]NaritaM.PathogenesisofextrapulmonarymanifestationsofMycoplasmapneumoniasinfectionwithspecialreferencetopneumonia[J].JInfectChemother,2010,16(3):162-169
[7] 陈志敏.肺炎支原体肺炎的再认识-从发病机制到临床治疗的探讨[J].中国实用儿科杂志,2012,27(4):254-255
[8] 赵慧芳,刘晓红.小儿肺炎支原体肺炎的细胞免疫功能变化[J].中国实用儿科杂志,1998,13(3):166
[9] 钱嘉林,矍介明.IL-18与TH1细胞因子在成人肺炎支原体肺炎发展中的作用[J].国外医学呼吸系统分册,2002,22(6):333-334
[10]HardyRD,JafriHS,OlsenK,etal.Elevatedcytokineandchemokinelevelsandprolongedpulmonaryairflowrcsistanceinamurine.Mycoplasmapncumoniamodel:amicrobiologic,histologicimmunologicandrespiratoryplethysmographicprofile[J].InfectImmun,2001,69(6):3869-3876
[11] 王喜栋,赵捷,张晋霞.心肌酶谱与心肌损伤标志物在急性心肌梗死诊断中的价值[J].河北医科大学学报,2011,32(8):9
[12] 侯立向.一种心肌保护剂:磷酸肌酸[J].生物化学与生物物理进展,2003,30(2):134-136
[13] 栾桂珍,高彬昌.丙种球蛋白治疗小儿支原体肺炎合并心肌损害的疗效观察[J].现代中西医结合杂志,2006,15(16):2164-2165
石家庄市科学技术研究与发展指导计划课题(131461053)
10.3969/j.issn.1008-8849.2015.20.011
R563.1
B
1008-8849(2015)20-2200-03
2015-01-12

