壳聚糖-端羧基聚酰胺胺接枝物的合成与性能
张晓洋,赵 峻,姚芳莲
(天津大学化工学院教育部生物工程系统重点实验室,天津300072)
壳聚糖(CS)是自然界唯一的碱性天然多糖,是由 β-(1→4)-2-氨基-2-脱氧-D-吡喃葡萄糖(GlcN)和 β-(1→4)-2-乙酰氨基-2-脱氧-D-吡喃葡萄糖(GlcNAc)重复单元组成的线型共聚物,化学结构和性质与纤维素相似。由于具备来源丰富、良好的生物相容性、低免疫原性、抗肿瘤性等生物活性,CS被广泛用于药物释放和基因转染领域[1]。然而,CS的低水溶性限制了它的使用[2]。改性后的水溶性 CS则可以增强CS在水中的稳定性,同时减小了药物缓释载体和基因转染过程中由于内涵体酸化可能带来的细胞毒性。
以乙二胺为核的聚酰胺胺树枝状大分子(PAM-AM)是一类新型的高支化大分子,具有纳米级分子尺寸、结构和尺寸可控、以及低分散性等独特性能[3-4]。PAMAM内部还有空穴以及表层有众多功能性端基。因此,PAMAM可以用作低水溶性药物的增溶剂和生物活性物质的输送载体[5-6]。但是树枝状大分子通常具有代数依赖性的细胞毒性,即代数越高,毒性越强[7]。将生物相容性好的天然高分子引入低代数PAMAM是降低其细胞毒性的一种理想手段[8]。
本研究目的是制备以CS和PAMAM为原料的接枝物,合成的接枝物具备自组装成为核壳结构纳米粒的能力。这种新型的核壳结构纳米颗粒可以作为药物纳米载体,对生物活性分子进行包覆以及释放,可能在生物医学领域有潜在的应用前景。端羧基PAMAM对CS进行接枝改性的合成路线为:

1 实验部分
1.1 原料
壳聚糖(CS),相对分子质量20万,脱乙酰度85%,青岛海汇生物制品有限公司;EDC,分析纯;NHS,分析纯;上海吉尔生化有限公司;乙二胺(EDA),除水后使用;丙烯酸甲酯(MA),除水后使用;HCl,质量分数36% ~38%;甲醇,分析纯;天津市江天化工技术有限公司;实验用水为超纯水。
1.2 CS-g-PAM AM的合成
本实验是以乙二胺和丙烯酸甲酯为原料,合成端酯基PAMAM树枝状分子,然后对其末端的酯基进行水解反应制得端羧基的PAMAM,最终通过CS与端羧基PAMAM之间的酰胺化反应得到目标产物CS-g-PAMAM。
1.2.1 端酯基PAM AM的合成
在0℃冰水浴,氮气保护,搅拌条件下,将91.2 g丙烯酸甲酯(1.06 mol)与 7.92 g乙二胺(0.132 mol)相互混合,搅拌10 min后,缓慢滴入125 m L无水甲醇。之后,将温度升高至35℃,避光搅拌反应21 h。反应结束后,于50℃旋转蒸发除去未反应的丙烯酸甲酯与甲醇,得到端酯基PAMAM。
1.2.2 端羧基PAM AM的合成
称取1.616 g端酯基PAMAM溶于50 m L超纯水中,小心地滴加浓 HCl调节 pH值至2.0,室温下搅拌反应3 d,反应结束后,旋蒸除去多余水分,至淡黄色黏稠液体,然后加入5 mL超纯水,转移至分液漏斗中,用三氯甲烷萃取提纯,冻干即得端羧基PAMAM。
1.2.3 CS-g-PAM AM的合成
按照表1中的数据(表1中投料比为端羧基PAMAM分子与CS上的氨基的物质的量之比),分别称量6种质量的端羧基 PAMAM,EDC,NHS,都加入200 mg CS,再溶于100 m L超纯水中。使用盐酸调节溶液至pH值为3.7,在35℃水浴中搅拌3 d,然后对产物混合液透析3 d,透析完毕之后冻干即得不同投料比的CS-g-PAMAM。

表1 不同投料比CS-g-PAM AM的合成结果Table 1 The synthesis resu lts of CS-g-PAM AM at d ifferen t feeding ratios
2 结果与讨论
2.1 核磁共振谱图分析
如图1为端酯基 PAMAM,端羧基 PAMAM和CS-g-PAMAM的核磁共振谱图。

图1 核磁共振谱图Fig.1 1 H NMR spectra
由图 1a)可见,CH2N(a),NCH2(b),NCH2CH2(c)和 CH2COOCH3(d)的化学位移分别是 3.66,2.80,2.53和 3.63,其中 4种氢的峰面积之比为:Sa∶Sb∶Sc∶Sd=1.00∶2.12∶2.06∶3.18≈1∶2∶2∶3,所有氢原子的数目与理论结构几乎一致。由图1b)可见,CH2N(a),NCH2(b),NCH2CH2(c)和 CH2COOH(d)的化学位移分别为 3.74,2.88,3.48和 4.70,这些峰的位置和以前的研究结果[9]一致。水解后由于氢键效应和溶剂效应的影响,化学位移向高场移动。在4.68处出现强峰,这是由于溶剂D2O中的D与COOH中的H发生活泼氢的快速交换作用[9],羧酸氢在9~13范围内的氢峰被覆盖,而生成的HOD中的质子在化学位移为4.7左右出现信号峰,由此可知,端羧基PAMAM合成成功。
如图1c)所示,CS-g-PAMAM接枝物与端羧基PAMAM相比较[图2b)],在化学位移3.84~3.40,2.90和1.80处分别出现了新峰,它们分别归属于CS结构单元上的H-34,5,6,H-2和乙酰基团产生的质子峰,这些峰的位置和以前的研究结果一致[10]。值得注意的是与CS通过酰胺键相连的NCH2CH2(d)与没有与CS通过酰胺键相连的NCH2CH2(c)相比,化学位移会向低场移动,而NCH2CH2(c)与羧基相连,化学位移较高。而且由图2 c)可见,CH2N(a,3.23),NCH2(b,2.47),NCH2CH2COOH(c,3.13),NCH2CH2CONH(d,1.95),4 种氢的峰面积之比为:Sa∶Sb∶Sc∶Sd=2.00∶4.12∶3.24∶0.96≈2∶4∶3∶1,所有氢原子的数目与理论结构几乎一致。根据NCH2CH2(d)处与NHCOCH3(7)处的峰面积计算出当投料比(端羧基PAMAM分子与CS上的氨基的物质的量之比)为1/15时,端羧基PAMAM对于CS的取代度为4.0%(若反应时投入的端羧基PAMAM都被接枝到CS分子链上,其理论取代度为5.7%)。
2.2 TG与DTA分析
图2为 CS和CS-g-PAMAM的TG,DTA曲线。

图2 TG和DTA曲线Fig.2 TG and DTA curves for
从图2a)中可以看出,CS失重过程主要分为2个阶段,第1个阶段从25℃到105℃,失重率为8.76%,这一阶段的DTA曲线在69.7℃出现吸热峰,这是由于 CS在该阶段失去吸热结晶水所致。第2阶段是260℃~340℃,CS失重率达46.24%,在此阶段,相应的 DTA曲线在311.0℃出现放热峰,应该是CS发生氧化反应而导致。
相对而言,CS-g-PAMAM的DTA曲线[图2b)]在61.5℃处出现吸热峰,开始失去结晶水。CS-g-PAMAM除了在313.1℃出现放热峰,发生氧化反应并放热。在577.3℃处又出现放热峰,这一放热峰很有可能是由于所接枝的端羧基PAMAM被氧化分解引起的。
综合图2a)和图2b)可以发现,CS以及 CS-g-PAMAM的热行为曲线有显著的差异,这也间接说明端羧基PAMAM被成功接枝到了CS分子链上。
2.3 投料比影响分析
室温下,使用不同投料比制备而成的 CS-g-PAMAM配置成1 g·L-1的水溶液,其水溶性变化如表1所示。当投料比低于1∶15时,接枝物不溶于水,这主要是引入的基团(端羧基PAMAM)过少,不足以破坏CS分子链之间的氢键作用,因此对CS的水溶性没有显著的改变。随后对于 1∶5,1∶10,1∶15这3种投料比条件下制备而成的具有良好水溶性接枝物进行粒径测试,结果如图3所示。
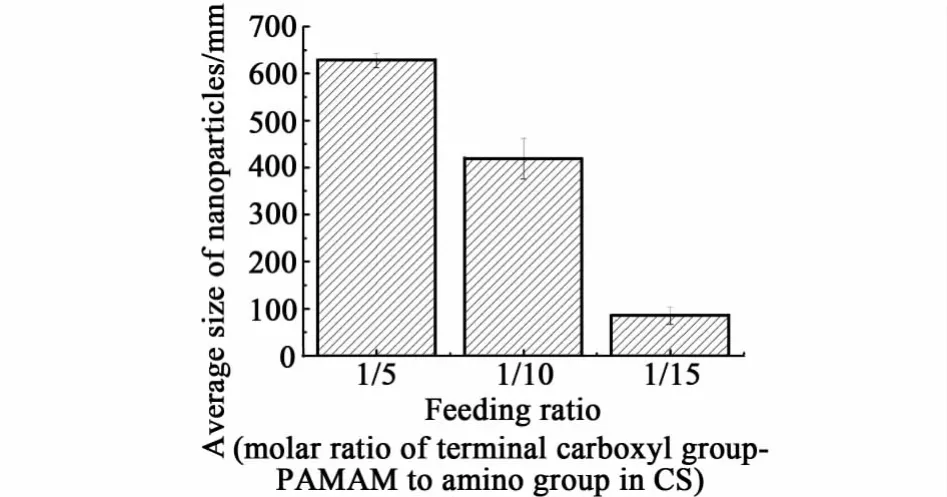
图3 不同投料比(端羧基PAMAM分子与CS上的氨基的物质的量之比)制备的CM-g-PAM AM纳米颗粒的尺寸分布Fig.3 Size distribution of CS-g-PAM AM nanoparticles p repared at different feeding ratios(m olar ratios of term inal carboxyl group-PAM AM to am ino group in CS)
从图3可以看出,在合成 CS-g-PAMAM过程中,当投料比为1∶15时,生成的纳米粒子粒径为90 nm。此时,接枝到CS的端羧基PAMAM恰好可以产生驱动力(氢键作用和疏水作用),自组装成为核壳型纳米粒子。投料比高于1∶15时,生成的纳米粒子尺寸大于400 nm,这主要是由于PAMAM带有多个可反应的端羧基,所以过多的端羧基 PAMAM会导致这些分散的核壳型CS-g-PAMAM纳米粒子进行交联反应,结果生成较大尺寸的纳米粒子。有研究证明尺寸较小的纳米粒子相对于那些尺寸比较大的纳米粒子比较难被吞噬细胞吞入,作为药物释放载体更有优势[11-12]。所以我们确定合成CS-g-PAMAM的最适宜投料比为1∶15,实验测试中所用的 CS-g-PAMAM都为1∶15投料比条件下制备而成的。
2.4 CS-g-PAM AM纳米粒子形态观察
通过TEM观察了CS-g-PAMAM纳米粒的形貌,如图4所示。

图4 CS-g-PAM AM纳米粒子的TEM图片Fig.4 TEM images of CS-g-PAMAM dendrimer nanoparticles
从TEM照片可以清楚的看到CS-g-PAMAM接枝物形成了分散较好的球形纳米粒。此外,我们也观察到了个别纳米粒的聚集现象。这是由两方面造成的:第一,纳米粒的表面能较高,相互聚集可以降低表面能,所以那些表面电荷较少的纳米粒之间可能发生聚集;第二,CS外壳上有羟基和氨基的存在,因此带来的分子间氢键作用也是纳米粒聚集的重要原因。
2.5 CS-g-PAM AM纳米粒子的成球机理
CS-g-PAMAM核壳结构纳米颗粒形成过程如图5所示。

图5 CS-g-PAM AM自组装成核壳型纳米粒子的示意图Fig.5 Process of CS-g-PAM AM dend rim ers self-assem b le in to core-shell nanoparticles
在生理pH值的条件下(pH=7.4),支链PAMAM上面大量的端羧基都不会电离,这些大量不电离的羧基相互之间会产生非常强的氢键作用,端羧基PAMAM树枝状大分子还会作为疏水核存在于纳米粒子的内部。所以端羧基PAMAM产生的疏水作用和氢键作用对于整个CS-g-PAMAM核壳结构纳米颗粒的形成起着非常关键的作用。
3 结论
1)合成了端羧基PAMAM,然后通过CS的胺基与端羧基PAMAM的羧基之间的酰胺缩合反,成功合成了CS-g-PAMAM接枝物。
2)通过考察不同CS-g-PAMAM接枝物溶解性和生成纳米粒子的大小确定了合成过程的最适宜投料比。
3)TEM实验结构表明,CS-g-PAMAM为球形纳米颗粒,粒径大约为90 nm。
4)提出了CS-g-PAMAM的成球理论,认为通过氢键和疏水作用的驱动,CS-g-PAMAM可以自组装成以CS为壳,端羧基PAMAM为核的CS-g-PAMAM核壳结构纳米粒子。
[1]Xiao B,Wan Y,Wang X,et al.Synthesis and characterization of N-(2-hydroxy)propyl-3-trimethyl ammonium chitosan chloride for potential application in gene delivery[J].Colloids and Surfaces B:Biointerfaces,2012,91:168-174
[2]Sajomsang W,Ruktanonchai U R,Gonil P,et al.Mucoadhesive property and biocompatibility of methylated N-aryl chitosan derivatives[J].Carbohydrate Polymers,2009,78(4):945-952
[3]Esfand R,Tomalia D A.Poly(amidoamine)(PAMAM)dendrimers:From biom imicry to drug delivery and biomedical applications[J].Drug Discovery Today,2001,6(8):427-436
[4]Tomalia D A.Birth of a new macromolecular architecture:Dendrimers as quantized building blocks for nanoscale synthetic polymer chemistry[J].Progress in Polymer Science,2005,30(3):294-324
[5]Ma M,Cheng Y,Xu Z,et al.Evaluation of polyamidoamine(PAMAM)dendrimers as drug carriers of anti-bacterial drugs using sulfamethoxazole(SMZ)as a model drug[J].European journal of medicinal chemistry,2007,42(1):93-98
[6]Balogh L,Swanson D R,Tomalis D A,et al.Dendrimer-Silver complexes and nanocomposites as antimicrobial agents[J].Nano Letters,2001,1(1):18-21
[7]Boas U,Heegaard PM H.Dendrimers in drug research[J].Chemical Society Reviews,2004,33(1):43-63
[8]Meyers SR,John F S,Griset A P,et al.Anionic amphiphilic dendrimers as antibacterial agents[J].Journal of the American Chem ical Society,2008,130(44):14 444-14 445
[9]胡加娟,郭秀生,于德梅.半代聚酰胺-胺树状聚合物的酸性水解及性能研究[J].工程塑料应用,2011,39(1):4-8 Hu Jiajuan,Guo Xiusheng,Yu Demei.Acid hydrolysis and performance measurement of half generation polyamidoamine dendrimers[J].Engineering Plastics Application,2011,39(1):4-8(in Chinese)
[10]Hitoshi S,Hirufumi Y,Seiichi A.Synthesis of a chitosan dendrimer hybrid and its biodegradation[J].Biomacromolecules,2003,4:1 244-1 249
[11]Vonarbourg A,Passirani C,Saulnier P,et al.Parameters influencing the stealthiness of colloidal drug delivery systems[J].Biomaterials,2006,27:4 356-4 373
[12]Vonarbourg A,Passirani C,Saulnier P,et al.Evaluation of pegylated lipid nanocapsules versus complement system activation and macrophage uptake[J].Journal of Biomedical Materials Research PartA,2006,78:620-628

