硼改性Cu/Al2 O3催化甘油氢解反应合成1,2-丙二醇
石 恒,赵兰兰,陈吉祥
(天津大学化工学院,天津 300072)
甘油氢解制备1,2-丙二醇是甘油利用的有效途径之一。甘油氢解的关键技术为催化剂。目前,研究者们所关注的催化剂主要包括贵金属[1-2]、镍[3]及铜催化剂[3-6]。贵金属及镍基催化剂甘油氢解活性较高,但同时具有较高的C-C键氢解活性,从而降低了丙二醇选择性[2-3]。铜基催化剂具有C-O键氢解活性高而C-C键氢解活性低的特点,因而极具应用前景。甘油氢解催化剂通常具有金属/酸双功能性。在甘油氢解反应中,甘油先在酸性中心上脱水生成丙酮醇,丙酮醇再在金属中心上加氢生成1,2-丙二醇。载体是影响催化剂酸性的重要因素。Al2O3载体应用广泛,其负载Cu催化剂具有较好的甘油氢解反应性能[7-8]。Guo等[7]研究表明,Cu/γ-Al2O3催化剂的甘油氢解活性高于HY、13X、HZSM-5和Hβ等分子筛负载 Cu催化剂,这与分子筛载体酸性强、催化甘油脱水生成丙烯醛而非丙酮醇有关。然而,γ-Al2O3酸性较弱。本课题组前期工作表明[9],采用磷改性提高了 Cu/Al2O3催化剂酸量、改善了其甘油氢解反应性能。有研究表明,硼改性不仅可以调节 Al2O3表面酸性[10],还会影响金属活性组分(如 Mo)在其表面的存在环境[11]。然而,硼对 Cu/Al2O3结构及其对甘油氢解反应性能的影响尚未见报道。
本研究采用硼对Cu/A l2O3催化剂进行了改性,考察了硼含量、Cu与B的浸渍次序对催化剂结构和甘油氢解性能的影响,分析了硼改性对催化剂性能影响的因素。
1 试验部分
1.1 催化剂制备
采用分步等体积浸渍法制备硼改性Cu/Al2O3催化剂。首先,以不同浓度 H3BO3溶液浸渍 γ-Al2O3(20~40目,温州氧化铝厂),室温晾干后经120℃干燥12 h、500℃焙烧4 h制备得到改性载体(标记为B-Al2O3);然后,用Cu(NO3)2溶液浸渍改性载体,经120℃干燥12 h、500℃煅烧4 h制得改性催化剂(标记为 Cu/x B-Al2O3),其中 x表示 B质量分数(x%)。采用先浸渍Cu组分再浸渍B组分的方法制备了1.0B-Cu/Al2O3催化剂 (B质量分数1.0%),每次浸渍后都经晾干、120℃干燥12 h和500℃焙烧4 h。此外,采用等体积浸渍法还制备了未改性的Cu/Al2O3催化剂。各催化剂中Cu质量含量均为10%。
1.2 催化剂表征
采用 Quantachrome公司 QuadraSorb SI型吸附仪测定催化剂宏观物性。采用德国布鲁克AXS公司D8 Focus型多晶粉末衍射仪进行X射线衍射(XRD)测试,Cu_Kα(λ=0.15406 nm)辐射源。采用美国Thermo Fisher公司Nicolet 380型红外光谱仪进行FT-IR测试。采用Lambda 750S型紫外可见分光光度计进行紫外-可见光谱(UV-Vis)分析,用BaSO4为参比扣除背景。采用 H2程序升温还原(H2-TPR)对催化剂前躯体还原性能进行表征,采用NH3程序升温脱附(NH3-TPD)法表征催化剂酸性,测试步骤同文献[9]。催化剂表面Cu面积(SCu)采用N2O解离吸附法测定,具体步骤同文献[9]。
1.3 催化剂评价
催化剂活性评价采用不锈钢固定床反应器。催化剂在270℃用H2恒温还原3 h后降温至220℃,将H2压力提升至3.0 MPa,用微量进料泵将质量分数为60%的甘油水溶液打入反应器进行反应,n(H2)/n(甘油)为 20,甘油重时空速为 2.0 h-1。液相产物采用北京分析仪器厂SP-3420型气相色谱仪(PEG-20M毛细管柱和氢火焰离子化检测器)进行定量分析。
2 结果与讨论
2.1 催化剂表征
表1给出了硼改性前后催化剂宏观物性性质。随B含量提高,催化剂的比表面及孔容均降低,这与浸渍的B物种堵塞载体孔道有关。

表1 B改性Cu/A l2 O3催化剂的性质Table 1 Properties of B m od ified Cu/A l2 O3 catalysts
图1为不同催化剂的XRD谱。还原前后Cu/Al2O3和 Cu/0.3B-Al2O3样品的 XRD图中分别有CuO和金属Cu的衍射峰,而还原前后硼质量含量为1%~3%样品的XRD谱图中没有发现CuO及金属Cu的衍射峰。因此,先浸渍B对Cu/A l2O3进行改性可以提高Cu的分散程度。与Cu/1.0B-Al2O3不同,还原前后的1.0B-Cu/Al2O3样品中分别检测到了CuO和Cu,说明先浸渍B后浸渍Cu更有利于促进Cu的分散。

图1 还原前后催化剂的XRD图Fig.1 XRD patterns of catalysts before and after reduction
采用FTIR和UV-Vis表征了催化剂氧化态前驱体中B和Cu的存在状态。图2为催化剂氧化态前驱体的FTIR谱图。1 500~1 200 cm-1和1 100~1 000 cm-1处的吸收峰分别归属于和中B-O键的不对称伸缩振动[12]。随 B含量的提高,1 100~1 000 cm-1处吸收峰强度变化不明显,而1 500~1 200 cm-1之间的吸收峰强度有所增强,表明B物种含量较高时主要以存在。

图2 未还原催化剂样品的FT-IR谱Fig.2 FT-IR spectra of unreduced catalysts
图3 为各催化剂氧化态前驱体的UV-Vis谱图。255 nm处吸收峰归属于分散Cu2+与表面O2-之间的电荷跃迁[9]。随B含量的提高,该处吸收峰的相对强度提高并发生红移,表明Cu2+分散程度提高、CuO晶粒减小[13]。此外,400~600 nm处吸收峰可能与游离态CuO颗粒有关[9]。
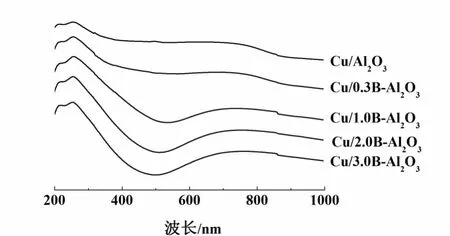
图3 未还原催化剂样品的UV-Vis谱Fig.3 UV-V is absorp tion spectra of unreduced catalysts
图4 为催化剂氧化态前驱体的H2-TPR图。经B改性后催化剂的还原性能发生很大变化。Cu/Al2O3在205和260℃处的还原峰分别对应高分散的 Cu2+离子及 CuO颗粒的还原[14]。与 Cu/Al2O3相比,Cu/0.3B-Al2O3催化剂的低温及高温还原峰分别向高温及低温方向偏移,说明B与铜物种之间产生作用、促进了铜物种的分散。硼质量分数为1%~3%的Cu/x B-Al2O3催化剂只有1个还原峰,说明Cu物种存在环境比较均一。随B含量提高,Cu物种的还原难度增加,说明铜与硼物种的相互作用增强。与 Cu/1.0B-A l2O3不同,1.0B-Cu/Al2O3出现2个还原峰,说明先浸渍B后浸渍Cu更有利于促进Cu物种分散。XRD、UV-Vis及H2-TPR结果一致表明,先浸渍B对Al2O3进行改性可以促进Cu分散并提高Cu与B间的相互作用。

图4 不同催化剂前驱体的H2-TPR图Fig.4 H2-TPR p rofiles of catalyst p recu rsors
图5为催化剂氧化态前驱体的NH3-TPD图。与未改性催化剂相比,硼改性催化剂的脱附峰向高温偏移,并且峰面积明显增大(尤其低温峰面积),表明B改性提高了Cu/Al2O3的酸强度及酸量。研究[15]表明,H3BO3容易与 Al2O3表面 Al-OH(尤其是碱性羟基)反应形成Al-O-B-OH基团。B改性提高催化剂表面中强酸酸量可归因于Al-OB-OH基团的形成,而弱酸酸量增大可能与游离的硼酸有关。此外,形成Al-O-B-OH基团还会降低载体表面的等电点[16],有利于 Cu2+离子与 H+通过离子交换形成-B-O-Cu物种,这样既增强了Cu物种与载体的相互作用又促进了铜的分散。
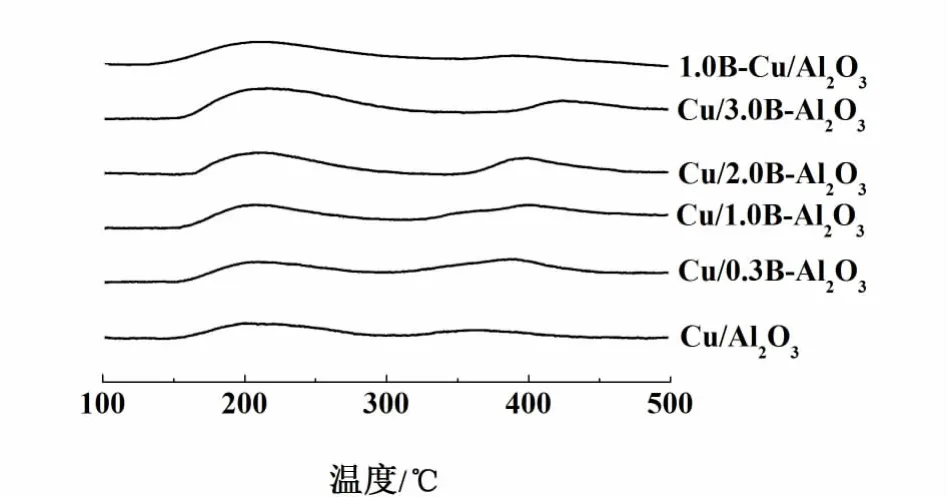
图5 不同催化剂的NH3-TPD图Fig.5 NH3-TPD profiles of different catalysts
各还原态催化剂Cu表面积如表1所示。对于先浸渍B后浸渍Cu系列催化剂,随B含量提高,Cu表面积呈现先增大后减小的趋势。Cu/3.0B-A l2O3催化剂的Cu表面积(1 g Cu表面积为215 m2)低于Cu/Al2O3,可能与Cu和 B物种间的强相互作用导致表面Cu被B物种覆盖有关。
2.2 催化剂甘油氢解反应性能
色谱分析表明,甘油氢解的主要产物为1,2-丙二醇,同时产生少量丙酮醇和乙二醇。图6显示了硼含量对Cu/x B-Al2O3催化剂甘油氢解反应性能的影响。随硼含量提高,甘油转化率及1,2-丙二醇选择性呈现增大趋势,其中硼质量分数为2%的催化剂上甘油转化率及 1,2-丙二醇选择性分别达到99.9%和96.2%。显然,B改性使Cu/Al2O3催化甘油脱水转化为丙酮醇以及丙酮醇加氢的性能得以提高。这与B改性使催化剂的表面酸性及Cu表面积提高存在密切关系。另外,Cu与B物种之间的相互作用也是重要因素。据文献报道,Cu与B物种之间的相互作用有利于促进Cu+的形成,并且随B含量提高Cu+数量增加[17]。Cu0具有吸附活化 H2分子的作用,而Cu+物种作为亲电中心能活化酮基基团[17],故Cu0和Cu+物种之间可形成协同作用而促进甘油氢解反应。
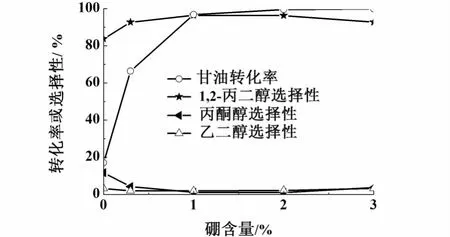
图6 B含量对催化剂甘油氢解性能的影响Fig.6 E ffect of boron content on catalyst per form ance for hyd rogenolysis of glycerol
此外,对比了B和Cu物种浸渍顺序对催化剂甘油氢解性能的影响。1.0B-Cu/A l2O3催化剂上甘油转化率(39.5%)和1,2-丙二醇选择性(88.3%)均高于 Cu/A l2O3,但明显低于 Cu/1.0B-A l2O3,说明先B后Cu的浸渍顺序对提高催化剂的甘油氢解性能更为有利。这与先浸渍B后浸渍Cu所制备的催化剂具有较大酸量和表面Cu面积以及较强B与Cu之间的相互作用有关。
3 结论
B改性可以提高Cu/Al2O3表面酸性及Cu的分散,其中以先浸渍B后浸渍 Cu时效果尤为明显。随B含量提高,改性催化剂中B与Cu物种的相互作用得到增强。但B含量较高会使Cu物种被覆盖,降低暴露Cu的表面积。在甘油氢解反应中,先浸渍B明显提高了Cu/Al2O3上的甘油转化率及1,2-丙二醇选择性。这与催化剂酸性提高及Cu与B之间的强相互作用有关。
[1]冯建,熊伟,贾云,等.Ru/TiO2催化剂上甘油氢解制 1,2-丙二醇[J].催化学报,2011,32(9):1 545-1 549 Feng Jian,Xiong Wei,Jia Yun,et al.Hydrogenolysis of glycerol to 1,2-propanediol over Ru/TiO2catalyst[J].Chinese Journal of Catalysis,2011,32(9):1 545-1 549(in Chinese)
[2]Miyazawa T,Kusunoki Y,Kunimori K,et al.Glycerol conversion in the aqueous solution under hydrogen over Ru/C-An ion-exchange resin and its reaction mechanism[J].JCatal,2006,240(2):213-221
[3]Huang L,Zhu Y,Zhang H,et al.Continuous production of1,2-propanediol by the selective hydrogenolysis of solvent-free glycerol under mild conditions[J].JChem Technol Biotechnol,2008,83(12):1 670-1 675
[4]Kusunoki Y,M iyazawa T,Kunimori K,et al.Highly activemetal-acid bifunctional catalyst system for hydrogenolysis of glycerol undermild reaction conditions[J].Catal Commun,2005,6(10):645-649
[5]李莉,杨娟,于磊,等.甘油氢解合成1,2-丙二醇铜锌铝催化剂的性能[J].化学工业与工程,2013,30(4):16-22 Li Li,Yang Juan,Yu Lei,et al.Performance of Cu-Zn-Al catalyst for hydrogenolysis of glycerol to 1,2-propanediol[J].Chem ical Industry and Engineering,2013,30(4):16-22(in Chinese)
[6]田沙沙,杨娟,陈吉祥.以类水滑石为前体的铜基催化剂催化甘油氢解反应[J].化学工业与工程,2015,32(2):25-30 Tian Shasha,Yang Juan,Chen Jixiang.Hydrogenolysis of glycerol to 1,2-propanediol on Cu-based catalysts derived from hydrotalcite-like precursors[J].Chem ical Industry and Engineering,2015,32(2):25-30(in Chinese)
[7]Guo L,Zhou J,Mao J,et al.Supported Cu catalysts for the selective hydrogenolysis of glycerol to propanediols[J].Appl Catal A,2009,367(1/2):93-98
[8]Zhou J,Guo L,Guo X,et al.Selective hydrogenolysis of glycerol to propanediols on supported Cu-containing bimetallic catalysts[J].Green Chem,2010,12:1 835-1 843
[9]赵兰兰,陈吉祥.P对 Cu/Al2O3催化剂结构及其催化甘油氢解反应性能的影响[J].催化学报,2012,33(8):1 410-1 416 Zhao Lanlan,Chen Jixiang.Effect of phosphorus on structure and performance of Cu/Al2O3catalysts for hydrogenolysis of glycerol[J].Chinese Journal of Catalysis,2012,33(8):1 410-1 416(in Chinese)
[10]Bautista F M,Campelo JM,Garcia A,et al.Acidity and catalytic activity of AlPO4-B2O3and Al2O3-B2O3(5~30 wt%B2O3)systems prepared by impregnation[J].Appl Catal A,1998,170(1):159-168
[11]Usman U,Takaki M,Kubota T,et al.Effect of boron addition on a MoO3/Al2O3catalyst:Physicochem ical characterization [J].Appl Catal A,2005,286(1):148-154
[12]Kamitsos E I,Karakassides M A,Chryssikost G D.Vibrational spectra of magnesium-sodium-borate glasses:Ⅰ)Raman and mid-infrared investigation of the network structure[J].J Phys Chem,1987,91(5):1 073-1 079
[13]Chary K V R,Sagar G V,Naresh D,et al.Characterization and reactivity of copper oxide catalysts supported on TiO2-ZrO2[J].J Phys Chem B,2005,109(19):9 437-9 444
[14]Chen L,Horiuchi T,Osaki T,et al.Catalytic selective reduction of NO with propylene over Cu-Al2O3catalysts:Influence of catalyst preparation method[J].Appl Catal B,1999,23(4):259-269
[15]Usman U,Takaki M,Kubota T,et al.Effect of boron addition on a MoO3/Al2O3catalyst:Physicochemical characterization[J].App l Catal A,2005,286(1):148-154
[16]Su C,Suarez D L.Coordination of adsorbed boron:A FTIR spectroscopic study[J].Environ Sci Technol,1995,29:302-311
[17]He Z,Lin H,He P,et al.Effect of boric oxide doping on the stability and activity of a Cu-SiO2catalyst for vapor-phase hydrogenation of dimethyl oxalate to ethylene glycol[J].JCatal,2011,277:54-63

