猪SsBHMT基因的原核表达及条件优化
余爱丽, 赵晋锋, 张晏萌, 张 正, 郭二虎
1.山西省农业科学院谷子研究所, 山西 长治 046011;2.河北农业大学生命科学学院, 河北 保定 071001
BHMT(betaine-homocysteine methyl transferase)基因存在于动物和微生物体内,用于编码甜菜碱高半胱氨酸甲基转移酶,能够催化甜菜碱的甲基转移到高半胱氨酸上,形成二甲基甘氨酸和甲硫氨酸[1]。甲硫氨酸是合成蛋白质的必需氨基酸,是构成蛋白质的“骨架”氨基酸,甲硫氨酸含量不足将影响其他氨基酸的利用效率,从而影响蛋白质的合成[2]。甲硫氨酸是合成腺苷甲硫氨酸(SAM)的底物,SAM是生物体内的重要甲基供体。甲基代谢在生物体内具有十分重要的意义,很多生物大分子的合成代谢需要甲基的供给,多个基因的表达调控需要甲基参与[3,4],如:蛋白质、脂类的代谢,DNA、RNA的甲基化等。为此本研究在克隆了猪BHMT基因和构建其原核表达载体的基础上, 对其进行原核表达分析和表达条件的优化, 为进一步目的蛋白的纯化和表达研究提供素材。
1 材料与方法
1.1 材料
1.1.1实验材料 pET30a-SsBHMT原核表达载体为本实验室构建。大肠杆菌(Esherichiacoli)菌株ER2566、BL21为本实验室保存。
1.1.2实验药品 蛋白Marker、SDS、丙烯酰胺、胰蛋白胨、酵母提取物等化学试剂购自上海生工生物工程公司;IPTG购自北京赛百盛基因技术有限公司;Ni-NTA Resin购自北京全式金生物技术有限公司。
1.2 方法
1.2.1外源基因的诱导表达及可溶性分析 菌种的活化: 取实验室保存的菌株,在含卡那霉素的LB固体培养基上“之”字划线,37℃培养过夜。自平板挑取单菌落,转接于含卡那的液体培养基中,200 r/min振荡培养过夜。
取样: 取培养过夜的菌液,按照1∶100比例转接于含相应抗生素的培养基中,37℃,200 r/min培养2~3 h,当其OD值达0.6~0.8时,取2 mL菌液作对照,记作0 h;剩余菌液分别加入IPTG至终浓度0.4 mmol/L,37℃,200 r/min继续培养,诱导2 h、4 h、6 h、8 h、10 h,各取2 mL,12 000 r/min离心1 min,去其上清,保存于-20℃。
样品制备: 取所收集菌体,分别加入100 μL 10 mmol/L的Tris-HCl(pH 8.0),2% β-巯基乙醇2 μL,重悬细胞沉淀;冰浴条件下,超声处理10 min,4℃,12 000 r/min离心15 min,分别取上清和沉淀物。沉淀中加入100 μL 10 mmol/L的Tris-HCl(pH 8.0),2%β-巯基乙醇2 μL,重悬细胞沉淀。
分析:SDS-PAGE检测表达蛋白。
1.2.2诱导表达条件优化 不同菌株的筛选:将重组载体分别导入菌株ER2566、BL21进行表达分析,具体方法同1.2.1。
目的蛋白表达量最多的株系的筛选:从平板上挑取8个单菌落,IPTG浓度为0.4 mmol/L,进行筛选,具体方法同1.2.1。
IPTG浓度的优化:取筛选得到的目的蛋白表达量最多的菌株,分别加入IPTG至终浓度为0.3 mmol/L、0.4 mmol/L、0.5 mmol/L、0.6 mmol/L、0.7 mmol/L、0.8 mmol/L、0.9 mmol/L和1.0 mmol/L进行诱导,具体方法同1.2.1。
IPTG诱导时间的优化:取筛选得到的目的蛋白表达量最多的菌株,在IPTG诱导2 h、4 h、6 h、8 h和10 h取样,具体方法同1.2.1。
超声时间的优化:设定冰浴超声处理时间分别为5 min、10 min、15 min和20 min,方法同1.2.1。
1.2.3目的蛋白的纯化 经优化条件诱导后,离心收集菌体,加入裂解液,超声破碎,离心收集上清沉淀,沉淀用8 mol/L尿素溶解后,用Ni2+亲和柱纯化(参照说明书),SDS-PAGE 鉴定。
2 结果与分析
2.1 外源基因的诱导表达及可溶性分析
含有外源基因菌株ER2566(pET30a-SsBHMT)和不含外源基因菌株ER2566(pET30a)在37℃,经过IPTG(终浓度为0.4 mmol/L)诱导2 h、4 h、6 h、8 h和10 h后,SDS-PAGE分析见图1和图2,结果表明:沉淀和上清中,在蛋白Marker的45 kDa与66 kDa的条带之间有一条明显的条带,与预测目的蛋白条带的分子量(约为51 kDa)相吻合;沉淀中的目的蛋白的表达量明显高于上清;目的蛋白以可溶性蛋白和包涵体两种形式表达,但主要以包涵体的形式存在。
2.2 不同菌株对目的蛋白表达的影响
将构建的原核表达载体pET30a-SsBHMT分别转化大肠杆菌BL21(DE3)和ER2566菌株,分析结果如图3,目的蛋白在ER2566中明显表达,且在沉淀中的表达量明显高于上清液中的表达量。但目的蛋白在BL21中不表达或表达不明显,说明不同菌株也影响目的蛋白的表达。
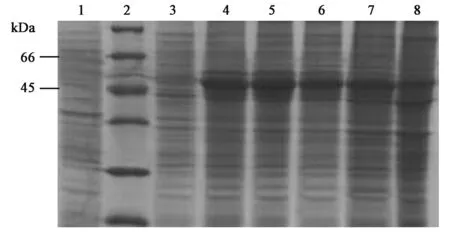
图1 目的蛋白在沉淀中的表达分析Fig.1 Analysis of target protein expression in precipitation.1.ER2566(pET30a)诱导6 h; 2.蛋白Marker; 3~8.ER2566(pET30a-SsBHMT)诱导0 h、2 h、4 h、6 h、8 h和10 h.

图2 上清中目的蛋白的表达分析Fig.2 Analysis of target protein expression in supernatant.1.ER2566(pET30a)诱导6 h; 2.蛋白Marker; 3~8.ER2566(pET30a-SsBHMT)诱导0 h、2 h、4 h、6 h、8 h和10 h.

图3 SsBHMT在大肠杆菌BL21(DE3)和ER2566菌株中的诱导表达SDS-PAGE分析Fig.3 SDS-PAGE analysis of SsBHMT protein in E.coli BL21(DE3)and ER2566.M.蛋白Marker;1.ER2566(pET30a-SsBHMT)沉淀;2.ER2566(pET30a-SsBHMT)上清;3.ER2566(pET30a-SsBHMT)未诱导;4.ER2566(pET30a)沉淀;5.ER2566(pET30a)上清;6.BL21(pET30a-SsBHMT)沉淀;7.BL21(pET30a-SsBHMT)上清
2.3 同一菌株不同株系对目的蛋白表达的影响
从平板上随机挑8个单菌落,IPTG(终浓度为0.4 mmol/L)诱导2 h以后,分析结果表明:4号菌株在沉淀中目的蛋白表达量最多(图4);上清中除5号菌外,2、4号菌表达量略低,其余目的蛋白表达量接近(图5)。
2.4 IPTG浓度对目的蛋白表达量的影响
沉淀中目的蛋白表达量最多的菌株,不同浓度的IPTG(0.3 mmol/L、0.4 mmol/L、0.5 mmol/L、0.6 mmol/L、0.7 mmol/L、0.8 mmol/L、0.9 mmol/L、1.0 mmol/L)诱导2 h,分析结果表明:在未加IPTG时,没有目的蛋白的表达;在IPTG浓度为0.3 mmol/L时,目的蛋白表达;在IPTG浓度为0.4 mmol/L时,目的蛋白的表达量微量上调,之后随IPTG浓度的增大,目的蛋白的表达量减少(图6)。所以0.4 mmol/L为此菌株的最佳IPTG诱导浓度。

图4 筛选在沉淀中表达最优的菌株Fig.4 Screening optimal bacteria expressed in precipitation.M:蛋白Marker;1~8:从平板上挑的8个单菌落

图5 筛选在上清中表达最优的菌株Fig.5 Screening optimal bacteria expressed in supernatant.M:蛋白Marker; 1~8:从平板上挑的8个单菌落

图6 不同IPTG浓度对目的蛋白在沉淀中表达量的影响Fig.6 Effects of IPTG concentration on the recombinant protein expressed in precipitation.M:蛋白Marker;1~9. IPTG浓度分别为0 mmol/L、0.3 mmol/L、0.4 mmol/L、0.5 mmol/L、0.6 mmol/L、0.7 mmol/L、0.8 mmol/L、0.9 mmol/L、1.0 mmol/L
2.5 IPTG诱导时间对目的蛋白表达量的影响
沉淀中目的蛋白表达量最大的菌株,加入IPTG至终浓度为0.4 mmol/L,经过不同时间诱导后,结果表明:沉淀中,IPTG诱导2 h时,目的蛋白开始表达;并且随着诱导时间的延长,表达量明显增加;IPTG诱导10 h时,目的蛋白的表达量最大(图7)。上清中目的蛋白的表达量随时间变化无明显变化(图8)。

图7 不同IPTG诱导时间对目的蛋白在沉淀中表达量的影响Fig.7 Effects of induction time on the target protein expression in precipitation.1.ER2566(pET30a)诱导6 h; 2.蛋白Marker; 3~8. ER2566(pET30a-SsBHMT)诱导0 h、2 h、4 h、6 h、8 h、10 h

图8 不同IPTG诱导时间对目的蛋白在上清中表达量的影响Fig.8 Effects of induction time on the target protein expression in supernatant.1.ER2566(pET30a)诱导6 h;2.蛋白Marker;3~8.ER2566(pET30a-SsBHMT)诱导0 h、2 h、4 h、6 h、8 h、10 h.
2.6 超声时间对目的蛋白提取量的影响
沉淀中目的蛋白表达量最多的菌株,0.4 mmol/L IPTG诱导2 h后,经不同的冰浴超声破碎时间5 min、10 min、15 min、20 min破碎,结果见图9,超声5 min时,沉淀中目的蛋白提取量略大;上清中目的蛋白表达量变化不明显(图10)。

图9 不同超声时间对目的蛋白在沉淀中提取量的影响Fig.9 Effects of different ultrasonic time on the target protein extraction in precipitation.1.ER2566(pET30a)对照;2~5.超声5 min、10 min、15 min、20 min;M.蛋白Marker

图10 不同超声时间对目的蛋白在上清中提取量的影响Fig.10 Effects of different ultrasonic time on the target protein extraction in supernatant.M.蛋白Marker; 1.ER2566(pET30a)对照; 2~5.超声5 min、10 min、15 min、20 min
2.7 目的蛋白的纯化
上清和沉淀的纯化结果如图11所示,沉淀纯化结果明显,在45~66 kDa之间有一条带,无杂蛋白,但上清纯化无结果。
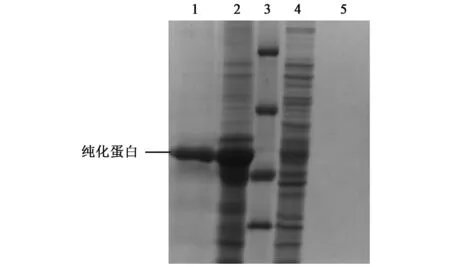
图11 SsBHMT蛋白的纯化Fig.11 Purification of SsBHMT protein.1.ER2566(pET30a-SsBHMT)沉淀纯化;2.ER2566(pET30a-SsBHMT)沉淀;3.蛋白Marker; 4.ER2566(pET30a-SsBHMT)上清;5.ER2566(pET30a-SsBHMT)上清纯化
3 讨论
原核细胞表达体系是目前研究最深入、应用最广泛的表达系统,它具有真核表达体系无可比拟的优点,成本低廉、外源基因表达量大等[5]。原核表达载体系统pET功能非常强大,可通过目的蛋白的特点、IPTG浓度的调节等方法来调控目的蛋白的表达水平,通过载体上的His-Tag标签纯化蛋白,特别适用于那些以包涵体形式表达的蛋白,使蛋白纯化过程变得简单高效。为此本研究中选用pET载体对外源基因BHMT进行表达,结果发现BHMT基因在原核细胞BL21(DE3)中不表达或表达不明显,在ER2566中主要以包涵体的形式表达,而且在不同ER2566(pET30a-SsBHMT)株系中表达量不同。前期实验28℃和37℃两个诱导温度实验结果表明,温度对目的蛋白的表达差异不大(未列出),于是进行了IPTG诱导浓度、诱导时间的优化,结果表明筛选到的沉淀中目的蛋白表达量最多的菌株,在37℃,IPTG浓度为0.4 mmol/L,诱导时间为10 h时,沉淀中的表达量最多,但仍主要以包涵体的形式表达,分析其原因可能与菌株有关[6],也可能与pH、温度[7~9]、真核生物密码子偏爱性及氨基酸的组成等有关[10]。本研究结果与已有研究结果一致,表明不同重组载体的最佳表达条件不同,不同重组载体在同一菌株的最适条件也不相同,每种重组载体的最适表达条件都需要进行特定的优化[11~15],如黑山羊基因MSTN[BL21-pET-32a(+)-MSTN69]的最优表达条件为31℃,IPTG 0.8 mmol/L诱导5 h[12]; 番茄谷胱甘肽转移酶基因ShGSTU1在大肠杆菌BL21(pET28a)中的最佳表达条件为37℃,1 mmol/LIPTG诱导4 h;在BL21(pET32a)中最佳表达条件为30℃,1 mmol/L IPTG诱导5 h[15]。另外对不同超声破碎时间分析发现,超声时间对目的蛋白的纯化影响不大。本研究优化了目的基因在原核细胞中表达的条件,使得目的基因在原核细胞中的表达量明显增加,为进一步纯化目的蛋白、制备抗体奠定了基础。
[1] Garrow T A. Purification, kinetic properties, and cDNA cloning of mammalian Betaine homocysteine methyl-transterase[J]. J. Biol. Chem., 1996, 271: 22831-22838.
[2] 麻益良,何瑞国.饲料添加剂蛋氨酸在养禽业中的应用[J].山东家禽,1999,2:25-28
[3] Amir R. Current understanding of the factors regulating methionine content in vegetative tissues of higher plants[J]. Amino Acids, 2010, 39:917-931
[4] 苏 玉, 王 溪, 朱卫国.DNA 甲基转移酶的表达调控及主要生物学功能[J].遗传,2009,31(11): 1087-1093
[5] Sambrook J,Fritsch E F,Maniatis T. Molecular cloning: a laboratory manual[M](3rdeds). Cold Spring Harbor: Cold Spring Harbor Laboratory Press,2002,934
[6] 张秀香,袁子国,李景文,等.LTB-MOMP融合基因表达载体的构建及其在原核细胞中的表达[J]. 中国生物制品学杂志,2008,21(6):449-451,456.
[7] 叶 姣,陈长华,夏 杰,等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J]. 华东理工大学学报, 2002,28(2):364-367.
[8] Donovan R S, Robinson C W, Glick B R. Review:optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter[J]. J. Ind. Microbiol., 1996,16(3):145-154.
[9] Carte R P, Kelley R F, Rodrigues M L,etal.. High levelEscherichiacoliexpression and production of a bivalent humanized antibody fragment [J]. Biotechnology , 1992,10:163-167.
[10] Peter E V.E.coliGene Expression Protocols [M]. Totowa, New Jersey: Humana Press Inc., 2003,335-338.
[11] 张雪利,鲁义善,谢吉国,等. 红笛鲷重组激活基因rag1原核表达条件的优化及纯化[J]. 广东海洋大学学报,2012,32(1):11-16.
[12] 石照应,曲月秀,陈 蓉,等.贵州黑山羊MSTN基因原核表达条件优化及蛋白纯化[J].西南农业学报,2012,25(6):2343-2346.
[13] 吕 彤,刘 扬,赵 青,等. 烯酮还原酶基因的克隆与优化表达[J]. 应用与环境生物学报,2011,17(1): 87-90.
[14] 孙 涛,申 宁,白 羽,等. 海栖热袍菌极耐高温木聚糖酶基因xynB64在大肠杆菌中的融合表达[J]. 微生物学通报,2011,38(7):1090-1097.
[15] 裴冬丽,张红岩,李 萌,等.番茄抗白粉病必需基因ShGSTU1原核表达条件优化[J].河南大学学报:自然科学版,2014,44(2):202-207.

