卤键:阴离子识别的新宠—从有机相到水相的飞跃
庞 雪
(北京市八一学校,北京100080)
卤键:阴离子识别的新宠—从有机相到水相的飞跃
庞 雪*
(北京市八一学校,北京100080)
卤键是指共价键合的卤原子的亲电区域与分子亲核区域的吸引相互作用。近年来卤键的发展用飞速来形容一点也不为过,但是卤键在溶液中尤其是水相中的应用却凤毛麟角,卤键究竟能否像氢键一样应用于水溶液中呢?这也成为卤键发展过程中的一个至关重要的问题。设计高选择性与亲合性的受体分子在水溶液中进行阴离子识别是一个挑战性的问题。该文基于最近Paul Beer课题组在Nature Chemistry发表的文章,对卤键在水溶液中的阴离子识别过程进行了详细评述。
卤键;氢键;阴离子识别;拟轮烷结构;水相
0 引言
生物体系中分子识别过程的重要特点之一就是在水溶液环境完成。也正是因为如此,在设计具有高选择性和高亲合性卤键进行分子识别的过程中消除水的干扰问题就成为具有挑战性的课题。这不仅仅因为水具有较大的极性,更重要的是水既能充当氢键供体又能作为氢键受体,容易与被识别分子或离子之间发生较强的溶剂化作用。解决这个问题可能的思路和策略包括:通过使主体和/或客体分子带有多重电荷来增加主客体分子之间的库仑力;将呈路易斯酸性的金属或主族元素引入到受体分子中,增加与阴离子之间的键强度;利用受体在折叠或聚集过程中产生的疏水效应促进阴离子键的形成[1]。 最近,Paul Beer课题组在Nature Chemistry发表文章,完美实现了利用卤键在水溶液中对Cl-、Br-、I-、SO42-的识别[2]。并通过卤键与氢键对阴离子识别效果的比较,显示了卤键极有可能成为水相中进行阴离子识别的新宠。基于此篇报道,该文介绍了卤键的定义及作用特点,对卤键的分子识别尤其是在水溶液中的阴离子识别过程进行了详细评述。
1 卤键及其作用特点
卤键(XB)可追溯到1814年Colin所报道的
I2…NH3复合物[3],已有200年的历史。2014年在意大利莱切市成功举办了第一届卤键国际研讨会(1st international symposium on halogen bonding (ISXB-1)),预示着卤键在静默了近两个世纪后又腾飞了。
1.1 卤键的定义
关于卤键的定义存在着多种说法。最初的卤键被定义为:卤素原子与含孤对电子的电负性原子之间的非共价作用。但随着研究对象的不断扩展,卤键的原始定义已远远不能概括这种非共价作用,除了富含孤对电子的电负性原子(如S,N,O等)外,其他富电子的基团如π电子体系,阴离子,甚至极化程度较高的卤素原子都能作为卤键受体发生卤键作用。因此急需对卤键进行重新的认识和更为全面的定义。2013年,Resnati等应国际纯粹与应用化学联合会(IUPAC)邀请重新对卤键进行了较为全面和准确的定义[4]:“A halogen bond occurs when there is evidence of a net attractive interaction between an electrophilic region associated with a halogen atom in a molecular entity and a nucleophilic region in another,or the same, molecular entity。”即卤键是指发生在某个分子实体中卤原子的亲电区域与另一或同一分子实体中的亲核区域间的净的吸引相互作用。简单来说卤键是一类以卤原子为电子密度受体的非共价作用[5]。
卤族元素(F、Cl、Br、I)具有较大的电负性,又为什么能够作为电子受体发生卤键作用呢?如图1所示,计算表明,能够发生卤键作用的卤素原子X,在沿着Y-X键轴方向的外围中心区域具有正的表面静电势穴。卤键正是以此正的表面静电势区域与电负性原子或基团发生卤键作用。Politzer等创造性地将这一正的表面静电势区域命名为σ-穴(σ-hole)[6-8]。其起源于卤素原子电子云的各向异性分布,并且X原子临近的吸电子取代基的诱导效应使得σ-穴处的表面静电势更正。σ-穴模型很好的解释了卤键的形成及作用特点,是目前最为流行且普遍认可的用来解释卤键方向性的理论模型。
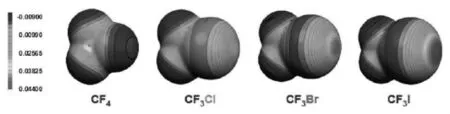
图1 卤代甲烷分子表面静电势图[6]Fig.1 The molecular surface electrostatic potential of CF3X
1.2 卤键的方向性和作用强度
能够称之为“键”的分子间弱相互作用,方向性是其最重要的特征之一。卤键比氢键具有更好的方向性,倾向于线性。当体系中存在适宜的电子供体或受体时,会选择沿σ-穴方向与之发生作用,所以卤键倾向于180°。当然。电子供体的轨道类型和空间位阻等也会对卤键的键角产生一定的影响,从而使实际的键角可能略偏离180°。
影响卤键作用强度的因素有很多。但总的来说,卤键的作用强度与σ-穴和负电性元素的正负表面静电势大小呈正相关性,这是卤键的静电作用部分决定的。当然,极化作用(能力)和色散作用也影响卤键强度。
2 卤键在阴离子识别中从有机相到水相的飞跃
无论是在自然界还是在生物体系中,阴离子无处不在。因此对阴离子进行识别,尤其是在水溶液中对阴离子进行识别,一直以来都是大家非常热衷并且感兴趣的课题。从生物体系中的阴离子识别过程得到启发,要想显著提高对阴离子识别的选择性,一方面需要设计结构巧妙的三维主体分子,如“内锁(Interlocked)”型的主体结构;另一方面,寻找新的专属性识别工具也同样重要[9]。 而最近Beer课题组[2]关于卤键在水相中进行阴离子识别的成果很可能将卤键的发展推向另一个高潮,使卤键成为阴离子识别中的后起
之秀。
2.1 卤键在有机体系/有机-水混溶体系中的阴离子识别
在有机相中,容易产生卤键作用。例如,Shen等[10]观察到,当无色的卤阴离子氯仿溶液加入到粉红色的二碘全氟烷烃中,尤其是1,2-二碘全氟乙烷氯仿溶液中时,溶液的颜色瞬间变化为黄色,且从Cl-、Br-到I-依次加深。UV光谱实验结果显示,二碘代全氟烷烃与卤阴离子在溶液中的化学计量比均为1∶1,并进行了缔合常数的测定,对于相同的X-,二碘代全氟烷烃的链越长,形成的卤键作用也越强。Wang等[11]选取了具有多作用位点的四碘乙烯分子作为卤键供体,UV吸收光谱结果显示,四碘乙烯与X-在稀溶液中的计量比为1∶1,具有较大的缔合常数,X-的电子密度越高,得到的卤键复合物的强度则越强。
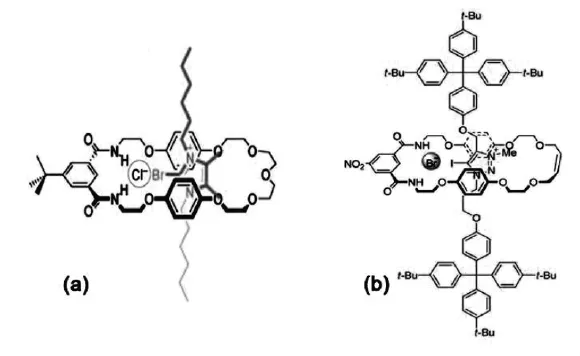
图2 含有卤键供体的拟轮烷结构的阴离子受体[12-13]Fig.2 XB-donor rotaxane anion receptors
Beer课题组在将卤键应用到分子识别领域中做出了许多突出贡献。Beer等[12]以2-溴-1,3-二己基-4,5-二甲基咪唑基阳离子氯盐(图2a)为主体分子,与大环分子组装成呈“针-线”结构的超分子拟轮烷。理论计算模拟了拟轮烷能够通过三维孔穴的空间选择性,同时以C-Br…Cl-卤键和N-H…Cl-氢键为 “抓手”,实现对阴离子的识别。首次实现了将卤键设计引入到相互贯穿的分子体系中。虽然没有进一步的关于对阴离子识别能力的实验研究,但是让人们看到了通过设计“内锁(Interlocked)”型的精巧分子结构体系,有望实现通过卤键对阴离子进行识别的目的。随后,Beer等又以碘代三唑卤化物(图2b)为主体分子与大环分子组装成拟轮烷结构,并在主体分子两侧引入体积较大的位阻基团,增强拟轮烷分子结构的稳定性[13]。采用这种结构,成功实现了在水-甲醇-氯仿混合溶剂中对卤阴离子的识别。1H NMR滴定实验显示该体系对碘离子具有很好的选择性。
之后,他们用溴代咪唑衍生物直接合成了具有两个卤键作用位点的主体分子(图3c)[14],并在水-甲醇混合溶剂中实现了对卤阴离子的识别。1H NMR实验结果显示该化合物与各种卤阴离子的缔合常数的大小顺序为:Br->I->>Cl-(对应的缔合常数分别为889、184和<10 M-1),而与F-之间没有发生有效的卤键作用,表明其对溴离子具有较好的选择性。图3d为该化合物与Br-通过C-Br…Br-卤键组成的复合晶体结构示意图。在此基础上,通过与阴离子型模板的结合,设计合成了第一个可利用卤键的协同作用选择性识别Cl-和Br-(缔合常数分别为1.5×105和3.7×106M-1)的卤键索烃(图3e)[15]。之后又设计合成了大环的卤代咪唑类主体分子(图3f),当与卤阴离子作用时,通过主体分子的荧光变化进而实现对阴离子
的识别[16]。如荧光光谱滴定实验表明溴代和顺式的碘代咪唑类主体分子分别可以选择性的识别I-和Br-(缔合常数:对溴代咪唑类主体分子分别为2.9×104和6.3×105M-1;对碘代咪唑类主体分子分别为9.6×105和3.7×104M-1)。并且顺式的碘代咪唑类异构体与Br-和I-分别以2∶2的化学缔合比形成了新颖的二聚体的卤键复合晶体,质子化、氯代和反式的碘代咪唑类主体分子则不能有效的与X-络合。
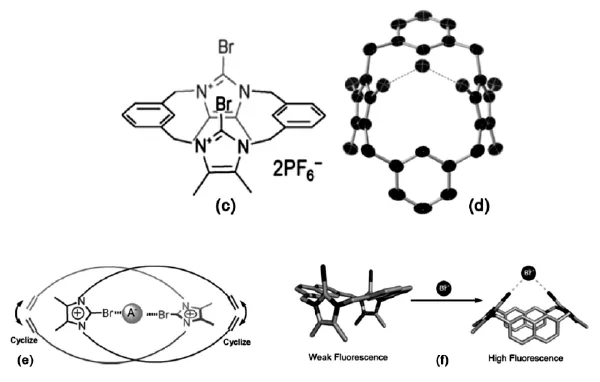
图3 含有卤键供体的拟轮烷结构的阴离子受体[14-16]Fig.3 XB-donor rotaxane anion receptors
2.2 卤键在水相中的阴离子识别
尽管已经出现了一些将卤键应用于溶液中进行阴离子识别的报道,但在这些报道中,所选用的溶剂均为有机相,或有机-水混合体系,但无论在自然界还是生物体系中,水是大量存在的,多数的识别过程都发生在水溶液中。因此,卤键能否在纯水溶液中成功的对离子进行识别成为一个格外重要的问题。最近,Beer课题组[2]在Nature Chemistry报道的结果让人印象深刻同时又鼓舞人心。他们分别设计合成了含有两个卤键供体基团的无环和拟轮烷结构的三唑吡啶盐主体分子,通过β-环糊精的功能化,成功的在重水中实现了对Cl-、Br-、I-的识别。并且通过与结构相似的含有氢键供体基团的无环和拟轮烷结构的对比,证明了在水溶液中卤键对于阴离子的亲合性比氢键更强。
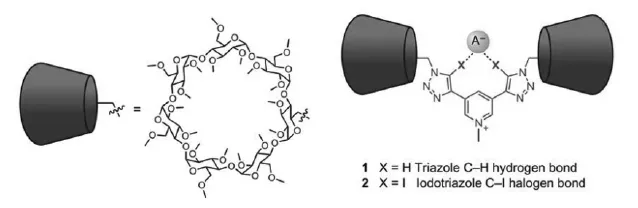
图4 无环阴离子受体:双质子的HB-受体三唑吡啶盐1和双碘代的XB-受体三唑吡啶盐2[2]Fig.4 Acyclic anion receptors:HB-and XB-donor bis-triazole pyridinium acyclic receptors
如图4所示,以3,5-二乙炔基-吡啶和叠氮
基功能化的全甲基β-环糊精为原料,Beer等合成了无环的阴离子受体——双质子的三唑吡啶盐1和双碘代的三唑吡啶盐2,分别为氢键型阴离子受体和卤键型阴离子受体。可以想象1和2可以通过与阴离子之间的氢键和卤键作用对阴离子进行识别,但与已报道的 “内锁(Interlocked)”型结构相比,无环结构中缺少了空间的选择识别效应,可以预期在无环结构中仅仅依靠“抓手”氢键或卤键进行识别的效果应远不如Interlocked型分子结构。因此,Beer等以1和2为轴向分子进一步合成了拟轮烷结构阴离子受体3和4(图5)。Interlocked型化合物的合成通常是一项比较有挑战性的工作,但是Beer等在1和2中引入Cl-,使用Cl-作为模板,结构3和4具有很高的产率,非环的二胺化合物较容易以1、2为中心轴成环,形成所设计的拟轮烷结构。然后用配位能力较弱的硝酸盐交换合成过程中所使用的模板氯离子,即得到目标结构氢键型拟轮烷受体3和卤键型拟轮烷受体4。拟轮烷结构中甲基化的β-环糊精取代基具有双重作用:一方面充当位阻剂防止大环结构的移动,另一方面增加了受体分子的在水中的溶解度。
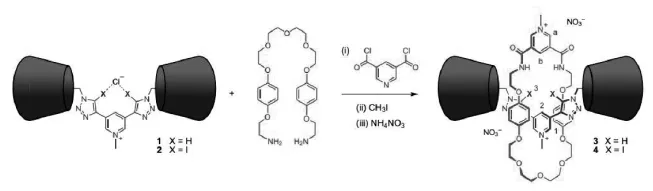
图5 拟轮烷结构的阴离子受体:HB-受体3和XB-受体4[2]Fig.5 Rotaxane anion receptors:HB-receptor 3 and XB-receptor 4
那么无环结构1(氢键型)、2(卤键型)和拟轮烷结构3(氢键型)、4(卤键型)是否如想象的一样对阴离子有很好的识别效果呢?Beer等使用核磁滴定方法进行了考察,向受体1、2、3、4的重水溶液中逐渐加入Cl-,Br-,I-和SO42-离子的钠盐,如果受体能够与阴离子之间成键,那么周围H的化学位移将发生显著变化。通过化学位移的变化与阴离子浓度之间关系的分析得到所设计的受体与阴离子之间的结合比均为1∶1。随着Cl-,Br-,I-的加入,含卤键供体的拟轮烷结构4表现出显著的化学位移的变化,尤其是与碘离子,键合常数达到了2200 M-1,在水溶液中如此大的键合常数通常只有在受体分子带有更多正电荷时才会出现[1]。但4对于硫酸根离子的识别能力较弱,这是由于硫酸根离子体积较大阻碍了与4中键合孔穴的作用,此外硫酸根离子具有较大的水合作用能,同时阻碍了受体对于其的选择性识别。结构相似的氢键型拟轮烷受体3与4相比对阴离子的识别效果明显下降,只对溴离子和碘离子表现出较弱的结合能力,其键合常数分别为10 M-1和20 M-1。对于氯离子和硫酸根离子无法识别。仅仅将拟轮烷中的两个质子以碘取代在阴离子识别效果上即产生如此惊人的影响,可见卤键在水溶液中对阴离子识别有着显著的增强作用。无环HB-受体1和XB-受体2与阴离子在水溶液中的成键结果也可以证明这点。尽管无环的XB-受体2结构相对简单且只带有一个单位正电荷,但对于溴离子和碘离子的识别能力较强,键合常数可达到15 M-1和40 M-1,甚至强于带有两个正电荷的HB-拟轮烷受体3。相比之下,无环的HB-受体1仅仅与碘离子显示出微弱的结合能力(Ka=5 M-1)。
水相中对于4与卤阴离子之间相互作用的分子动力学模拟显示X-…I作用无论从作用距离还是键角上都与卤键的作用特点相符。根据van’t Hoff方程进行的热力学测定结果表明,HB-受体与XB-受体之间存在着较大差别,对于HB-受体,与I-的结合是熵增控制,而XB-受体则是
焓变控制。
3 结论
能够在水溶液中实现对阴离子的高效识别对于生物体系中的识别、传感以及药物设计等领域都至关重要。通过分子结构设计,巧妙的将卤键应用于纯水相中的分子识别是卤键应用的一次飞跃。可以断言,随着第一颗种子的萌发,不久将会见到卤键在水溶液中应用的丰硕花果。
[1]Kubik S.Anion recognition in water[J].Chem.Soc. Rev.,2010,39:3648-3663.
[2]Langton M J,Robinson S W,Beer P D,et al.Halogen bonding in water results in enhanced anion recognition in acyclic and rotaxane hosts[J].Nature Chem.,2014,6: 1039-1043.
[3]Colin J J.Sur quelques combinaisons de l’iode[J].Ann. Chim.,1814,91:252.
[4]Desiraju G R,Ho P S,Resnati G,et al.Definition of the halogen bond(IUPAC Recommendations 2013)[J].Prue Appl.Chem.,2013,85(8):1711-1713.
[5]Metrangolo P,Pilati T,Resnati G.Halogen bonding and other noncovalent interactions involving halogens:a terminology issue[J].CrystEngComm,2006,8(12):946-947.
[6]Clark T,Hennemann M,Politzer P,et al.Halogen bonding:the σ-hole[J].J.Mol.Model.,2007,13(2):291-296.
[7]Politzer P,Lane P,Concha M C,et al.An overview of halogen bonding[J].J.Mol.Model.,2007,13(2):305-311.
[8]Politzer P,Murray J S,Clark T.Halogen bonding:an electrostatically-driven highly directional noncovalent interaction[J].Phys.Chem.Chem.Phys.,2010,12(28): 7748-7757.
[9]Beale T M,Chudzinski M G,Sarwar M G,et al.Halogen bonding in solution:thermodynamics and applications [J].Chem.Soc.Rev.,2013,42:1667-1680.
[10]Shen Q J,Jin W J.Strong halogen bonding of 1,2-diiodoperfluoroethane and 1,6-diiodoperfluorohexane with halide anions revealed by UV-Vis,FT-IR,NMR spectroscopes and crystallography[J].Phys.Chem.Chem. Phys.,2011,13(30):13721-13729.
[11]Wang H,Zhao X R,Jin W J.The C-I…X-halogen bonding of tetraiodoethylene with halide anions in solution and cocrystals investigated by experiment and calculation[J].Phys.Chem.Chem.Phys.,2013,15(12):4320-4328.
[12]Serpell C J,Kilah N L,Beer P D,et al.Halogen bond anion templated assembly of an imidazolium pseudorotaxane[J].Angew.Chem.Int.Ed.,2010,49(31):5322-5326.
[13]Kilah N L,Wise M D,Beer P D,et al.Enhancement of anion recognition exhibited by a halogen-bonding rotaxane host system[J].J.Am.Chem.Soc.,2010,132(34): 11893-11895.
[14]Caballero A,White N G,Beer P D.A bidentate halogenbonding bromoimidazoliophane receptor for bromide ion recognition in aqueous media[J].Angew.Chem.Int. Ed.,2011,50(8):1845-1848.
[15]Caballero A,Zapata F,White N G,et al.A halogenbonding catenane for anion recognition and sensing[J]. Angew.Chem.Int.Ed.,2012,51(8):1876-1880.
[16]Zapata F,Caballero A,White N G,et al.Fluorescent charge-assisted halogen-bonding macrocyclic halo-imidazolium receptors for anion recognition and sensing in aqueous media[J].J.Am.Chem.Soc.,2012,134(28): 11533-11541.
Halogen bonding:the new favorite in anion recognition—the leap from organic to waterphase
Pang Xue*
(Beijing Bayi School,Beijing 100080,China)
The halogen bond refers to a net attractive interaction between an electrophilic region associated with a halogen atom in a molecular entity and a nucleophilic region in another or the same molecular entity.In recent years, the halogen bond has undergone a dramatic development.However,the application of XB in solution especially in water is so limited.Then whether XB,like hydrogen bond,can use in the water or not?It concerns the further development of XB.More important,the design of receptors with strong and selective recognition of anions in water remains a significant challenge.Based on the paper in Nature Chemistry by Beer’s group,the application of XB in molecular recognition in solution especially in water is reviewed.
halogen bond;hydrogen bond;anion recognition;rotaxane;water
*通信联系人,E-mail:pangxuebnu@163.com

