基于金纳米粒子/巯基-β-环糊精修饰的柔红霉素传感器
吴粦静,刘桂华,闫雅倩,黄杉生
(上海师范大学生命与环境科学学院,上海200234)
基于金纳米粒子/巯基-β-环糊精修饰的柔红霉素传感器
吴粦静,刘桂华,闫雅倩,黄杉生*
(上海师范大学生命与环境科学学院,上海200234)
利用电沉积法将金纳米粒子修饰到玻碳电极表面,巯基-β-环糊精通过金硫键自组装修饰到电极表面,制备的传感器对柔红霉素(DNR)有灵敏的电化学响应。以场发射扫描电镜表征电极的形貌。以循环伏安法、电化学阻抗等方法考察了修饰电极电化学特性,及DNR在修饰电极上的电化学行为。由于金纳米粒子的良好导电特性,使得电极具有较好的电子转移活性。在优化实验条件下,该传感器对柔红霉素的响应分两段呈良好线性关系,线性范围分别为:1.0×10-7~1.0×10-6mol/L,线性相关系数r=0.9990;1.0×10-6~1.0×10-5mol/L,线性相关系数r=0.9985。检测限为5.0×10-8mol/L(S/N=3)。
柔红霉素;金纳米颗粒;β-环糊精
0 引言
金纳米颗粒(Gold nanoparticles,简称GNP)由于其具有特殊的物理、化学及光学特性,在生物传感器、电化学催化、光化学等领域有着广阔的应用前景[1]。
粒径在10~100 nm范围的GNP具有很好的光吸收特性,同时在表面等离子体共振波长区域有较大的散射横截面[2-4]。Xiong Liu等[5]利用金纳米粒子的这种特性,采用动态光散射原理构造出针对癌症标记物的纳米免疫探针,用来检测低浓度的前列腺癌标志性蛋白。黄文华等[6]利用GNP对抗坏血酸的催化氧化特性构建了在多巴胺共存条件下选择性检测抗坏血酸的电化学传感器。吉玉兰等[7]利用金纳米粒子的电催化活性结合单壁碳纳米管制备了黄芪甘的电化学传感器。Chenzhong Li等[8]利用GNP构建了阻抗型免疫传感器实现了DNA结合性药物的快速灵敏检测。
β-环糊精(Beta cyclodextrin,β-CD)是由多个
D-β比喃葡萄糖单元通过α-1,4糖苷键连接起来的环状分子,其外形为锥形的圆筒环状结构,呈现内疏水外亲水特性。这种内疏水空腔结构可作为良好的超分子主体,对某些物质具有包合作用,抗癌药柔红霉素(DNR)的非极性蒽醌结构即可插入β-CD疏水空腔,在电极表面催化氧化时产生电化学信号。
金纳米粒子可以和巯基通过共价结合形成稳定的金硫键(Au-S)[9-10],可将含有巯基的化合物固定到金基底或者GNP表面。该文将巯基-β-环糊精组装至GNP表面。利用糊精空腔结构和DNR的特异性结合,金纳米粒子的良好的导电性构建了检测抗癌药DNR的高灵敏传感器。
1 实验部分
1.1 实验仪器
CHI760C电化学分析仪 (上海辰华仪器公司,中国),与三电极体系相结合:以玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极,用来进行电化学表征及测定。电化学阻抗分析在含有1 mmol/L K3[Fe(CN)6]和1 mmol/L K4[Fe(CN)6](1∶1)及0.1 mol/L氯化钾的溶液中进行;循环伏安、微分脉冲伏安实验在PBS缓冲溶液中进行;所有的电化学测定都是在容积为10 mL的容器中进行。扫描电镜为S-4800型场发射扫描电镜(FESEM,日本Hitachi公司)。
1.2 实验试剂
浓硫酸、硝酸、氯金酸、氯化钾以及浓磷酸购自(上海)化学试剂有限公司,巯基-β-环糊精购自山东滨州智源生物科技有限公司,柔红霉素对照品来自上海创赛科学仪器有限公司,注射用盐酸柔红霉素来自浙江海正药业有限公司,磷酸二氢钠、磷酸氢二钠购自上海润捷化学试剂有限公司,磷酸盐缓冲溶液由Na2HPO4、NaH2PO4,和KCl按照比例配置。实验中所用试剂级别均为分析纯,实验用水为Milli-Q18.2MΩ超纯水。
1.3 电极的制备
玻碳电极(GCE)依次用1.0 μm,0.3 μm,和0.05 μm的α-氧化铝粉末在麂皮上抛光打磨至形成平整光滑的镜面。之后用水冲洗,依次在硝酸-乙醇 (V∶V=1∶1)和超纯水中分别超声15 min,取出室温晾干。
电沉积金纳米粒子(GNP):以处理好的玻碳电极为工作电极,甘汞电极为参比电极,铂丝电极为辅助电极,采用循环伏安法,以5 mmol/L的氯金酸溶液为电解质溶液进行电沉积。扫描电压为-0.3 V~0.0 V,扫速50 mV/s。所得修饰电极标记为GNP/GCE。
巯基-β-环糊精 (SH-β-CD)的修饰:取0.1150 g巯基环糊精溶于10.0 mL水,超声溶解,得到10 mmol/L的SH-β-CD溶液,将制备的GNP/GCE电极浸入SH-β-CD溶液,室温静置组装4 h~12 h。取出后以超纯水淋洗去除未能稳定结合的SH-β-CD,将所得修饰电极标记为:SH-β-CD/GNP/GCE。电极制备原理示意图如图1所示。
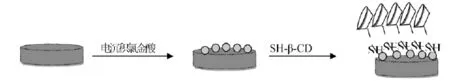
图1 传感界面的构建过程Fig.1 Preparation of SH-β-CD/GNP/GCE
2 结果与讨论
2.1 逐层修饰电极的形貌及电化学表征
图2为工作电极的场发射扫描电镜(FESEM)图。从图中可明显看出,裸玻碳电极(GCE,图2a)为洁净光滑的平面。电沉积金纳米粒子(GNP)后,电极表面形貌发生较大变化(图2b),可明显看出GNP较均匀的修饰到了电极表面,其粒径大小约为50 nm。图2c显示,以巯基-β-环糊精(SH-β-CD)修饰电极之后,电极表面形貌进一步发生明显变化,从图中可看出电极表面的GNP被一层半透明物质均匀包裹,说明SH-β-CD成功组装到了GNP/GCE表面。
电化学阻抗谱 (Electrochemical Impedance
Spectroscopy,简称EIS)是一种表征电极界面特性的有效手段,不同修饰物的电极表面其阻抗值不同[11]。图3分别为裸玻碳电极GCE、修饰电极GNP/GCE和SH-β-CD/GNP/GCE为工作电极在1 mmol/L[Fe(CN)6]4-/3-(含0.1 mmol/L KCl)的底液中测定获得的交流阻抗图谱(Nyquist plot),频率变化范围为:0.05 Hz~10 kHz。由图3 Nyquist曲线可计算出工作电极的表面电子转移阻值Ret(电极表面电子转移所受阻力)。GCE的Ret值为190 Ω(3a)。在修饰GNP之后,修饰电极GNP/GCE的Ret值显著降低,为60 Ω(3b),这是由于GNP的相比于GNP/GCE电极,其阻值有所上升。这可能是由于作为多糖型有机物的SH-β-CD相比于GNP其电子传导能力减弱,抑制了电子在电极界面的转移能力。借此说明电极的层层修饰是成功的。很好的介电特性利于电子的传导,增强了电极表面电子传导能力,表现为界面电子转移阻值减小。当SH-β-CD通过金硫键组装到电极上后,SH-β-CD/GNP/GCE的电极的Ret值为110 Ω,

图2 裸GCE(a)、GNP/GCE(b)、SH-β-CD(c)的FESEM图Fig.2 FESEM of GCE(a),GNP/GCE(b)and SH-β-CD/GNP/GCE(c)
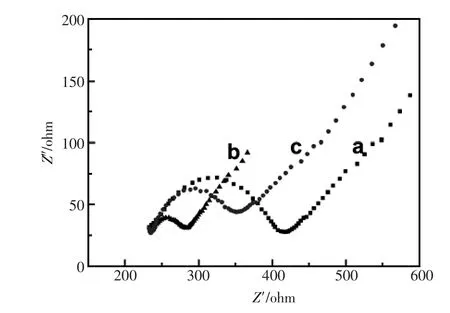
图3 裸玻碳电极(a)、GNP/GCE(b)、SH-β-CD/GNP/ GCE(c)在1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)(0.1 mol/L KCl)溶液中的交流阻抗图谱Fig.3 Electrochemistry nyquist plots of bare GCE(a), GNP/GCE(b)and SH-β-CD/GNP/GCE(c)in a mixture of 1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)(0.1 mol/L KCl) solution
图4为逐层修饰电极在1 mmol/L[Fe(CN)6]4-/3-(含0.1 mmol/L KCl)溶液中获得的循环伏安曲线。由于不同电极其界面电子转移阻值不同,通常对应的循环伏安曲线中峰电流也会发生相应变化,Ret值越大则对应峰电流越小。裸GCE Ret值最大为190 Ω,相应的其循环伏安曲线峰电流最小(图4a)。而GNP/GCE电极由于GNP的较大的比表面积和良好的电子传导能力,相应的Ret值最小为60 Ω,循环伏安峰电流最大(图4b)。对于修饰电极SH-β-CD/GNP/GCE,其Ret值增大为110 Ω,峰电流亦相应减小(图4 c)。循环伏安特性与获得的电化学阻抗谱实验结果是一致的。
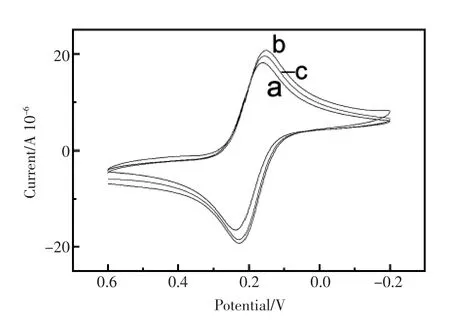
图4 裸GCE(a)、GNP/GCE(b)、SH-β-CD/GNP/GCE(c)在1 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)(0.1 mol/L KCl)溶液中的循环伏安曲线Fig.4 CVs for different electrodes:bare GCE(a),GNP/ GCE(b)and SH-β-CD/GNP/GCE(c)
2.2 柔红霉素在电极上的电化学行为
图5为SH-β-CD/GNP/GCE电极在空白PBS溶液(pH=6.0)以及含有0.01 mmol/L柔红霉素(DNR)的PBS溶液(pH=6.0)中的循环伏安曲线。图5 a为修饰电极SH-β-CD/GNP/GCE不含DNR的PBS溶液中的空白对照循环伏安图,在-1.0 V~0.6 V的电位范围内,SH-β-CD/GNP/ GCE在-0.7 V处有一氧化峰。加入DNR后,分别在0.5V及0.25V和-0.5V及-0.75V处产生两对新的氧化还原峰(图5 b)。相对而言,在0.5V和0.25V处的氧化还原峰更适合DNR的检测。
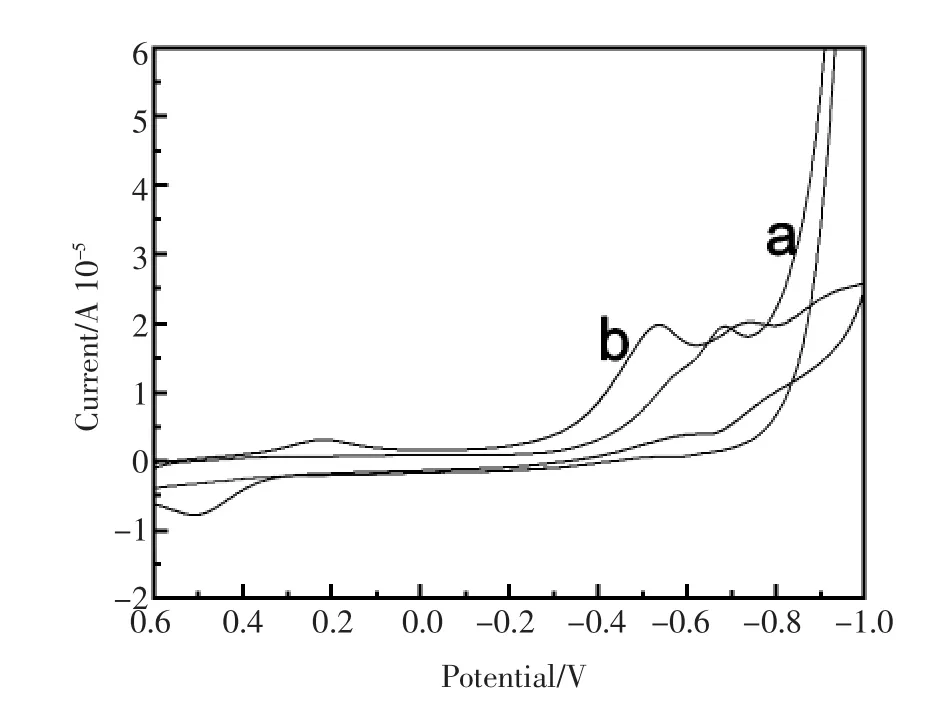
图5 SH-β-CD/GNP/GCE电极在空白PBS溶液(pH= 6.0)(a)以及含有0.01 mmol/L DNR的PBS溶液(b)中的循环伏安曲线Fig.5 CVs of SH-β-CD/GNP/GCE in PBS(pH=6.0)(a) and PBS containing 0.01 mmol/L DNR(b)
图6为裸GCE和修饰电极GNP/GCE和SH-β-CD/GNP/GCE分别在含DNR 0.01 mmol/L的PBS溶液(pH=6.0)中的循环伏安图。结果显示,与DNR在裸GCE在0.5 V处的氧化峰及0.25 V处的还原峰(6 a)相比,DNR在修饰电极GNP/GCE上的氧化还原峰信号 (图6 b)明显增强。这是由于GNP对DNR的氧化还原有着良好的催化活性,同时由于GNP的较大比表面积和良好的电子传导能力,使氧化还原峰电流有着明显的增强。图6 c为DNR在SH-β-CD/GNP/GCE上的循环伏安图,显示其氧化还原峰电流稍弱于GNP/GCE电极,但是仍然远远大于GCE。这可能是由于和GNP相比,SH-β-CD的多糖结构不利于电子的转移造成峰电流的下降。虽然实验结果显示GNP/GCE修饰电极对DNR的响应信号最强,但是由于GNP对很多化合物有着无选择的催化氧化作用,而SH-β-CD与DNR的特异性结合可提供特异性信号,提高传感器的抗干扰性。综合考虑,修饰电极SH-β-CD/GNP/GCE可极大提高电化学响应信号,同时具有很好的选择性。
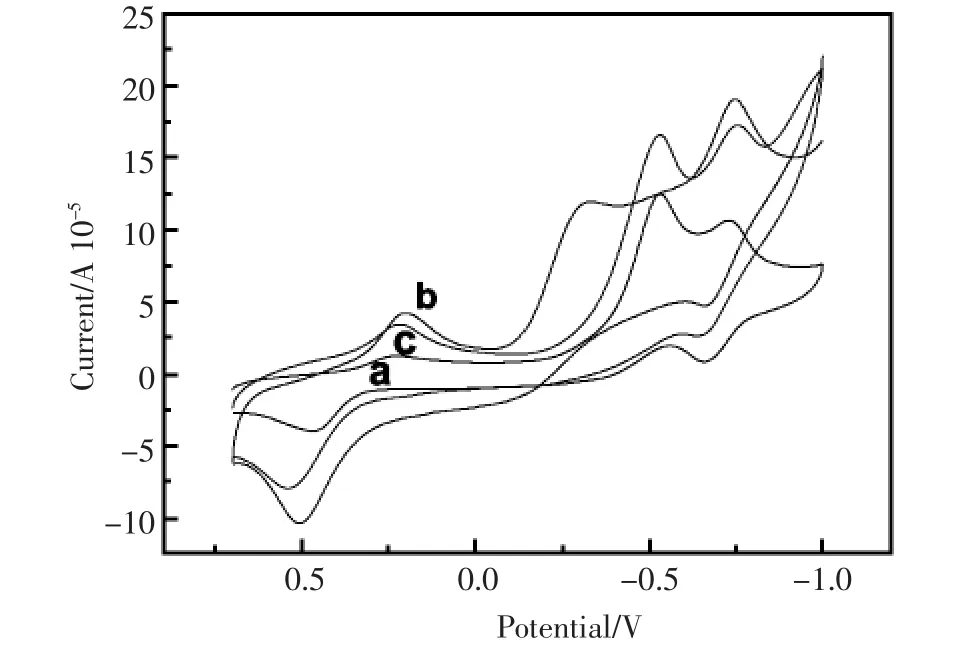
图6 不同电极在含DNR 0.01 mmol/L PBS溶液(pH=6.0)中的循环伏安图(a)裸GCE;(b)GNP/GCE;(c)SH-β-CD/GNP/GCEFig.6 CVs of different electrodes in PBS(pH=6.0) containing 0.01mmol/L DNR:bare GCE(a),GNP/GCE(b), SH-β-CD/GNP/GCE(c)
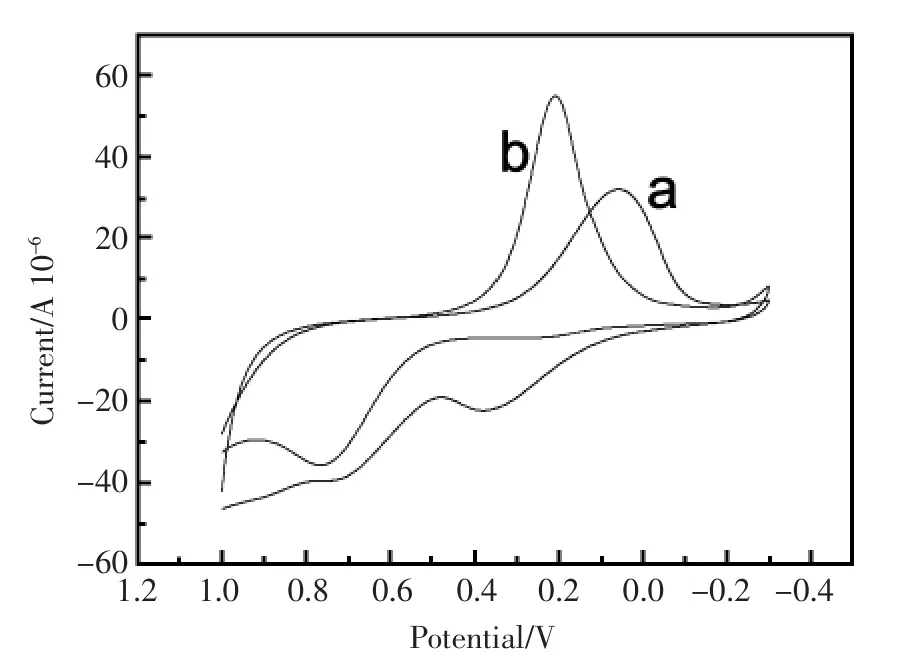
图7 修饰电极SH-β-CD/GNP/GCE在含DNR 0.01 mmol/L的不同底液中的循环伏安图:(a)在Tris中;(b),在PBS溶液中。溶液pH=6.0Fig.7 CVs of SH-β-CD/GNP/GCE in different solutions containing 0.01 mmol/L DNR:(a)pH=6.0 Tris;(b)pH= 6.0 PBS
2.3 实验条件的优化
2.3.1 溶剂体系的选择
分别考察了Tirs和PBS为底液时,DNR在修饰电极SH-β-CD/GNP/GCE上的电流响应特性(图7)。图7a是以pH=7.4 Tirs为溶剂,图7b是以pH=7.4 PBS为溶剂进行电化学测试获得。
mV/s、200 mV/s、250 mV/s。由图可见,还原峰电流均随着扫速的增加而增加,峰电位无明显变化。内插图为还原峰电流与扫速的线性关系图,线性回归方程为Ip(μА)=-0.067υ(mV/s)+1.509,r =0.9990。由此说明,在50 mV/s~250 mV/s范围内,氧化峰电流与扫描速度成良好的线性关系,该反应为表面控制的电极反应过程。以下实验选择扫速为200 mV/s。结果显示,PBS为溶剂时(图7b),DNR的氧化还原信号峰形更好,峰电流更大,明显优于以Tris为底液的体系。以下的所有电化学测试均采用PBS溶液为底液。在DNR的PBS溶液 (pH 6.0)中,0.25 V处的还原峰峰形及峰电流强度均优于0.75 V处的氧化峰,因此,选择该还原峰为目标检测信号。
2.3.2 扫速对DNR电化学信号的影响探究
图8为SH-β-CD/GNP/GCE在含DNR 0.01 mmol/L的PBS溶液(pH=6.0)中,不同的电位扫描速度(简称:扫速)下的循环伏安图。曲线由内而外,其扫速依次为50 mV/s、100 mV/s、150
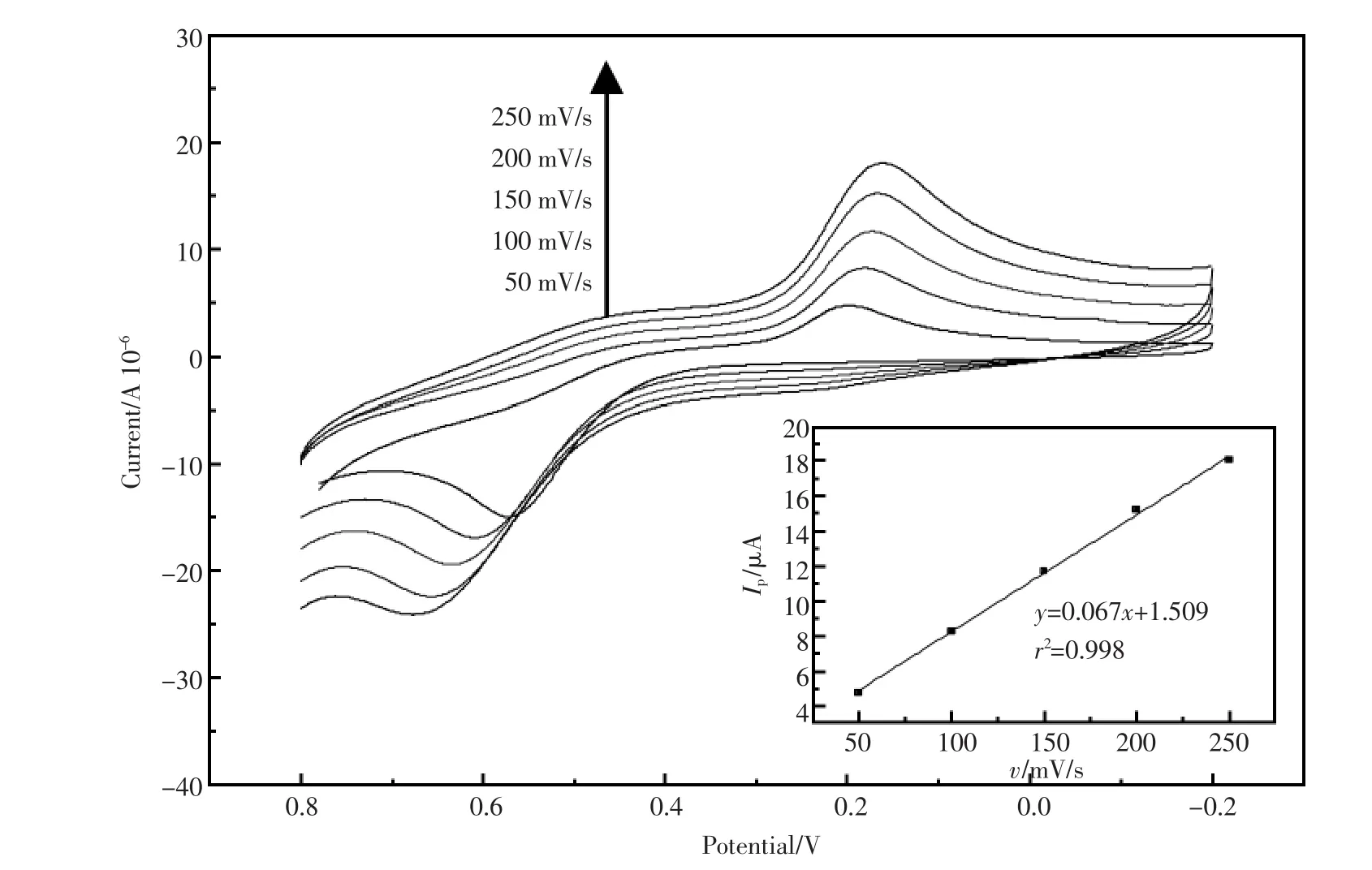
图8 修饰电极SH-β-CD/GNP/GCE在含DNR 0.01 mmol/L的PBS溶液(pH=6.0)中不同扫速下的循环伏安图;内插图:峰电流与扫速的线性关系图Fig.8 CVs of SH-β-CD/GNP/GCE in pH=6.0 PBS containing 0.01 mmol/L DNR at different scan rates(mV/s)
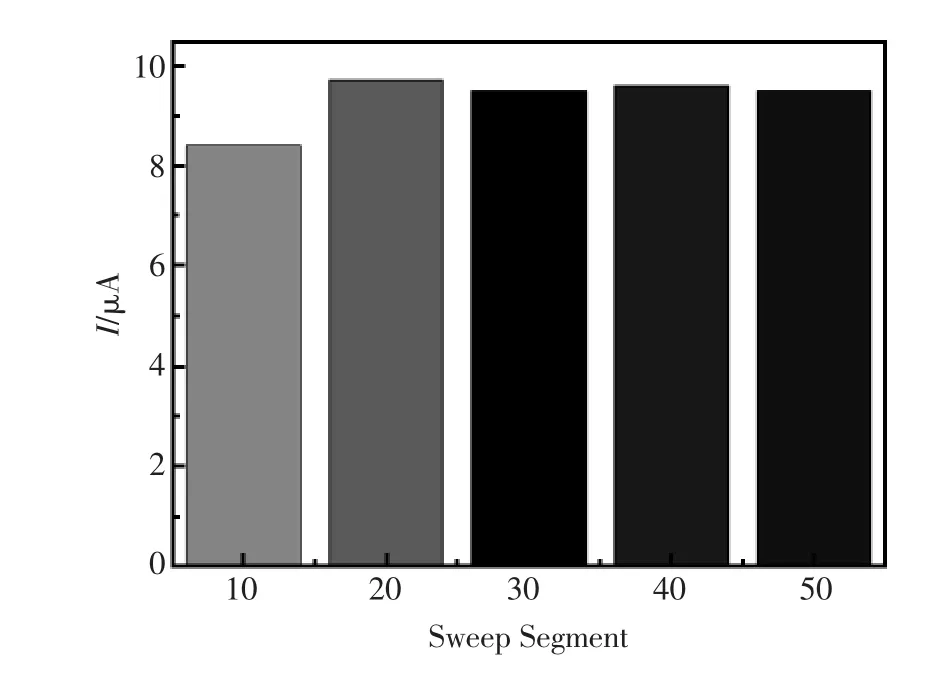
图9 扫描圈数与还原峰电流的关系示意图Fig.9 The relationship of between segment and reductive peak current
2.3.3 GNP沉积量对DNR电化学信号的影响
GNP的沉积量会对其表面积有一定影响,从而影响其对DNR的催化效果。图9显示了电化学方法沉积GNP时,扫描圈数(Segment)与峰电流的关系示意图。如图所示,当以5 mmol/L的氯金酸溶液为电解质溶液,在扫描电压为-0.3 V~0.0 V,扫速50 mV/s条件下进行电沉积,在扫描圈数<20时,还原峰电流随着扫描圈数的增加而增加,并在经20圈扫描时达到最大值;当扫描圈数>20时,还原峰电流出现轻微降低,并达到一种
稳定状态。这可能是由于当扫描圈数为20时,有着最大比表面积,当超过此量,随着GNP的增多,GNP间缝隙减少,修饰电极表面粗糙度下降趋于光滑,有效表面积下降,并达到一个稳态。因此,沉积GNP选择扫描圈数为20圈。
2.3.4 SH-β-CD修饰时间对DNR还原峰电流的影响
巯基-β-环糊精(SH-β-CD)可通过金硫键强烈的共价结合作用[12]组装到GNP的表面,但是根据文献[13]报道,当Au和巯基的结合少于一定时间(12 h),二者不能形成稳定的金硫键,考虑到这个因素,该工作还考察了SH-β-CD与GNP的组装时间对DNR电化学信号的影响。图10为SH-β-CD组装时间与DNR还原峰电流之间关系示意图。如图所示,该工作分别考察了组装时间(t)分别为:4 h、6 h、8 h、10 h、12 h、13 h、14 h、15 h、16 h时,组装时间对峰电流的影响。当组装时间少于12 h时,随着时间的增加,还原峰电流显著增加,呈线性增长。这可能是由于在t<12 h时,Au-S并未稳定结合,随着时间增长,金硫键越稳定。组装时间为12 h~14 h范围内,还原峰电流呈缓慢增长,并在14 h时达到最大值约为12 μA;当t>14 h后,还原峰电流基本不变达到一种稳态。这可能是由于,当t≥14 h时,Au与-SH形成稳定结合,在GNP的表面形成层有序的SH-β-CD,并达到一种稳态,使得峰电流达到最大值。结果与文献[14-15]所述相一致。因此,后续工作采用t=14 h为最佳SH-β-CD自组装时间。

图10 SH-β-CD自组装时间与DNR还原峰电流之间关系示意图Fig.10 The relationship of between the self-times of SH-β-CD and reductive peak current of DNR
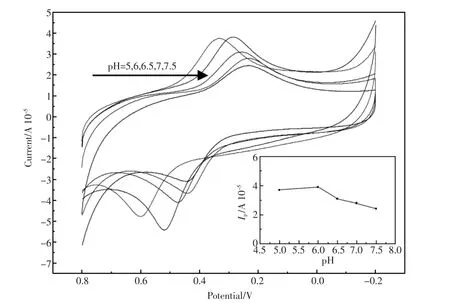
图11 SH-β-CD/GNP/GCE分别在pH值为5.0、6.0、6.5、7.0、7.5含DNR 0.01 mmol/L的PBS溶液中的循环伏安图;内插图为还原峰电流强度与溶液pH值之间的关系图Fig.11 CVs of SH-β-CD/GNP/GCE in different pH containing 0.01 mmol/L DNR
2.3.5 底液pH值对DNR还原峰电流的影响
电极的氧化还原反应过程一般都会有质子和电子的参与,因此待测液的pH值往往对电化学信号有一定影响。图11为SH-β-CD/GNP/GCE分别在pH值为5.0、6.0、6.5、7.0、7.5含DNR 0.01 mmol/L的PBS溶液中的循环伏安图,内插图为
还原峰电流强度与溶液pH值之间的关系图。如图所示,当溶液pH值在6.0~7.5范围内,还原峰的峰电流随着pH值的增加而持续降低,同时峰电位右移。当pH值增大到8.0时氧化峰电流开始减小。同时,随着pH值的增大,氧化峰位置发生负移。pH值在5.0~6.0之间时,还原峰电流强度变化不大。同时,在pH=5.0~7.5范围内,随着pH的增大,还原峰电位右移。以上结果显示,当溶液pH值逐步增大时,质子减少,不利于DNR还原反应的发生[16]。综上,根据实验结果可认为pH=6.0为最佳pH值,在后续工作中,溶剂体系pH值控制为6.0。
2.4 修饰电极对DNR的检测线及线性
图12为修饰电极SH-β-CD/GNP/GCE对一系列浓度DNR(pH=6.0)的DPV电流响应值。从图中可以看出,当DNR浓度低于1.0 μmol/L时,其电流响应值随着DNR浓度增加而迅速增加并成良好线性关系 (左上内插图)。在1.0 μmol/L~ 10 μmol/L范围内,DPV响应电流强度与DNR浓度依然成良好线性关系,但峰电流增长缓慢(右上内插图)。当DNR浓度高于10 μmol/L,其电流响应值达到饱和,不再有明显变化。图12内插图显示了该传感器分两段对不同浓度的DNR响应电流与浓度的线性校正关系,分别为:1.0×10-7~ 1.0×10-6mol/L,线性相关系数r=0.9990;1.0×10-6~ 1.0×10-5mol/L,线性相关系数r=0.9985。检测限为5.0×10-8mol/L(信噪比S/N=3)。
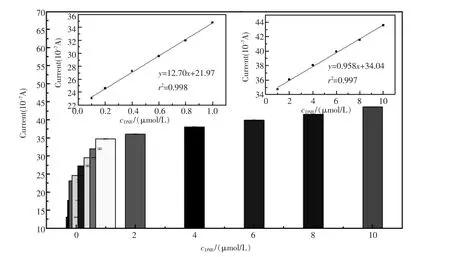
图12 SH-β-CD/GNP/GCE对不同浓度DNR(pH=6.0 PBS)的DPV峰电流响应值内插图:DPV电流响应值对浓度的校正曲线Fig.12 DPVs of SH-β-CD/GNP/GCE in different concentrations of DNR
2.5 SH-β-CD/GNP/GCE的重现性、稳定性及抗干扰实验
在0.5 μmol/L DNR的PBS(pH=6.0)的溶液中,连续测定5次,得到相对标准偏差(RSD)为4.6%;用3支不同的修饰电极分别检测,每支电极测3次,相对标准偏差(RSD)为2.1%,说明该传感器有较好的重现性。采用计时电流法测定,无机离子K+、Na+、Fe3+、Zn2+、NO3-、Cl-、SO42-和PO43-等对DNR的检测无干扰;加入甘露醇100 μmol/L、尿酸200 μmol/L、20 μmol/L赖氨酸及色氨酸之后测定其干扰,发现甘露醇、尿酸、赖氨酸及色氨酸对DNR的检测几乎没有干扰。当该传感器不用时,置于4℃的PBS(pH=6.0)溶液中保存;一周后,该传感器响应电流为初始的96.8%,1个月后响应电流为原来的91.2%,说明此电极具有良好的稳定性。
2.6 DNR传感器对实际样品的检测
该实验构建的DNR传感器抗干扰能力强,检测限较低,有望应用于尿液中微量DNR的检
测。该工作根据尿液的主要成分 (H2O:95%,尿素:1.8%,尿酸:0.05%,无机盐:1.1%),模拟配置了含有微量DNR的与尿液成分相同的溶液,并进行了回收率测试,结果如表1所示。
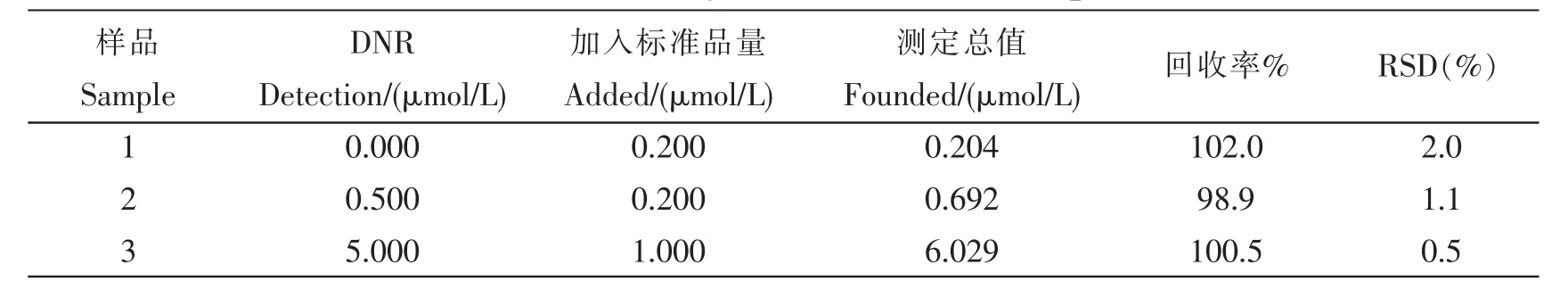
表1 样品检测及回收率测定Tab.1 Recovery of DNR in Real Samples
3 结论
以玻碳电极为基底,采用电沉积法修饰了具有良好生物亲和性、介电特性和较大比表面积的金纳米粒子(GNPs),利用金硫键的稳定结合特性修饰了可与柔红霉素选择性结合的巯基-β-环糊精 (SH-β-CD),成功构建了一种新型的抗癌药DNR的电化学传感器。实验结果表明,该传感器具有良好的选择性和抗干扰性以及较低的检测线。同时,实验结果显示该传感器同时具有很好的稳定性和重现性,为微量的DNR的检测提供了一种可供选择的简便、快速高灵敏度的检测方法。
[1]姚素薇,邹毅,张卫国.金纳米粒子的特性,制备及应用研究进展[J].化工进展,2007,26(3):310-314.
[2]Nikoobakht B, El-Sayed M.Preparation and growth mechanism of gold nanorods(NRs)using seed-mediated growth method[J].Chem.Mater.,2003,15:1957-1962.
[3]Link S,El-Sayed M A.Spectral properties and relaxation dynamics of surface plasmon electronic oscillations in gold and silver nanodots and nanorods[J].J.Phys. Chem.B,1999,103:8410-8426.
[4]Sun Y,Xia Y.Shape-Controlled Synthesis of Gold and Silver Nanoparticles[J].Science,2002,298:2176-2179.
[5]Liu Xiong,Dai Qiu,Lauren Austin,et al.A one-step homogeneous immunoassay for cancer biomarker detection using gold nanoparticle probes coupled with dynamic light scattering[J].Journal of the American Chemical Society,2008,130(9):2780-2782.
[6]黄文华,王百木,张雷.金纳米颗粒在玻碳电极表面的固载及其对抗坏血酸的电催化氧化[J].理化检验:化学分册,2008,44(4):299-303.
[7]吉玉兰,王广凤,方宾.纳米金/单壁碳管修饰玻碳电极对黄芩苷的电催化作用及快速检测[J].分析试验室,2010,29(6):11-14.
[8]Li Chen-Zhong,Yali Liu,John HT Luong.Impedance sensing of DNA binding drugs using gold substrates modified with gold nanoparticles[J].Analytical chemistry,2005,77(2):478-485.
[9]Grabar K,Smith P,Musick M,et al.Angle-resolved nanosphere lithography:Manipulation of nanoparticle size,shape,and interparticle spacing[J].J.Am.Chem. Soc.,1996,118:1148.
[10]胡瑞省,刘善堂,朱涛,等.金纳米粒子通过形成Au-S键的组装[J].物理化学学报,1999,15(11):961-965.
[11]Cheng Z L,Wang E K,Yang X R.Capacitive detection of glucose using molecularly imprinted polymers[J]. Biosens.Bioelectron.,2001,16(3):179-185.
[12]Jia Guang,Haifang Wang,Lei Yan,et al.Cytotoxicity of carbon nanomaterials:single-wall nanotube,multi-wall nanotube,and fullerene[J].Environmental science& technology,2005,39(5):1378-1383.
[13]Tans Sander J,Michel H Devoret,Hongjie Dai,et al.Individual single-wall carbon nanotubes as quantum wires [J].Nature,1997,386(6624):474-477.
[14]Yu Min-Feng,Bradley S,Files,et al.Tensile loading of ropes of single wall carbon nanotubes and their mechanical properties[J].Physical review letters,2000,84(24): 5552.
[15]Park Cheol,Zoubeida Ounaies,Kent A,et al.Dispersion of single wall carbon nanotubes by in situ polymerization under sonication[J].Chemical physics letters,2002, 364(3):303-308.
[16]Yao Zhen,Charles L Kane,Cees Dekker.High-field electrical transport in single-wall carbon nanotubes[J]. Physical Review Letters,2000,84(13):2941.
Daunorubicin sensor based on gold nanoparticles/mercapto-βcyclodextrin
Wu Lin-jing,Liu Gui-hua,Yan Ya-qian,Huang Sha-sheng*
(Life and Environmental Science College,Shanghai Normal University,Shanghai 200234,China)
A sensitive daunorubicin(DNR)electrochemical sensor was prepared based on depositing gold nanoparticles(GNPs)onto the surface of glassy carbon electrode,and then immobilizing mercapto-β-cyclodextrin on the GNPs.Field emission scanning electron microscopy(FESEM)was used to characterize the morphology of the modified electrode.The electrochemical property of the modified electrode and response characteristics of DNR on the sensor were investigated by cyclic voltammetry and electrochemical impedance spectroscopy.The results showed that the sensor exhibited good electron transfer behavior due to the excellent conductivity of GNPs.Under the optimal experimental conditions,the current response of the sensor to DNR was linear with the concentration of DNR with two sections:1.0×10-7~1.0×10-6mol/L(r=0.9990);1.0×10-6~1.0×10-5mol/L(r=0.9985).The limit of detection was 5.0×10-8mol/L(S/N=3).
daunorubicin;gold nanoparticles;β-cyclodextrin
*通信联系人,E-mail:sshuang@shnu.edu.cn

