辉光放电电解等离子体降解水体中的亚甲基蓝
李敏睿,柳淑娟,班宁宁,李淑珍,俞 洁
(1.兰州理工大学石油化工学院,甘肃兰州 730050;
2.西北师范大学化学化工学院,甘肃兰州 730070)
辉光放电电解等离子体降解水体中的亚甲基蓝
李敏睿1,柳淑娟2,班宁宁2,李淑珍2,俞洁2
(1.兰州理工大学石油化工学院,甘肃兰州730050;
2.西北师范大学化学化工学院,甘肃兰州730070)
摘要:用辉光放电电解等离子体(GDEP)技术对模拟染料废水亚甲基蓝(MB)的降解过程进行了研究.通过紫外光谱(UV)分析了放电电压、催化剂对其脱色率的影响,用电导率仪和酸度计测定了降解液的电导率和pH值的变化.结果表明,在最佳电压为600 V和放电120 min时,可使200 mL 20 mg·L-1的MB的脱色率达到95.40%,脱色降解过程符合动力学一级反应的特征;降解过程中溶液的最大吸收波长发生蓝移,溶液的电导率先迅速增大后逐渐减小,溶液的pH值先减小后存在增大的趋势,说明在放电过程中产生了大量带电离子及酸性中间产物;Fe2+和Fe3+对MB的降解有催化作用,5 min时可使MB的脱色率分别达到95.61%和93.16%;羟基自由基(·OH)对MB的降解起关键作用.
关键词:辉光放电电解等离子体(GDEP);染料废水;亚甲基蓝(MB);降解;羟基自由基(·OH)
近年来,以湿式氧化、光催化氧化、臭氧氧化、电化学氧化等为代表的高级氧化工艺为染料废水的脱色降解提供了新思路.高级氧化工艺的作用机理是通过不同途径产生羟基自由基(·OH)的过程[3].·OH的标准电极电位为2.80 V,仅次于F2的电极电位(2.87 V),高于H2O2的电极电位(1.77 V),是一种氧化能力极强的氧化剂.·OH主要通过电子转移、亲电加成、脱氢反应等途径无选择地攻击水体中的各种有机污染物,直至最终降解为CO2,H2O和其他矿物质[4].
辉光放电电解等离子体(GDEP)技术是一种新型的高级氧化技术.其采用石墨碳棒为阴极,特殊工艺制作的铂丝为阳极,当两极间的电压足够高时,阳极针状电极与周围电解液之间产生·OH,O·,H·,H2O2等高活性粒子,同时伴随有辉光、紫外光辐射、冲击波等物理化学效应,因此对污染物的降解是多种效应协同作用[5].该法具有设备简单、投资小、无二次污染、降解彻底等优点而成为近年来的研究热点[5-8].大量研究表明,GDEP可使水体中的染料脱色率达90%以上[2,6,9],然而以往研究基本属于降解条件的优化探索,在提高降解效率和降解机理方面的研究较少.因此,本文以硫酸钠溶液的亚甲基蓝(MB)为模拟废水,利用紫外光谱、电导率仪和酸度计,研究了放电电压、催化剂等对染料脱色降解的影响,同时探讨降解机理,为深入了解辉光放电等离子体降解有机污染物提供实验依据.
1实验部分
1.1试剂与仪器
亚甲基蓝(MB)为生物制剂(上海中秦化学试剂有限公司);CuCl2,FeCl2,FeCl3,Na2SO4均为分析纯;实验所用其他试剂均为分析纯;溶液采用一次蒸馏水配制.
LW100J1型直流稳压稳流电源(上海力友电器有限公司),电压0~1000 V,电流0~1 A;UV 757CRT Ver 2.00紫外-可见分光光度计(上海科恒实业发展有限公司);DDSJ-308F型电导率仪(上海雷磁仪器厂);PHS-43型pH计(上海仪电科学仪器股份有限公司).
1.2实验方法
实验装置见文献[9].由直流稳压稳流电源和反应器构成.阳极为直径0.5 mm的铂丝,阴极为直径5 mm 的碳棒.反应液体积为200 mL,用2 g·L-1Na2SO4溶液配制而成的20 mg·L-1的MB作为模拟染料废水,降解过程中持续搅拌,温度保持在(30±2 )℃.MB的脱色率(η)根据(1)式计算[2]:
(1)
其中,A0为初始溶液的吸光度;At为放电tmin时溶液的吸光度.
2结果与讨论
2.1电流-电压曲线
由于MB模拟染料废水降解液的导电能力差,因此要使溶液导电必需添加一定的支持电解质.虽然可以找到可溶性的无机盐作为电解质,但因为硝酸盐和氯化物电解时在阳极上生成各种有毒有害的氮化物气体或有刺激性气味的氯气,因此不宜采用.由于Na2SO4溶液不参加电解反应,可以保持溶液导电的稳定性.因此本实验选用Na2SO4溶液为支持电解质.
图1为2 g·L-1Na2SO4溶液中GDEP的电流-电压曲线.DE段(大于500 V)发出辉光,产生等离子体,等离子体是可以导电的,因而,正常放电情况下,电压升高,电流增大,同时阳极周围产生的辉光越强.图1内插图为电压为600 V时的辉光照片,可以看出,辉光呈现黄色,这是因为溶液中有Na+,而Na+的焰色反应呈现黄色.本实验选中用550,600,650 V电压研究染料降解过程.
2.2不同电压下脱色率随降解时间的关系
在中性溶液中,考察了不同电压下脱色率随时间的变化关系,结果见图2.可以看出,随放电时间的延长,脱色率逐渐增大,说明染料MB逐渐被氧化降解.同时可以看出,同一时间内,放电电压越高,脱色率越大.如60 min时,电压为550,600,650 V的脱色率分别达到20.26%,59.67%,76.83%;120 min时,电压为550,600,650 V的脱色率分别达到47.46%,95.40%,98.97%.这是因为电压升高,放电产物(·OH,O·,H·,H2O2等高活性粒子和紫外光等)浓度和强度增加,导致·OH与MB分子进行有效碰撞使其氧化降解的几率增大[11].从理论上说电压越高脱色速率越快,降解越彻底,但电压高,能耗大,且当电压大于650 V 时,阳极铂丝很容易熔化.因此,本实验选用600 V为最佳放电电压.
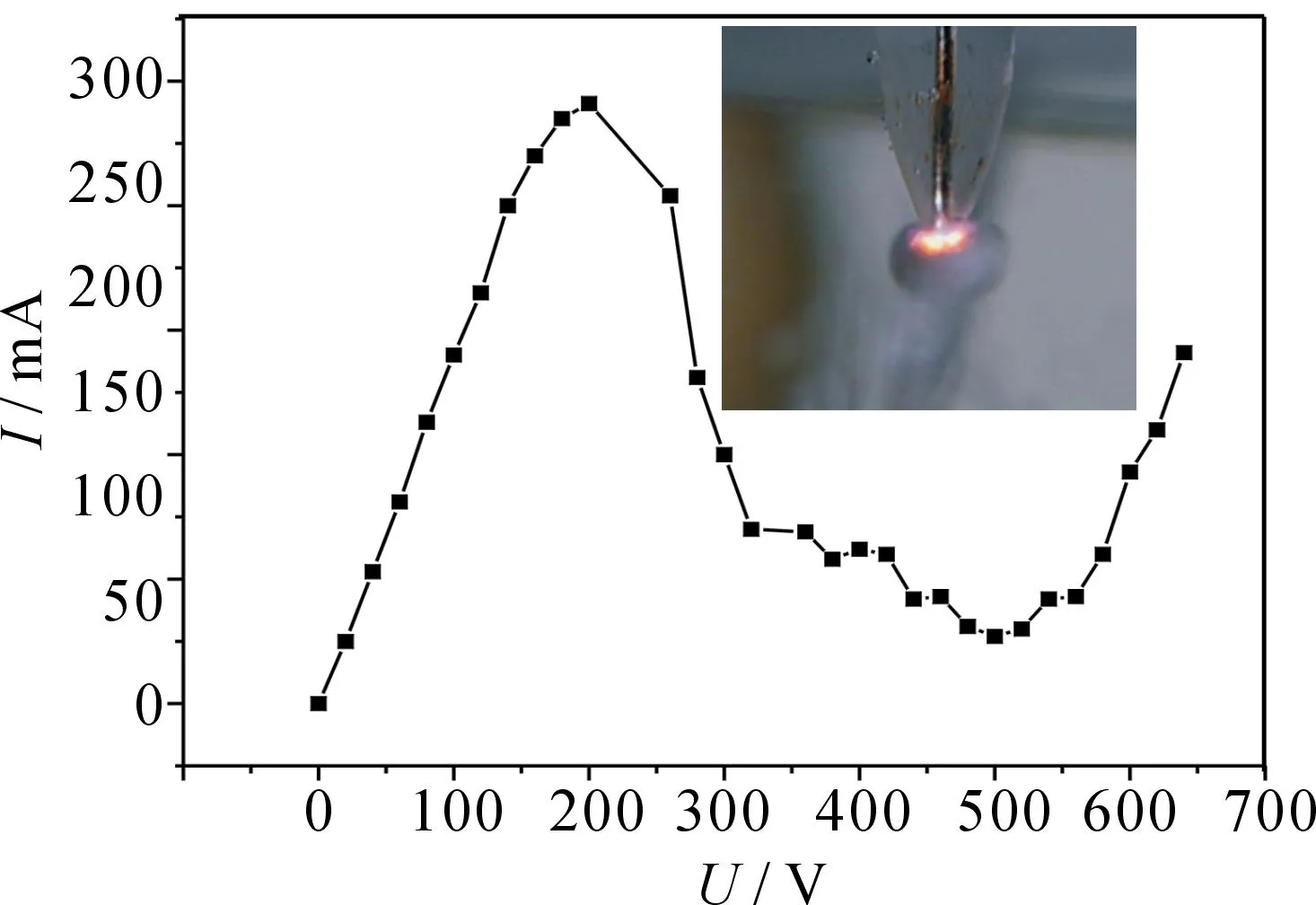
图1 辉光放电等离子体的电流-电压曲线
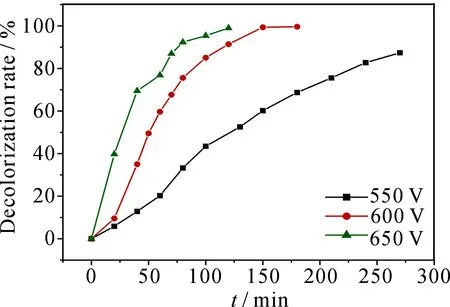
图2 不同电压下MB的脱色率随放电时间的变化
2.3亚甲基蓝降解过程中的紫外-可见吸收光谱
200 mL的20 mg·L-1MB在600 V电压下的紫外-可见吸收光谱随放电时间的变化见图3.可以看出,MB在293和664 nm处存在明显的吸收峰,分别对应苯环的B吸收带和骨架共轭体系的吸收带,这些吸收峰的强度随放电时间的延长而减小,另外,最大吸收波长(664 nm)处的吸收峰发生蓝移(低波长方向移动),这是由于放电处理使发色基团的结构被破坏,形成中间产物[12];同时,MB降解过程中产生羧酸类物质导致溶液的pH发生变化,最终也可能使最大吸收峰蓝移.放电180 min 后,吸光度已基本变为0,说明辉光放电等离子体对染料MB的降解效果显著.
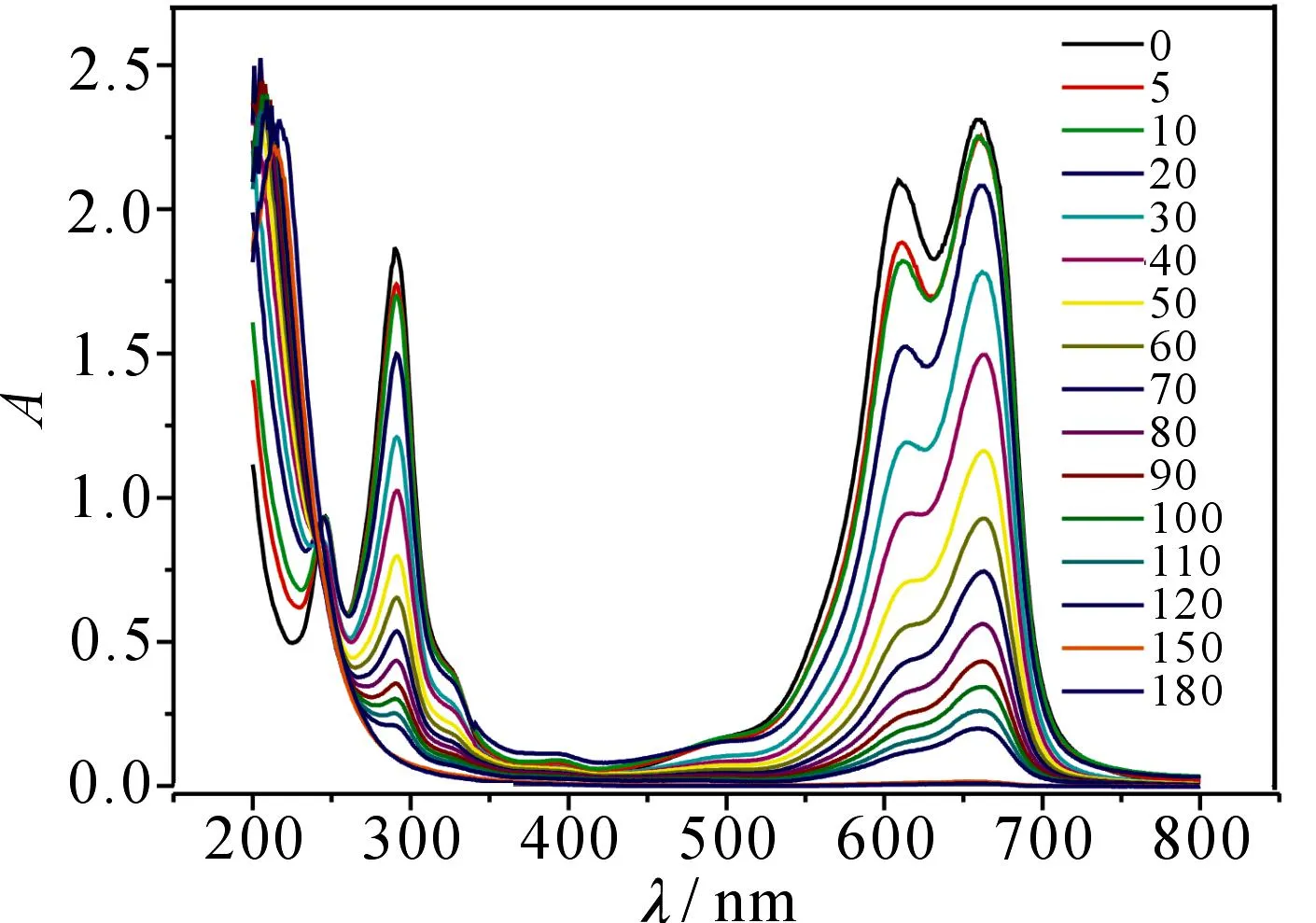
图3 MB溶液紫外-可见吸收光谱随降解时间的变化
2.4MB的降解动力学特征
为研究辉光放电等离子体降解MB的动力学过程,在664 nm处测量MB在不同放电时间的吸光度A,以ln(A0/At)对时间t作图,结果见图4.由图4可知,ln(A0/At)与降解时间t有很好的线性关系,其线性相关系数R2=0.997 9,动力学常数k=0.024min-1.表明辉光放电等离子体对MB的降解遵循一级动力学特性,此结果和许多文献报道一致[2,9].
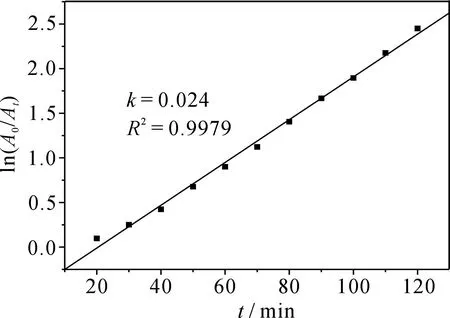
图4 ln(A0/At)对时间t的变化
2.5溶液电导率和pH的变化
图5为200mL的40mg·L-1MB在不同放电时间下溶液的电导率变化.由图可知,随着放电时间的延长,溶液的电导率先迅速增大后缓慢减小,在20min时溶液的电导率由2.68mS·cm-1增大到3.35mS·cm-1,之后逐渐减小,180min时电导率减小为3.04mS·cm-1.图6为相同条件下溶液pH随放电时间的变化曲线,可以看出,60min内,溶液pH由最初的6.46逐渐减少到3.755,120min后pH降为最低达到3.45,之后pH又存在逐渐升高的趋势,180min达到3.78.所有上述结果说明,在MB降解的初始阶段,不断有带电离子和酸性中间产物产生,之后这些中间产物降解为CO2、H2O和简单无机盐,导致电导率先增大后减小,pH先减小后缓慢增大[2,13].
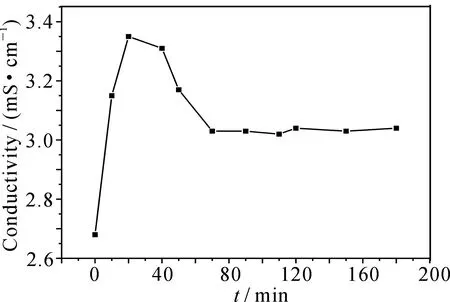
图5 MB降解液的电导率随时间的变化
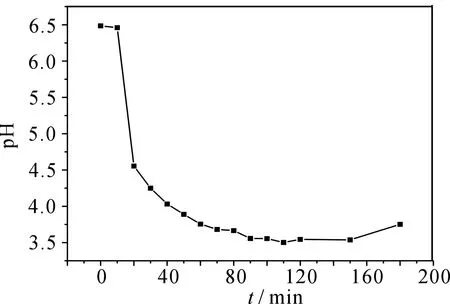
图6 MB降解液的pH随时间的变化
2.6不同催化剂对降解的影响
保持其他条件不变,在pH=6.5的MB溶液中分别各加入0.2mmolCu2+,Fe2+和Fe3+,同时与未加金属离子的MB的脱色效果进行比较,结果见表1.由表1可以看出,加入Fe2+和Fe3+,降解速度加快,5min时脱色率分别达到95.61%和93.16%;10min时降解完全,脱色率分别达到98.04%和98.14%,说明Fe2+和Fe3+对MB的降解有催化作用.这是因为辉光放电电解过程中产生·OH,O·,H·,H2O2等活性粒子,当Fe2+或Fe3+存在时,可与反应体系中的H2O2构成Fenton试剂,生成大量氧化性更强的·OH.其机理如下[5]:
(2)
Fe3+也能把H2O2间接转换为·OH:
Fe3++H2O2→Fe2++HO2·+H+,
(3)
Fe2+继续参与反应(2),生成·OH;反应(3)产生的HO2·又可继续如下反应[8]:
HO2·+H2O2→H2O+O2+·OH.
(4)
由于·OH的氧化性比H2O2的强,因此,·OH较H2O2对有机污染物的降解更快速,更彻底(·OH的寿命极短、反应速率常数大)[3].由表1可以看出,加入0.2 mmol的Cu2+后,20 min时MB的脱色率为34.92%,相比无催化剂时的脱色率9.52%有一定的提高,这可能是加入Cu2+后溶液中导电离子数目增多,辉光增强,单位时间内产生更多的·OH所致.
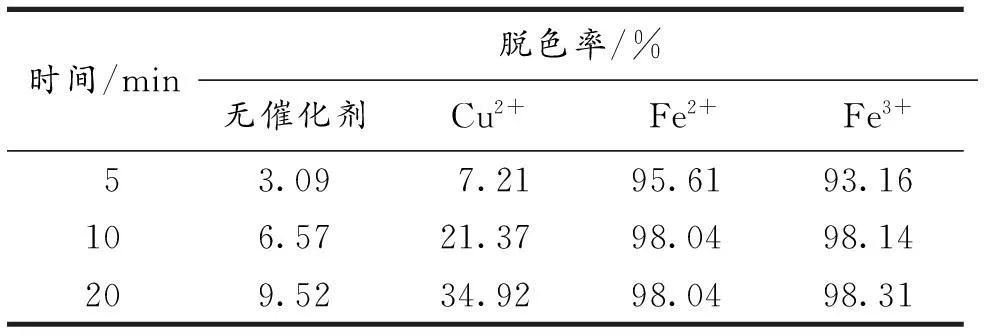
表1 催化剂对MB脱色率的影响
图7为加入Fe2+后放电0和5 min时的紫外光谱,可以看出,5 min后染料基本降解完全,降解率达到95.61%,吸收峰全部消失,无新的吸收峰产生,说明·OH无选择性地攻击染料分子,最终降解为CO2,H2O和其他矿物盐[14].
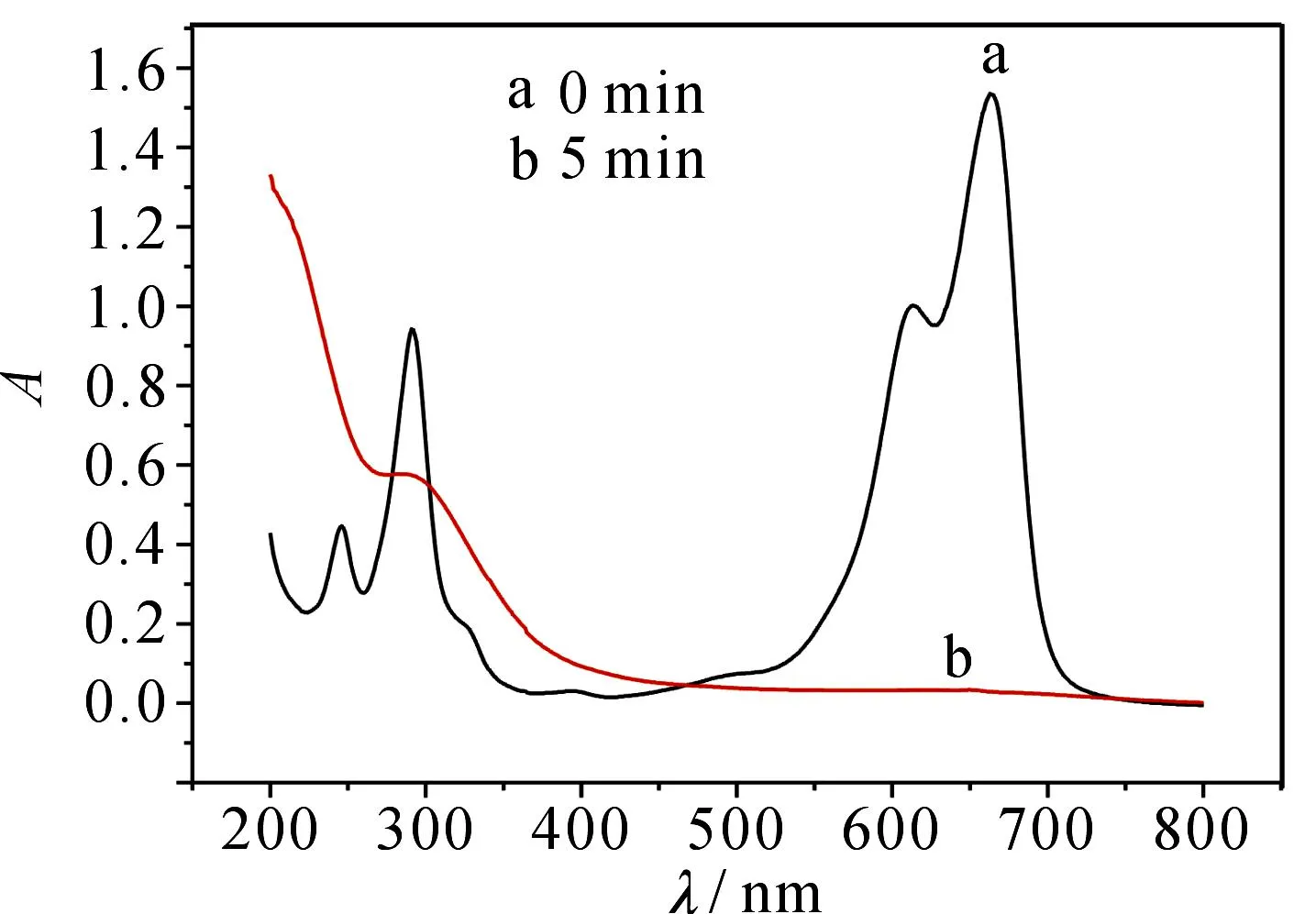
图7 Fe2+存在下放电0和5 min时的紫外光谱
2.7应机理探讨
在辉光放电的强电场作用下,活性粒子·OH,O·,H·,H2O2等主要由高能电子(5~15 eV)与水分子(H—OH 键能4.96 eV)的碰撞反应获得,主要反应包括[14]:
(5)
(6)
(7)
(8)
(9)
(10)
(11)
当存在Fe2+和Fe3+时,可与GDEP产生的H2O2反应生成大量的·OH[8].当MB存在时,·OH首先与染料分子发生羟基化反应,形成加成产物,使最大吸收峰发生蓝移;接着MB环破裂,生成羟基化中间产物和羧酸类物质,导致电导率增大,pH减小;最终生成CO2,H2O和简单无机盐,使电导率下降,pH呈上升趋势.
3结论
辉光放电电解等离子体(GDEP)是一种性能优异的高级氧化技术,产生的羟基自由基(·OH)可使模拟染料废水亚甲基蓝(MB)彻底氧化脱色.通过上述实验可以得出以下结论:
1)放电电压越高,脱色率越快,在最佳电压为600 V时,120 min内可使200 mL 20 mg·L-1的亚甲基蓝脱色率达到95.40%;降解过程中,664 nm处的最大吸收峰发生蓝移,这是由于放电产生的·OH使发色团的结构破坏,形成中间产物.
2)辉光放电等离子体降解MB的过程符合动力学拟一级反应的特点,一级动力学常数k=0.024 min-1,相关系数R2=0.997 9.
3)降解过程中随着放电时间的延长,溶液的电导率先增大后减小,溶液的pH先降低之后又存在逐渐升高的趋势.说明在MB降解的初始阶段,不断有带电离子和酸性中间产物产生,之后这些中间产物降解为CO2,H2O和简单无机盐.
4)Fe2+和Fe3+对染料MB的降解有催化作用.这是因为辉光放电电解过程中产生的H2O2可与Fe2+和Fe3+构成Fenton试剂,生成大量氧化性更强的·OH.
参考文献:
[1]程云,周启星,马奇英,等.染料废水处理技术的研究与进展[J].环境污染治理技术与设备,2003,4(6):56-60.
[2]张敏,高爱华,郭乐慧,等.辉光放电等离子体降解番红花红T染料废水[J].水处理技术,2014,40(10):103-107.
[3]JIANGBo,ZHENGJing-tang,QIUShi,etal.Reviewonelectricaldischargeplasmatechnologyforwastewaterremediation[J].Chem Eng J,2014,236:348-368.
[4]BRISSETJL,MOUSSAD,DOUBLAA,etal.Chemicalreactivityofdischargesandtemporalpost-dischargesinplasmatreatmentofaqueousmedia:Examplesofglidingdischargetreatedsolutions[J].Ind Eng Chem Res,2008,47:5761-5781.
[5]WANGXiao-yan,ZHOUMing-hu,JINXing-long.Applicationofglowdischargeplasmaforwastewaterreatment[J].Electrochimica Acta,2012,83:501-512.
[6]GAOJin-zhang,YUJie,LIYan,etal.DecolorationofaqueousBrilliantgreenbyusingglowdischargeelectrolysis[J].J Hazard MaterB,2006,137:431-436.
[7]WANGLei,JIANGXuan-zhen.Unusualcatalyticeffectsofironsaltsonphenoldegradationbyglowdischargeplasmainaqueoussolution[J].J Hazard Mater,2009,161:926-932.
[8]刘永军,王蕾,孙冰.液相辉光放电等离子体降解苯酚的机理[J].大连海事大学学报,2012,38(3):107-111.
[9]陆泉芳,俞洁.辉光放电等离子体降解模拟染料废水的研究[J].环境科学学报,2006,26(11):1799- 1803.
[10]陈日耀,郑曦,陈晓,等.电化学方法生成羟基自由基及其在染料降解脱色中的应用——电解槽中的能量分析[J].吉林化工学院学报,2001,18(3):1-4.
[11]陆泉芳,俞洁,刘永军,等.接触辉光放电等离子体降解水体中的对氯硝基苯[J].西北师范大学学报:自然科学版,2003,39(1):49-53.
[12]张嵚,程晓迪,徐观军,等.UV/TiO2降解亚甲基蓝染料废水的动力学特性及影响因素[J].江西农业大学学报,2012,34(6):1273-1280.
[13]汪煜,金星龙,刘兴旺,等.多电极接触辉光放电等离子体降解水中酸性橙的研究[J].天津理工大学学报,2013,29(1):56-60.
[14]JOSHIAA,LOCKEBR,ARCEP,etal.Formationofhydroxylradicals,hydrogenperoxideandaqueouselectronsbypulsedstreamercoronadischargeinaqueoussolution[J].J Hazard Mater,1995,41:3-30.
(责任编辑陆泉芳)
E-mail:liminrui503@126.com
Degradation of methylene blue in aqueous solution
by glow discharge electrolysis plasma
LI Min-rui1,LIU Shu-juan2,BAN Ning-ning2,LI Shu-zhen2,YU Jie2
(1.College of Petrochemical Technology,Lanzhou University of Technology,Lanzhou 730050,Gansu,China;
2.College of Chemistry and Chemical Engineering,Northwest Normal University,Lanzhou 730070,Gansu,China)
Abstract:Degradation of methylene blue(MB)solutions has been investigated by glow discharge electrolysis plasma(GDEP).The effects of applied voltage and catalyst on the discoloration rate are detected using ultraviolet(UV) absorption spectra.The conductivity and pH of MB solution in the degradation process are also recorded by conductivity meter and acidity meter.The results show that the discoloration rate of 20 mg·L-1MB is up to 95.4% after treating 120 min in 600 V.The degradation process follows the pseudo-first order kinetics.The maximum absorption wavelength of MB solution in 664 nm is produced blue shift in the process of degradation.The conductivity of degradation solution increases first and then reduces;however,the pH of the solution reduces first and then increases.All these indicate that a large number of charged ions and acidic substance are produced during the discharge process.Fe2+and Fe3+have certain catalytic effect for the degradation of MB.In the presence of Fe2+and Fe3+,the decolorization rate of MB within 5 min can reach 95.61% and 93.16%,respectively.Hydroxyl radical (·OH) may play a major role for the degradation of MB in the discharge process.
Key words:glow discharge electrolysis plasma(GDEP);dye wastewater;methylene blue(MB);degradation;hydroxyl radicals(·OH)染料废水是难处理的工业废水之一,具有色度深、成分复杂、有机污染物含量高和水质变化大的特点.大多数染料为有毒难降解有机物,化学稳定性强,具有致癌、致畸、致突变等危害,严重破坏水体、土壤及生态环境,危害人类健康[1].如何迅速有效地去除水体中的污染物质,一直是环保工作者努力探索的课题.目前,有机染料废水的处理方法常采用氧化、吸附、膜分离、絮凝、生物降解等,这些方法各有优缺点,如运行成本高,处理效果欠佳等[1,2].
中图分类号:X 523
文献标志码:A
文章编号:1001-988Ⅹ(2015)02-0042-05
作者简介:李敏睿(1981—),女,甘肃天水人,副教授,博士.主要研究方向为超分子化学和水处理技术.
基金项目:甘肃省自然科学基金资助项目(1212RJYA018,1208RJZA161,1308RJZA144);甘肃省高等学校科研项目(2013A-019)
收稿日期:2014-09-02;修改稿收到日期:2014-12-10

