烯虫酯的纯化
欧阳逊,刘松梁,姚明明,曾 洁,张广吉
(中国桂林昊旺生物科技有限公司科研中心,广西 桂林 541000)
安全、低毒、低残留、高效、方便和经济等是农药生产的基本原则,这些原则是农药和农业发展的基本要求,也是当今人们对环境友好生产的诉求[1],满足这些要求当推生物农药。ZR-型保幼激素即是一种典型生物农药,不仅是一种具备保幼激素活性的高效昆虫生长调节剂,而且生物活性和稳定性都远远超过天然保幼激素[2-4]。其中ZR-515是广西昊旺生物科技有限公司主打产品,于2014年12月建成投产,实现了国内首家工业化规模生产保幼激素类似物烯虫酯(11-甲氧基-3,7,11-三甲基-2E,4E-十二烯酸异丙酯)。
作为农药原药,投放市场前须办理农药登记,办理农药登记需提供一定数量高纯的烯虫酯(>98%),以及原药中存在的杂质成分确认。目前车间生产的烯虫酯含量在92%左右,仅在合格范围内,与高纯原药含量有较大差距,需通过一定手段纯化方能取得。
鉴于烯虫酯性黏,饱和蒸气压低,同时对温度敏感,不宜用蒸馏除去可能存在的杂质;同时可能存在的杂质分子量与烯虫酯分子量比较接近,也不适合分子蒸馏法提纯;比较可行的纯化方法有高效液相制备及提纯。但据相关单位信息,提纯100g费用4~5万,是一笔不小的费用。本公司科研中心实验室通过一段时间摸索,采用柱层析方法进行分离提纯,制得高纯烯虫酯。
1 仪器和试剂
福立气相色谱仪(9790Ⅱ),岛津液相色谱仪,玻璃层析柱(30mm×400mm),柱层析硅胶(0.038~0.049mm),三用紫外分析仪,硅胶板(50mm×100mm),旋转蒸发仪。
正己烷(95%),丙酮(AR),癸二酸二丁酯(GD),甲醇(GR),烯虫酸标准样品(>99%),烯虫酯(87% ~93%)。
2 烯虫酯的含量测定分析
烯虫酯含量测定普遍使用气相色谱和高效液相色谱分析[5-6],本研究采用气相色谱与液相色谱结合分析烯虫酯含量[7]。
2.1 气相色谱分析
2.1.1 仪器
气相色谱仪:氢火焰离子化检测器,气相工作站。色谱柱:OV-1701,30m×0.32mm×0.5μm毛细管柱。微量进样器:10μL。
2.1.2 气相色谱条件
温度:柱室240℃,汽化室270℃,检测室270℃。
气体流量:载气 (N2) 30 mL∙min-1,H230mL·min-1,Air 300 mL·min-1。
进样量:1.0μL;保留时间:烯虫酯约5.2min,内标物约6.3min,参见图1。
2.1.3 测定步骤
2.1.3.1 标准溶液的配制
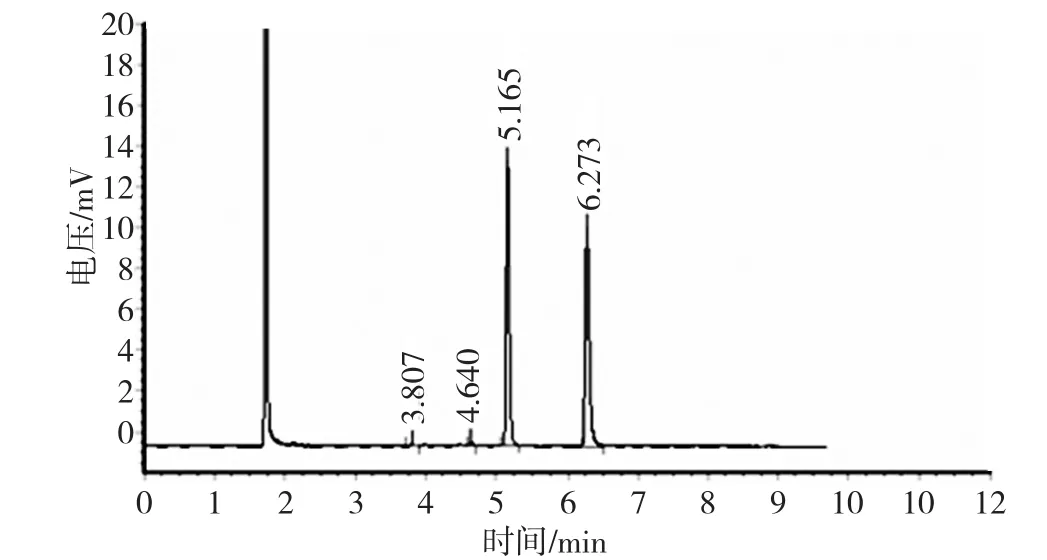
图1 内标法测定烯虫酯出峰情况
称取烯虫酯标准样一定量(精确至 0.0002g),置于10mL容量瓶中,准确加入2.0mL内标物(癸二酸二丁酯),用丙酮溶解并稀释至刻度,摇匀,备用。
2.1.3.2 试样溶液的配制
称取烯虫酯与标准样相同的量(精确至0.0002g),按2.1.3.1同法操作。
2.1.3.3 测定
分别取标准样溶液进样3次和试样溶液进样2次测定。
2.1.3.4 计算
由测得的3次标准样烯虫酯与内标物峰面积之比计算平均值,同时测2次试样烯虫酯与内标物峰面积之比,计算平均值,按下式计算烯虫酯含量X。
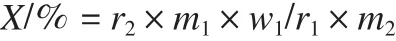
式中:r1为标准样烯虫酯与内标物峰面积之比算平均值;r2为试样烯虫酯与内标物峰面积之比算平均值; m1为标准样烯虫酯质量;m2为试样烯虫酯质量; w1为标准样烯虫酯质量分数。
平行测定2次试样,结果允许误差不大于1.5%。
2.2 高效液相色谱分析
2.2.1 仪器
色谱柱:C18,5μm,150mm×4.6mm;流动相:流速 1.0mL·min-1, V甲醇/V水= 85/15;检测波长:270nm;柱温:35℃ ;进样量: 4.6μL。
2.2.2 测定步骤
取一定量标准样烯虫酯溶解于100mL容量瓶中,从中取5mL用甲醇稀释到50mL,同法配制试样烯虫酯溶液。在相同条件下各平行进样2次,测得标准样积分面积A标样和试样的积分面积A试样,取平均值。
2.2.3 计算
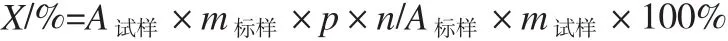
式中:A试样为试样的面积;A标样为标准样的面积;m试样为试样的质量,g;m标样为标准样的质量,g;p为标准样的含量,%;n为试样溶液的稀释倍数与标准样溶液的稀释倍数比。
平行2次测得结果面积的绝对误差小于0.5%.
3 烯虫酯的定性分析
高效液相色谱对烯虫酯检测的灵敏性可用于其定性分析,分析操作可按照2.2的步骤进行,从而可判断烯虫酯可能存在的杂质个数,具体见图2、图3、图4。
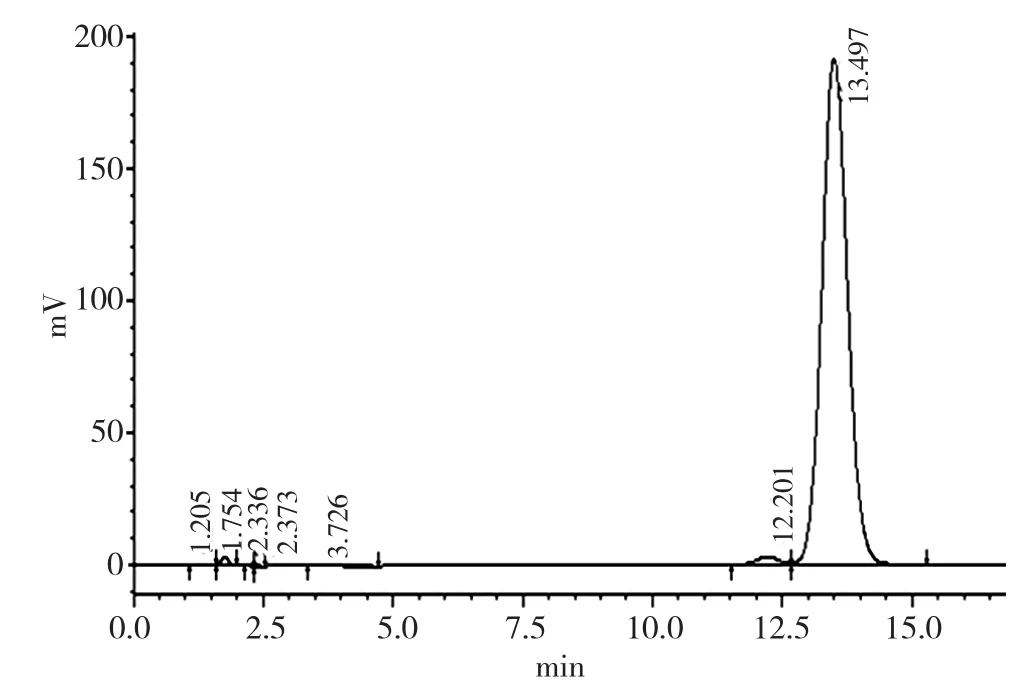
图2 烯虫酯标样液相图谱
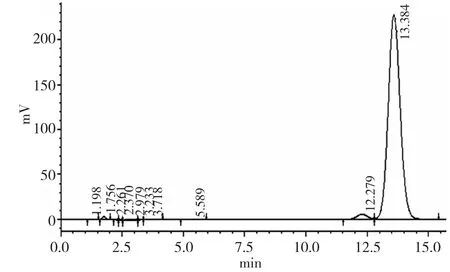
图3 纯化烯虫酯(99.22%)图谱

图4 烯虫酯原样(88%)图谱
从以上3个图谱可看出,经纯化后烯虫酯3.605min处的杂质基本去除,9.322min的杂质去除,12.279min处和1.756min处的杂质仍然存在(参见图3),但含量变少。
4 烯虫酯的纯化
鉴于烯虫酯作原药登记需提供一定量的高纯烯虫酯,而且还可部分用于企业内部用作参考标样,因此有必要摸清烯虫酯的纯化处理条件。鉴于烯虫酯黏性大,饱和蒸气压低,仅通过分相、水洗和减压蒸馏不能去除杂质,需另辟途径方可实现纯化,于是采用了柱层析纯化。
4.1 硅胶板层析实验
为了摸准洗脱条件,用硅胶板做层析实验,使Rf差值在0.2左右,从而分离烯虫酯中杂质。经试验,分别以正己烷与丙酮、乙酸乙酯与丙酮混合液作流动相,烯虫酯原样、杂质Rf情况见图4~图8(图中A为烯虫酯、B、C为杂质)。
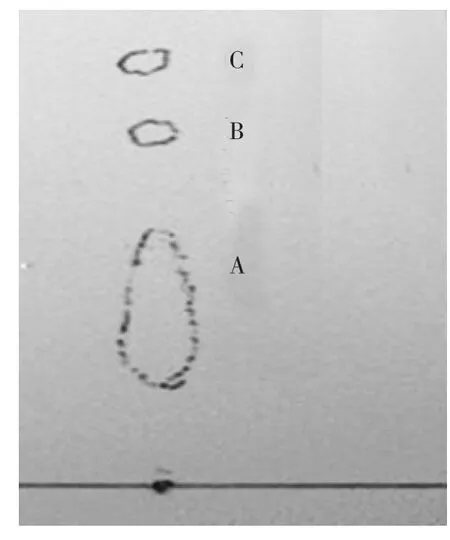
图4 正己烷∶丙酮100∶0.8烯虫酯原样的薄层层析图
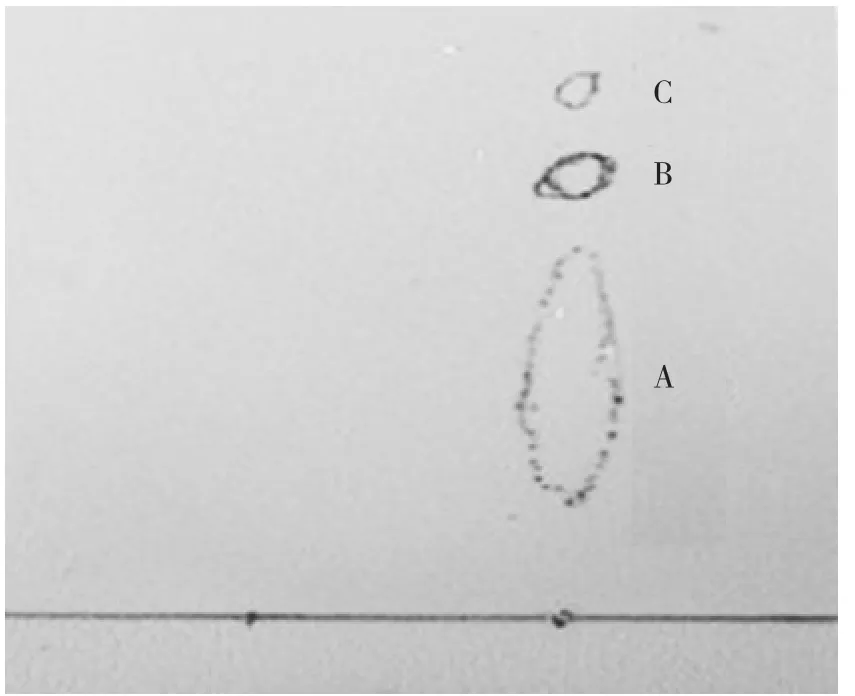
图5 正己烷∶丙酮100∶1烯虫酯原样的薄层层析图
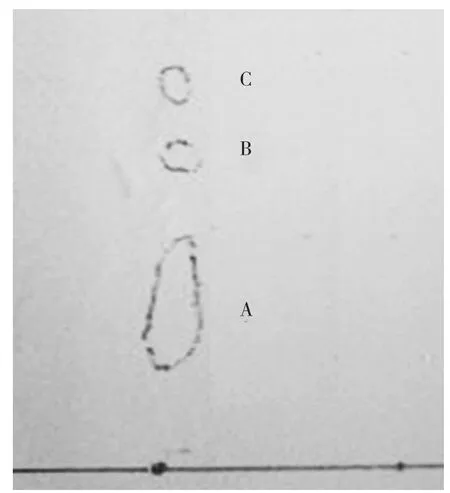
图6 正己烷∶丙酮100∶1.2烯虫酯原样的薄层层析图

图7 乙酸乙酯∶丙酮100∶0.8烯虫酯原样的薄层层析图

图8 乙酸乙酯∶丙酮100∶1烯虫酯原样的薄层层析图
当用乙酸乙酯和丙酮作溶剂时,烯虫酯、杂质A、B都接近溶剂线,不能分离,而极性最大的杂质已离开点样线(见图7、图8)。最后以V正/V丙:100/1~100/2正己烷丙酮混合液作洗脱液。
4.2 柱层析
层析柱:30mm×400mm;层析硅胶:0.038~0.049mm;硅胶装填高度:27~30cm; 上样量:4~6g;流动相:正己烷丙酮混合液;检测:三用紫外分析仪。
4.2.1 定性分析
收集不同洗脱段的烯虫酯溶液,经旋转蒸发仪减压脱除溶剂后,洗脱液前段、中后段的硅胶板层析图见图9。
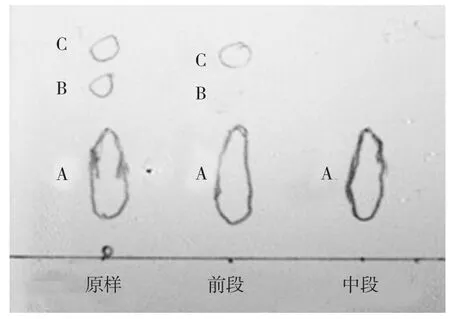
图9 烯虫酯原样、层析前段和中后段的薄层层析情况
结果表明,宜采集洗脱中后段浓缩液,并用液相对洗脱液中段的浓缩液进行定性分析,结果见图3、4及表1。发现经纯化后,个别杂质峰已消失,部分杂质峰明显减少,达到纯化效果。
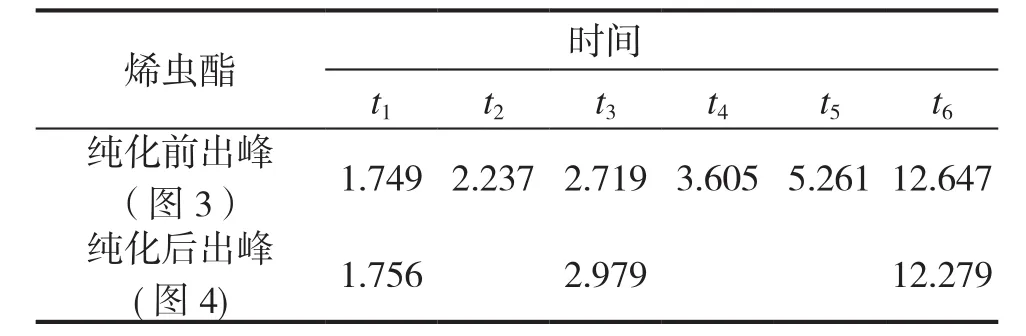
表1 烯虫酯纯化前后杂质峰变化情况
4.2.2 定量分析
浓缩液经旋转蒸发仪减压脱除溶剂后,对收集的中后段烯虫酯用气相色谱作定量分析,结果见表2。说明柱层析可纯化烯虫酯,得到高纯度的烯虫酯,并且发现与烯虫酯原样浓度关系不大。

表2 烯虫酯纯化前后的含量
5 潜在的经济效益
根据目前的分离技术,使用比较先进的高效液相色谱制备机纯化烯虫酯,费用4~5万元·(100g)-1,处理耗费色谱纯溶剂500L·(100g)-1左右,溶剂的后续处理将是一笔不小的费用。使用柱层析分离提纯,柱层析纯化成本1.6万元·(100g)-1。主要溶剂正己烷可部分回收,如提纯的烯虫酯能部分转化为产品,产生的效益参见表3。由表3可见,实验室用柱层析法分离提纯烯虫酯是一种可行、实用、见效快的方法。
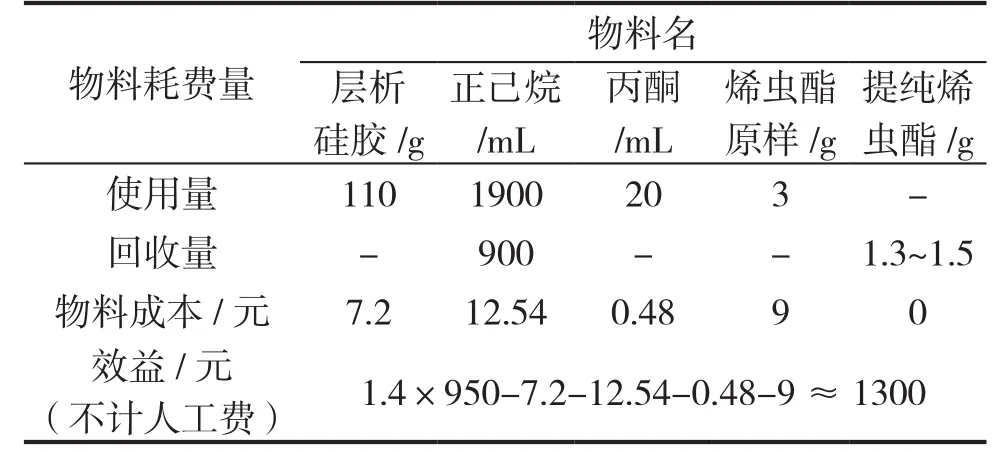
表3 柱层析纯化烯虫酯费用核算
[1] 黎金嘉.农药液体制剂配方设计参考[J].农药市场信息,2007(13):4-6.
[2] 金人宪,杨育华.ZR-型保幼激素类似物合成工艺研究[J].现代农药,2007(1):15-17.
[3] Amanda S.Hill,Joanne V.Mei,Chih-MingYin, Bruce S, et al.Determination of the Insect Growth Regulator Methoprone in Wheat Grain and Milling Fractions Using an Enzyme immunoassay[J]. Agric.Food chem., 1991(39): 1882-1886.
[4] Joanne V. Mei, Chih-Ming Yin, Louis A, Corpino, et al.Hapten Synthesis and Development of immunoassays for Methoprene[J]. Agric. Food chem., 1991(39): 2083-2090.
[5] Robert A. Heckman, Bruce S. Ferguson, Titan S. Fan, et al. Validation of an Enzyme immunoassays for analysis of Metfhoprene Reidues on Tobacco[J]. Agric. Food chem.,1992(40): 2530-2532.

