有氧跑台运动对去卵巢大鼠学习记忆能力、脑自由基代谢及纹状体c-fos表达的影响
庞变华,崔建梅, 庞立杰, 唐 伟
现有资料表明,绝经后妇女认知功能障碍是随着妇女卵巢功能自然衰老而出现的中枢神经系统退行性改变,学习记忆功能下降是最早和最突出的表现[1]。研究发现,绝经前女性AD(老年性痴呆)发病率远远低于同龄男性,而在绝经后由于女性体内雌激素水平的迅速下降增加了其对AD的敏感性,绝经期妇女老年痴呆发病率较同期男性高1.5~3倍[2]。雌激素替代疗法可以改善绝经妇女的记忆功能和降低发生AD病的风险或推迟患病年龄,但同时又可能带来一些副作用。目前研究证实,运动在绝经后AD的防治中起着重要作用,但是具体机制尚不清楚[3]。
大量研究表明,雌激素在维持机体的抗氧化机能中具有重要的作用。妇女绝经后随着卵巢功能的衰退、性激素、促性腺水平紊乱,引起机体脂质过氧化作用增强,自由基清除酶活性下降,导致自由基异常堆积与绝经后女性所致的记忆力减退有关[4];脑纹状体是基底神经核的主要组成部分之一。是皮层下高级中枢之一,其纤维联系和内部结构十分复杂,除运动整合功能外,还发现其具有调整躯体和内脏的传入信息、参与学习记忆神经环路的组成及疼痛反应等多种功能[5];c-fos基因是原癌基因家族成员。它编码的核蛋白fos调节靶基因转录,是细胞内信号传递通路中非特异转录调节因子。发现c-fos基因表达能反映神经细胞的功能状态,与神经元的信号转导及认知功能和记忆有关,而且对长期记忆的保持是必须的[6]。近年来,围绕卵巢切除大鼠脑组织自由基代谢及大脑核团c-fos变化研究较多,但是脑组织自由基代谢与纹状体c-fos的关系未见报道,且长期有氧跑台运动能改善去卵巢大鼠学习记忆的机制尚不清楚。因此,本实验利用雌性去卵巢大鼠模拟绝经后女性,以纹状体(corpus striatum)为研究重点,观察去卵巢大鼠跑台运动8周后大鼠脑自由基代谢(SOD活性、MDA含量)的水平,测试大鼠空间学习记忆能力及大脑纹状体c-fos的变化,旨在探讨长期有氧跑台运动改善去卵巢大鼠学习记忆能力的可能机制。
1 材料及方法
1.1 动物及分组
健康成年SD雌性大鼠30只,体重(230~250)g,均购于山西医科大学动物饲养中心。每笼3只,标准鼠饲料饲养,自由摄食及饮水;室温(23±1)℃,湿度45%~55%。将30只雌性大鼠随机分为假手术安静组(SHAM)、去卵巢安静组(OVX)及去卵巢运动组(OVX+E)。
1.2 手术制作去卵巢模型
雌性大鼠用250g/L乌来糖0.5mL,麻醉,进行双侧卵巢切除术,分层缝合肌肉和皮肤,回笼饲养。术后肌注青霉素(20000u/kg/d),连续3d。
假手术组起始步骤与手术组相同,但不切除卵巢,只切除腹腔内一小块脂肪组织,然后缝合伤口。术后肌注青霉素(20000u/kg/d),连续3d。
所有大鼠在手术后1周进行跑台训练。
1.3 试剂
c-fos测定试剂盒,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)测定试剂盒均由武汉博士德生物工程有限公司生产。
1.4 训练方案
对SHAM及OVX组大鼠不施加任何干扰因素,两组老鼠均可在笼中自由活动。OVX+E组大鼠从第二周开始运动8周,运动负荷参照Bedford跑台训练方法略加改动[6]。OVX+E组大鼠适应性训练3d,正式实验时,每天跑台运动60min。第1周18m/min,第2~8周20m/min,每周5d(周六、周日停训),共8周。
1.5 八臂迷宫实验程序[7]
所有大鼠在第10周周一进行八臂迷宫实验。实验前大鼠先放置在迷宫中适应2d,每天2次。适应时3~4只大鼠同时置于迷宫中央,自由活动和摄取食物(10min),适应后每天进行2次训练。每次训练中,八臂中只有四臂放置了食物(2、4、6、8号臂),整个实验过程均维持此顺序。正式实验时,大鼠置于迷宫中央区。此时中央区四周用鼠门关住,15s后将门打开并开启分析测试软件。测试定时10min,大鼠可选择进入任意一臂,以摄取食物。大鼠进入有食物的臂且摄取了食物为1次正确选择,分析记忆的记录参数为错误选择的次数。重新进入放食物臂或第一次进入放食物臂而不摄取食物为工作记忆错误(working memory error,WME),进入不放食物臂称为参考记忆错误(reference memory error,RME),两者之和为总记忆错误(total memory error,TE)。当大鼠将4臂食物吃完或10min钟后,实验结束,记录所需时间(TT)。
1.6 脑自由基测试
八臂迷宫行为测试后第二天,将每组大鼠取6只断头处死,迅速取出脑组织。将脑组织冲洗3次,滤纸拭干剪碎后,加入生理盐水制成10%的组织匀浆,离心(转速3500r/min,时间10min),取上清液进行SOD、MDA的测定。按试剂盒说明书测定各个指标的含量及活性。
1.7 脑组织取材与切片
八臂迷宫行为测试结束后即刻,每组剩余4只大鼠经常规灌注固定,脑冠状位连续冰冻切片,片厚40μm。切片经Triton X-100(0.5%)磷酸缓冲液孵育40min,加入山羊血清工作液孵育封闭1h,再加入c-fos血清兔抗大鼠多克隆第一抗体(武汉博士德生物有限公司生产);孵育后加入生物素羊抗兔IgG第二抗体,DAB呈色(武汉博士德)。入0.2%明胶溶液裱片,酒精脱水、透明、封片。
2 图像分析和统计学处理
参照大鼠脑立体定位图谱确定大鼠脑组织纹状体区(如图1)的位置,测定纹状体c-fos免疫阳性产物的表达。

图1冠状位下纹状体截面图
每组大鼠各选取20张纹状体c-fos的片子在400倍下进行测量,计数c-fos阳性细胞个数、面积及灰度。
采用SPSS13.0统计软件包进行统计分析。描述性资料采用mean±SD表示,采用单因素方差分析(one-way ANOVA)对组间差异进行统计。方差齐采用LSD方法检验组间差异;方差不齐采用Dunnetts方法检验组间差异。P<0.05为显著性差异;P<0.01为极显著性差异。
2 实验结果
2.1 各组大鼠八臂迷宫实验结果
表1结果显示:与SHAM 组比较,OVX及OVX+E组完成八臂迷宫时间显著延长(P<0.01,P<0.01),增加幅度分别为45%及20%;OVX组WME显著增多(P<0.01),平均增加3.12次;RME显著增多(P<0.01),总错误次数远远高于SHAM组(P<0.01),平均值增加6.23次;而OVX+E组WME比SHAM组显著增多(P<0.05),平均增加1.71次。进入不放食物臂的次数及总错误次数均增多(P<0.05),总错误次数平均增加3.13次;与OVX组比较,OVX+E组WME及TE均显著减少(P<0.05,P<0.01),总错误次数减少3.1次,RME减少,但没有显著差异(P>0.05),完成八臂迷宫时间显著缩短(P<0.05),平均缩短50.92s。实验结果显示,长期跑台运动可以改善去卵巢大鼠的学习记忆能力。
表1 各组大鼠八臂迷宫实验结果比较
注:##:P<0.01,#:P<0.05,与假手术安静组比较;**:P<0.01,*:P<0.05,与去卵巢安静组比较,下同。
2.2 大鼠脑自由基活性测试结果(见表2)

表2 各组大鼠脑自由基代谢测试结果比较
表2结果显示:与SHAM组比较,OVX组及OVX+E组大鼠SOD活性均显著下降(P<0.01,P<0.01),下降幅度分别为38.59%及11.43%;OVX组及OVX+E组大鼠与SHAM组比较MDA含量显著增加(P<0.01,P<0.05),增加幅度分别为32.26%与20.97%;与OVX组大鼠比较,OVX+E组大鼠SOD活性显著增强(P<0.05),下降幅度为44.24%;MDA含量减少,但无显著差异(P>0.05)。提示长期规律的、维持一定时间的跑台运动可以有效增加去卵巢大鼠脑组织的抗氧化能力。
2.3 各组大鼠纹状体c-fos 免疫阳性神经元数量、面积及灰度
100倍显微镜下可见纹状体分布有大量原癌基因c-fos神经元,细胞核着色为棕褐色小圆点;400倍下为椭圆形和圆形的黄褐色神经元。
测量结果(见图2,表3)显示:与SHAM组比较,OVX组大鼠纹状体c-fos阳性细胞数量、面积及灰度值均显著减少(P<0.01),降低幅度分别为42.11%、42.81%及11.9%;与SHAM组比较,OVX+E组大鼠阳性细胞数量、面积均显著下降(P<0.01,P<0.05,P<0.01),灰度值无显著差异(P>0.05);与OVX组比较,OVX+E组大鼠阳性细胞数量、面积及灰度值均显著增高(P<0.01,P<0.05,P<0.05),增高幅度分别为30.55%、23.47%、及11.34%。
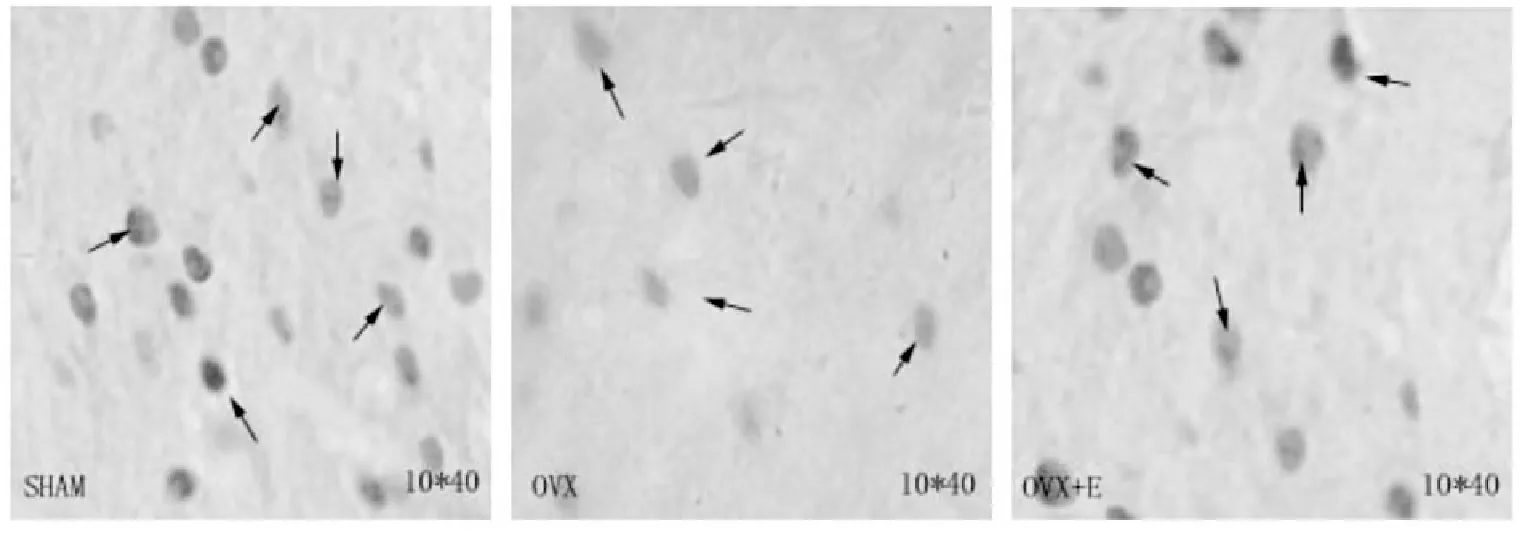

图2 各组大鼠纹状体c-fos 免疫阳性神经元数量、面积及灰度
注:免疫组织化学方法结果显示OVX大鼠纹状体c-fos 免疫阳性神经元(×400)数量、面积均明显减少,灰度减弱;跑台运动8周后大鼠纹状体c-fos 免疫阳性神经元数量、面积显著增多,灰度增强。
3 讨论
3.1 有氧跑台运动对去卵巢大鼠学习记忆能力的影响
认知功能包括注意、再认识、学习、记忆、语言、逻辑推理、解决问题的能力及其他高级智能和精神运动功能等多个方面。认知功能随着年龄的增加有下降趋势。绝经女性由于体内卵巢功能降低,雌激素水平迅速下降[8]。研究发现,雌激素水平的变化与认知功能有密切关系。NAKI等通过观察雌激素替代治疗对非痴呆妇女记忆和其他认知能力的影响,结果显示雌激素替代治疗的妇女词汇学习和记忆显著优于非雌激素替代对照组。说明雌二醇与中老年女性的认知功能呈正相关[9]。
学习记忆是大脑的高级活动之一,是认知活动的重要方面。动物的空间学习记忆能力测试是研究认知功能机制的常用方法之一。目前,从整体水平上研究动物学习记忆能力的实验模型有多种。放射状八臂迷宫(四臂放食物)是一种经典的测定动物空间记忆的方法。动物通过观察周围固定的参照物来学习和记忆自身与饵(置于迷宫臂末端的白色小食丸)的相对位置,获得辨别该空间方位的能力,是一种评估啮齿动物空间学习记忆能力的工具,已被广泛接受和应用[10]。在本研究中,我们观察了卵巢摘除对雌性大鼠学习记忆的影响。结果显示在八臂迷宫实验中,卵巢摘除大鼠的WME、RME及TE均显著增多,完成八臂迷宫时间显著延长,而经过8周跑台运动错误次数均显著减少,完成八臂迷宫时间显著缩短。说明长期有氧跑台运动可以改善去卵巢大鼠脑组织形态和结构上的退行性变化,有利于老年雌性大鼠记忆能力的维持和促进,在一定程度上改善大鼠去卵巢导致的学习记忆能力的下降。研究发现,运动可提高去卵巢大鼠的血清雌二醇水平,因此可以推断长期有氧运动增强记忆能力的可能与血清雌二醇水平的增加有关。Ooishi等研究认为,雌二醇在调整突触可塑性方面起着重要作用[11]。
3.2 跑台运动对去卵巢大鼠脑自由基的影响
学习记忆功能与大脑衰老有着密切联系,而机体内氧自由基是衰老和疾病发生的关键物质[12]。雌激素在维持机体的抗氧化机能中具有较强的抗氧化和保护细胞膜稳定性的作用,能有效延缓机体的衰老。研究表明,妇女绝经后认知功能下降与自由基的关系密切。绝经后妇女随着卵巢功能的衰退,内源性雌激素减少,使得性腺水平紊乱、氧化与抗氧化效应失衡、脂质过氧化作用增强、自由基增加、脑内自由基的清除能力降低等。这些自由基能损伤细胞膜、细胞器诱导神经元退化、变性、凋亡,并导致其功能严重破坏,从而使学习记忆能力下降,进而引起AD[13]。SOD是体内天然的抗氧化物,能清除自由基而具有抗自由基损伤作用。MDA是氧化应激反应中脂质过氧化的产物,其含量的变化可间接反映机体脂质过氧化水平的高低和组织细胞受自由基攻击的严重程度。本实验结果显示,大鼠去卵巢后,脑组织SOD活性明显降低,MDA含量增加,表明去卵巢大鼠机体抗氧化、清除自由基的能力严重受损,导致对氧自由基极为敏感的神经细胞的凋亡、死亡。这可能是去卵巢大鼠学习记忆能力下降的重要原因之一。研究认为,长期有氧训练有利于促进自由基的消除,抑制增龄引起的抗氧化能力降低,调节机体氧化系统的平衡,对机体产生有益影响,是运动延缓脑衰老的主要机制之一[14],本实验也证实了这一观点。去卵巢大鼠经过8周跑台运动,大鼠脑组织中SOD活性显著增强,显示长期跑台运动可能通过增强大脑自由基清除能力,能够缓解神经系统中对氧自由基极为敏感的神经细胞的凋亡和死亡,减少了自由基对神经系统的损害,从一定程度上增强了去卵巢大鼠的学习记忆能力,可以预防去卵巢大鼠出现过早的学习与记忆能力的下降及智力障碍等早衰现象。
3.3 跑台运动对去卵巢大鼠纹状体c-fos 表达的影响
纹状体接受来自于中脑黑质的多巴胺能神经元发出的纤维,并与脑内包括海马、杏仁核、Meynert氏基核和前额叶皮质等多个学习记忆相关的脑区存在着结构和/或功能上的联系。机能也是多方面的,如运动整合、调整躯体和内脏的传入信息、参与疼痛反应的调整[15]。迷宫试验证实纹状体与学习、记忆密切相关[16]。江刚等研究发现损毁双侧纹状体边缘区,对海马的长时程增强有明显影响。提示纹状体边缘区对海马的学习记忆功能有调控作用[17]。c-fos是原癌基因家族中一类可以被第二信使诱导的原癌基因,在体内相当于第三信使的作用,可直接参与细胞的分裂、生长、分化、信息识别与传递、学习记忆等生理过程[18]。而在病理情况下,c-fos 基因表达及调控变化与多种疾病的发生和发展有关[19]。Hartley 等研究发现,应激使去卵巢大鼠视上核c-fos表达减少,而雌甾二醇替代治疗可以增加去卵巢大鼠视上核c-fos表达[20]。
本实验结果发现,去卵巢大鼠纹状体c-fos表达显著减少。说明纹状体c-fos对学习和记忆有明显的调控作用,而且去卵巢大鼠空间学习记忆障碍至少部分是由于损害纹状体神经元减少所致。Tischmeyer等(1990)首先注意到经Y迷宫训练后动物海马中c-fos mRNA 水平增加。随后有研究者用c-Fos、c-Jun反义寡核苷酸阻断二者的表达,发现动物获得能力不受影响,但24 h后的再学习与对照组相比错误的发生明显增加,从而推断c-fos、c-jun是形成长期记忆的前提条件[21]。而去卵巢运动组大鼠跑台运动8周后纹状体c-fos阳性细胞及面积明显增多,并且学习记忆能力显著增强,说明长期跑台运动提高去卵巢大鼠的学习记忆能力可能与纹状体c-fos表达上调有关。
4 结论
去卵巢可以导致雌性大鼠学习记忆能力显著下降,脑组织SOD活性显著减弱,MDA含量增加,纹状体c-fos 表达减弱。长期跑台运动可以改善去卵巢大鼠的学习记忆能力。其机制可能与显著上调脑自由基SOD活性、增强纹状体c-fos阳性神经元表达有关。
[1] MacLennan AH, Henderson VW, Paine BJ, et al. Hormone therapy, timing of initiation, and cognition in women aged older than 60 years: the REMEMBER pilot study[J]. Menopause,2006,13(1):28~36.
[2] Loring-Meier S, Halpern DF. Sex differences in visuospatial working memory: compone- nts of cognitive processing[J]. Psychon Bull Rev,1999,6(3):464~471.
[3] Buchman AS, Boyle PA, Yu L, et al. Total daily physical activity and the risk of AD and cognitive decline in older adults[J]. Neurology,2012,78(17):1323~1329.
[4] Sasaki T, Unno K, Tahara S, et al. Age-related increase of reactive oxygen generation in the brains of mammals and birds: is reactive oxygen a signaling molecule to determine the aging process and life span[J]. Geriatr Gerontol Int,2010(1):10~24.
[5] Mattfeld AT, Stark CE. Functional contributions and interactions between the human hippocampus and subregions of the striatum during arbitrary associative learning and memory[J]. Hippocampus. 2015 Aug;25(8):900~911.
[6] Tsai YW, Yang YR, Wang PS, et al. Intermittent hypoxia after transient focal ischemia induces hippocampal neurogenesis and c-Fos expression and reverses spatial memory deficits in rats[J]. PLoS One,2011,6(8):e24001.
[7] Bedford TG, Tipton CM, Wilson NC, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol,1979,47(6):1278~1283.
[8] Buckler H. The menopause transition:endocrine changes and clinical symptoms[J]. J Br Menopause Soc,2005,11(2):61~65.
[9] NAki PM, Zonderman AB, Reanick SM. Enhanced verbal memory in nondemented elderly women receiving hormone-replacement therapy[J]. Psychinu,2001,158(2):227~233.
[10] Pietrelli A, López-Costa JJ, Goni R,et al. Effects of moderate and chronic exercise on the nitrergic system and behavioral parameters in rats[J]. Brain Res, 2011(1389):71~82.
[11] Ooishi Y, Kawato S, Hojo Y, et a1.Modulation of synaptic plasticity in the hippocampus by hippocampus-derived estrogen and androgen[J]. J Steroid Biochem Mol Biol,2012,131(1—2):37~51.
[12] Kumar H, Lim HW, More SV,et al.The role of free radicals in the aging brain and Parkinson's disease: convergence and parallelism[J]. Int J Mol Sci,2012,13(8):10478~10504.
[13] Sánchez-Rodríguez MA, Zacarías-Flores M, Arronte-Rosales A. Menopause as risk factor for oxidative stress[J]. Menopause,2012,19(3):361~367.
[14] Radak Z, Kumagai S, Taylor AW, et al. Effects of exercise on brain function: role of free radicals[J]. Appl Physiol Nutr Metab,2007,32(5):942~946.
[15] Barceló AC, Filippini B, Pazo JH. The striatum and pain modulation[J]. Cell Mol Neurobiol,2012,32(1):1~12.
[16] Packard MG, Knowlton BJ. Learning and memory functions of the Basal Ganlia [J]. Annn Rev Neurosci,2002(25):563~593.
[17] 江刚,舒斯云,包新民,等.大鼠纹状体边缘区与海马学习记忆功能的行为学比较研究[J]. 中国行为医学科学, 2003,12(6):601~603.
[18] Bin Lu, Zhao Ma, Fei Cheng, et al. Effects of electroacupuncture on ethanol-induced impairments of spatial learning and memory and Fos expression in the hippocampus in rats[J]. Neuroscience Letters, 2014:62~67.
[19] Volodymyr Borysovych Bogdanov, Olena Viktorivna Bogdanova, Arnaud Lombard, et al. Cortical spreading depression decreases Fos expression in rat periaqueductal gray matter[J]. Neuroscience Letters, 2015, 585(12):138~143.
[20] Hartley DE, Dickson SL, Forsling ML. Plasma vasopressin concentrations and Fos protein expression in the supraoptic nucleus following osmotic stimulation or hypovolaemia in the ovariectomized rat: effect of oestradiol replacement[J]. J Neuroendocrinol, 2004,16(3):191~197.
[21] Grimm R, Sch icknick H, Riede I, et al. Suppression of c -fos indeuction in rat brain im pairs retention b rightness discrimination reaction[J] . Learn Mem,1997,3(5):402~413.

