15-LOX/15-HETE对Kv通道的抑制在缺氧诱导的脑动脉收缩中的作用
朱雨岚,王迪,刘文娟
由缺氧诱导的缺血性脑动脉收缩是缺血性脑血管疾病的重要发病机制,最终导致脑缺血后细胞死亡[1-2]。到目前为止,缺血、缺氧引起脑动脉收缩的确切机制仍未阐明,有报道指出,缺氧对电压依从性钾通道(voltagegated potassium channels,Kv)的抑制作用与缺氧诱导的脑动脉收缩密切相关[3-4],主要是通过抑制脑动脉全细胞钾电流使细胞膜去极化、细胞内钙增加,最终引起脑动脉收缩。目前已知脑动脉平滑肌细胞上存在4种不同类型的钾通道,其中Kv1.5和Kv2.1在缺氧性脑动脉收缩中发挥重要作用[5-6]。15-羟二十碳四烯酸(15-hydroxyeicosatetraenoic acid,15-HETE)是花生四烯酸(arachidonic acid,AA)经15-脂加氧酶(15-lipoxygenase,15-LOX)代谢生成的主要产物之一,能在包括脑动脉在内的一系列血管床中产生强烈的血管收缩作用[7-8]。另外,缺氧可以诱导脑动脉15-LOX表达增加,同时增加脑动脉对15-HETE的敏感性[9]。
本课题组前期的研究显示15-HETE可以通过抑制脑动脉平滑肌细胞(carotid artery smooth muscle cell,CASMC)Kv通道的表达从而引起脑动脉收缩[10],而15-LOX作为催化15-HETE生成的关键酶,它在缺血缺氧性脑损伤中的作用如何,是否参与了15-HETE对Kv通道的调控?为了解决这个问题,本研究利用RNA干扰技术上调和下调15-LOX的表达;采用酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)法测定15-HETE生成量的变化;再分别采用反转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)和Western-blot技术测定Kv2.1基因和蛋白质表达的变化,对此展开探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康Wistar大鼠,体重200~250 g,由哈尔滨医科大学附属第二医院动物实验中心提供。
1.1.2 主要试剂 15-HETE和15(S)-HETE EIA试剂盒购自美国Cayman公司,15-LOX抗体和Kv2.1通道兔多克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶标记羊抗兔IgG抗体购自美国ZSGB-BIO公司,反转录试剂盒、聚合酶链反应(transcription-polymerase chain reaction,PCR)试剂盒及100 bp脱氧核糖核酸(deoxyribonucleic acid,DNA)Ladder均购自美国Fermentas公司,Trizol、Opti-MEM培养基和脂质体(Lipofectamine)TM 2000购自美国Invitrogen公司,FuGENTM6购自美国Promega公司,其他试剂均为国产分析纯。
1.1.3 仪器 低温高速离心机(Heraeus公司),台式高速冷冻离心机(Weofuge公司),PCR仪(Px220602,Thermo电子公司),电泳凝胶成像分析仪(GDS-7500,BIO-RAD公司),体视立体显微镜(SMZ-168,Motic公司)。
1.2 方法
1.2.1 大鼠CASMC分离与培养 Wistar大鼠,腹腔注射3 ml/kg水合氯醛(10%)麻醉,断头取脑,置于4℃的磷酸盐缓冲液(phosphate buffer solution,PBS)中,在立体显微镜下小心剥离出脑动脉,剪成1~2 mm长的小段,将血管段置于4 mg/ml木瓜蛋白酶(papain)液[含1 mg/ml牛血清蛋白(bovine serum albumin,BSA)]中37℃进行振荡消化18 min;换入1 mg/ml胶原酶Ⅱ液(含1 mg/ml BSA)中,37℃继续消化20 min;再换入含20%小牛血清和1%青霉素/链霉素的细胞培养基(Dulbecco's modified eagle medium,DMEM)溶液中,用吸管吹打得到细胞悬液;低速离心10 min,弃上清,用含20%胎牛血清和1%青霉素/链霉素的DMEM溶液制成细胞悬液,转入6孔板中,置于37℃,含5%CO2的培养箱内培养。采用免疫组化法鉴定平滑肌细胞。原代培养的CASMC长满后,用0.25%的胰蛋白酶消化传代,培养至第3代。
1.2.2 分组设计 实验前向培养的细胞中加入含有0.3%胎牛血清的DMEM培养12 h以终止细胞生长,将细胞随机分为4组。A组为正常细胞常氧组(对照组):将细胞放入37℃,5%CO2及95%O2的常规培养箱中培养48 h;B组为正常细胞缺氧组:将细胞放入3%O2,5%CO2和92%N2的缺氧箱中培养48 h;C组为15-LOX基因过表达细胞常氧组:对细胞上的15-LOX进行基因过表达,然后放入常氧箱中培养48 h;D组为15-LOX基因敲除细胞缺氧组:对细胞上的15-LOX进行基因敲除,然后放入缺氧箱中培养48 h。
1.2.3 15-LOX基因过表达及CASMC 基因敲除15-LOX基因过表达按照FuGENTM6转染试剂盒说明进行操作。以1×105个/孔的浓度接种于6孔板,细胞贴壁生长融合至50%~80%后更换为无血清Opti-MEM(Invitrogen,Carlsbad,CA)优化培养基,用100 ☒l Opti-MEM稀释3 ☒l转染试剂FuGENTM6并轻轻混合,取1 ☒g pcDNA3.1/NotI:15-LOX-XbaI质粒(Invitrogen,Carlsbad,CA)于已稀释的FuGENTM6,轻轻混合后室温孵育20 min,将上述的混合物或单独载体均匀滴入6孔板。6 h后,细胞更换为全培养基。
CASMC基因敲除按照LipofectamineTM2000转染试剂盒说明进行操作。用250 ☒l Opti-MEM稀释5 ☒l转染试剂LipofectamineTM2000至1.5 ml的EP管中,轻轻混合并室温孵育5 min。与此同时,在另一个1.5 ml的EP管中用250 ☒l Opti-MEM稀释小分子干扰RNA(small interfering RNA,siRNA),轻轻混合室温孵育5 min。孵育完成之后,将稀释的LipofectamineTM2000和稀释siRNA混合,室温孵育20 min,形成siRNALipo2000混合物。将siRNA-Lipo2000混合物均匀地滴入6孔板,6 h后细胞更换为完全培养基,培养48 h后进行后续实验。
对细胞进行裂解,用Western-blot和RTPCR的方法鉴定15-LOX过表达和敲除是否成功。
1.2.4 ELISA法测定CASMC的15-HETE生成量 分别设空白孔、标准品孔、待测样品孔。在酶标包被板上标准品孔中加入标准品50 μl;在酶标包被板上待测样品孔中先加15-HETE稀释液40 μl,然后再加待测15-HETE10 μl(样品最终稀释度为5倍)。待测样品孔每孔加入酶标试剂50 μl,轻轻晃动混匀,37℃温育60 min。弃去液体,甩干,每孔加满稀释后洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。如此重复5次,拍干。待测样品孔每孔先加入显色剂A50 μl,再加入显色剂B50 μl,轻轻震荡混匀,37℃避光显色15 min。取出酶标板,每孔加终止液50 μl,终止反应(此时蓝色立转黄色)。15-HETE测定:以空白孔调零,在450 nm波长下测量各孔的吸光度值(value of optical density,OD值),根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出15-HETE浓度。
1.2.5 RT-PCR测定CASMC的Kv2.1 mRNA表达 将各组CASMC用冷的PBS冲洗3遍,采用Trizol法提取RNA。取各组总RNA3 μg,参照反转录试剂盒说明书合成cDNA。PCR引物序列及反应条件为:
引物序列:①Kv2.1(X16476):上游引物:5’-CACCATCGCTCTGTCACTCA-3’;下游引物:5’-GCAGGCCCAGTTCGTTGTA-3’,
扩增出395 bp片段。②β-actin(BC063166):上游引物:5’-CCGTAAAGACCTCTATGCCAACA-3’;下游引物:5’-CGGACTCATCGTACTCCTGCT-3’,扩增出230 bp片段。
PCR反应条件:预变性94℃ 2 min,94℃45 s、49℃ 45 s、72℃ 45 s,循环32次,72℃总延伸5 min。用凝胶成像分析系统测定Kv2.1与内标β-actin的条带密度值,取两者条带密度值比值进行半定量分析。
1.2.6 Western-blot测定CASMC的Kv2.1蛋白质表达 将各组CASMC用冷的PBS冲洗3遍,每孔中加入200 μl裂解液[1%诺乃洗涤剂(Nonidet)P-40,0.5%脱氧胆酸钠(sodium deoxycholate),0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),100 μg/ml苯甲磺酰氟(phenyl methyl sulfonyl fluoride),30 μl/ml抑肽酶(aprotinin)],冰上裂解30 min。4℃,12 000 r/min离心10 min,取上清。Bradford法进行蛋白定量。8%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳分离蛋白,电转移至硝酸纤维素膜上。5%脱脂奶粉室温封闭1 h,加入兔多克隆Kv2.1抗体(1∶500稀释)4℃过夜(以β-actin作为内参),洗膜后加入辣根过氧化物酶标记的二抗(1∶5000稀释)室温孵育1 h。化学发光法发光,X线胶片显影,Bio-Rad图像处理系统对X线胶片进行扫描,Quantity one软件测定条带密度,进行半定量分析。
1.3 统计学分析 采用SPSS 13.0软件进行统计学分析,计量资料如符合正态分布采用(s)表示,组间比较采用方差分析,3个实验组与对照组间比较采用Dunnett-t检验进行两两比较。计数资料用频数或百分位数表示,组间比较用卡方检验,P<0.05为差异有显著性。
2 结果
2.1 15-LOX对CASMC的15-HETE生成量的影响 实验重复8次(n=8),与正常细胞常氧组比较,缺氧组及15-LOX基因过表达细胞常氧组15-HETE生成量均增加(P<0.01);而与正常细胞缺氧组比较,15-LOX基因敲除细胞缺氧组15-HETE生成量则减少,差异有显著性(P<0.01)(图1)。
2.2 15-LOX对CASMC Kv2.1通道mRNA表达的影响 实验重复8次(n=8),与正常细胞常氧组比较,缺氧组及15-LOX基因过表达细胞常氧组的Kv2.1 mRNA表达均下调(P<0.01);而与正常细胞缺氧组比较,15-LOX基因敲除细胞缺氧组的Kv2.1 mRNA表达则上调,差异有显著性(P<0.05)(图2)。
2.3 15-LOX对CASMC Kv2.1通道蛋白质表达的影响 实验重复8次(n=8),与正常细胞常氧组比较,缺氧组及15-LOX基因过表达细胞常氧组的Kv2.1蛋白质表达均下调(P<0.01);而与正常细胞缺氧组比较,15-LOX基因敲除细胞缺氧组的Kv2.1蛋白质表达则上调,差异有显著性(P<0.05)(图3)。
3 讨论
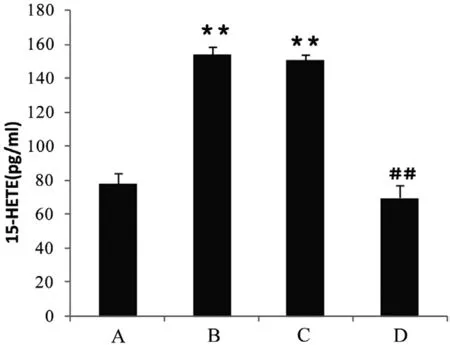
图1 15-LOX对CASMC 15-HETE生成量的影响注:与A组比较:**P<0.01;与B组比较:##P<0.01;A:正常细胞常氧组(对照组);B:正常细胞缺氧组;C:15-LOX基因过表达细胞常氧组;D:15-LOX基因敲除细胞缺氧组。15-LOX:15-脂加氧酶;CASMC:脑动脉平滑肌细胞;Kv:电压依从性钾通道;15-HETE:15-羟二十碳四烯酸
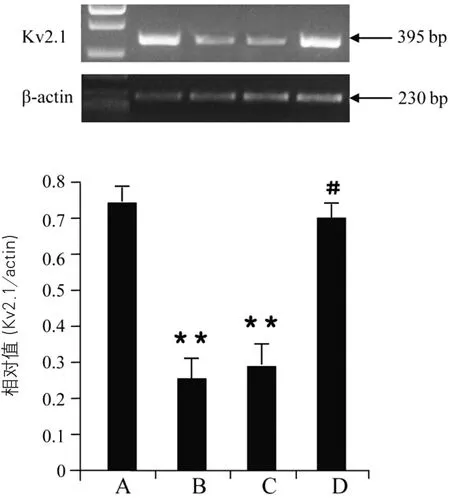
图2 15-LOX对CASMC Kv2.1通道mRNA表达的影响注:与A组比较:**P<0.01;与B组比较:#P<0.05;A:正常细胞常氧组(对照组);B:正常细胞缺氧组;C:15-LOX基因过表达细胞常氧组;D:15-LOX基因敲除细胞缺氧组。15-LOX:15-脂加氧酶;CASMC:脑动脉平滑肌细胞;mRNA:信使RNA
AA是人体内最丰富、最活跃的一种多不饱和脂肪酸,15-HETE是AA经15-LOX代谢生成的主要产物之一,在正常的鼠脑中仅有少量的15-HETE,而在缺氧时其含量则明显增加[11],这提示了15-HETE很可能参与了缺氧引起的一系列病理生理过程。在本课题组的前期研究中已经证实:在缺氧状态下,脑动脉平滑肌上的15-LOX表达增加,进而使15-HETE的生成量增加,并且15-HETE的生成可以被15-LOX抑制剂所抑制[11];同时还发现15-HETE可以浓度依赖的方式引起离体颈内动脉环收缩[12]。
有研究表明,颈动脉体Ⅰ型细胞的Kv通道在缺氧状态下受到抑制[13],提示Kv通道的抑制在缺氧诱导的脑动脉收缩中起重要作用。Han等[14]在肺动脉中的研究发现15-HETE通过阻滞肺动脉平滑肌细胞的Kv通道引起肺动脉平滑肌收缩。而本课题组的研究亦发现15-HETE可通过下调Kv通道(Kv1.5和Kv2.1)蛋白和mRNA的表达进而引起脑动脉平滑肌收缩[15-16]。因此,本研究假设在缺氧状态下,15-LOX表达增加,15-HETE的生成量亦随之增加,进而对Kv通道的抑制作用增强,最终导致脑动脉收缩。为了证实这一假设,本课题组选取了15-LOX作为关键点,对其进行干扰,然后观察15-HETE生成量的变化及Kv通道的表达情况。
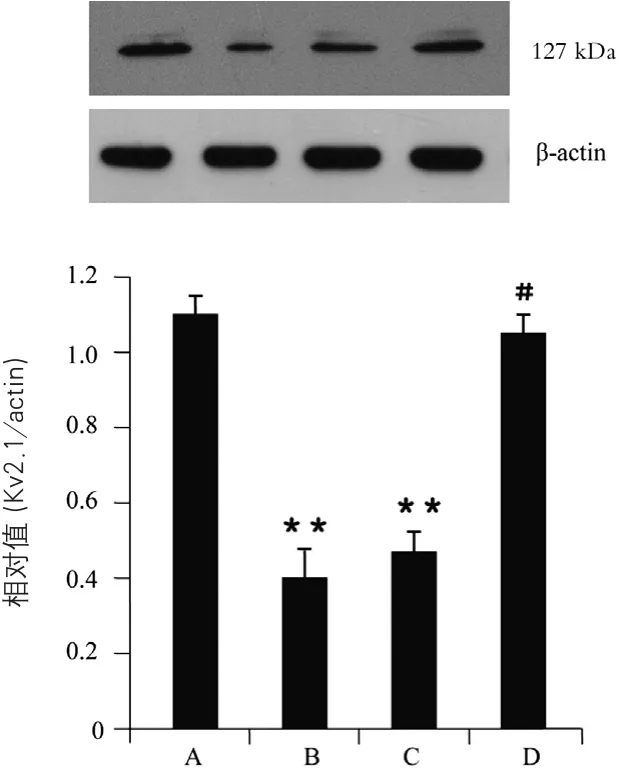
图3 15-LOX对CASMC Kv2.1通道蛋白质表达的影响注:与A组比较:**P<0.01;与B组比较:#P<0.05;A:正常细胞常氧组(对照组);B:正常细胞缺氧组;C:15-LOX基因过表达细胞常氧组;D:15-LOX基因敲除细胞缺氧组。15-LOX:15-脂加氧酶;CASMC:脑动脉平滑肌细胞
本研究将CASMC分为4组,分别于常氧环境和缺氧环境下培养。与常氧环境相比,Kv2.1通道的表达可被缺氧和15-LOX的过表达所抑制,而当15-LOX基因被敲除时,缺氧条件则不会抑制Kv2.1通道的表达。
脑动脉上至少存在4种不同类型的钾通道,在本课题前期研究中,采用大鼠离体颈内动脉环的方法已经证实:缺氧主要通过抑制Kv通道引起颈内动脉收缩[12]。在缺氧条件下15-LOX的表达增加可能促进了AA代谢生成15-HETE,而15-HETE在脑缺氧过程中有可能通过下调Kv通道增强脑动脉收缩,从而加重动脉狭窄。本研究证实了AA经15-LOX代谢生成的产物15-HETE对Kv通道确实有抑制作用。
总之,本研究表明可通过降低15-HETE水平和防止Kv通道的下调为改善缺血性血管闭塞提供治疗策略。同时,也提示15-LOX有望成为脑缺氧治疗的新靶点。然而,缺氧时,15-HETE究竟是如何抑制Kv通道,最终引起脑动脉收缩的,这一机制尚未明确,这将是以后我们重点研究的内容。
1 Badimon L, Vilahur G. Platelets arterial thrombosis and cerebral ischemia[J]. Cerebrovasc Dis, 2007,24:30-39.
2 Graham SH, Chen J. Programmed cell death in cerebral ischemia[J]. J Cereb Blood Flow Metab, 2001,21:99-109.
3 Bunn HF, Poyton RO. Oxygen sensing and molecular adaptation to hypoxia[J]. Physiol Rev, 1996, 76:839-885.
4 Coppock EA, Tamkun MM. Differential expression of K(v) channel alpha-and beta-subunits in the bovine pulmonary arterial circulation[J]. Am J Physiol Lung Cell Mol Physiol, 2001, 281:L1350-L1360.
5 Chung YH, Kim HS, Shin CM, et al.Immunohistochemical study on the distribution of voltage-gated K(+) channels in rat brain following transient focal ischemia[J]. Neurosci Lett, 2001,308:157-160.
6 Standen NB, Quayle JM. K+channel modulation in arterial smooth muscle[J]. Acta Physiol Scand, 1998,164:549-557.
7 Gannushkina IV. Cerebral circulation in different types of brain hypoxia[J]. Vestn Ross Akad Med Nauk, 2000, 9:22-27.
8 Amberg GC, Santana LF. Kv2 channels oppose myogenic constriction of rat cerebral arteries[J]. Am J Physiol Cell Physiol, 2006, 291:C348-C356.
9 Schulz R, Krueger C, Manickavel V, et al. Production of 15-HETE by cultured smooth muscle cells from cerebral artery[J]. Pharmacology, 1993, 46:211-223.
10 Hariri RJ, Ghajar JB, Pomerantz KB, et al. Human glial cell production of lipoxygenase-generated eicosanoids:A potential role in the pathophysiology of vascular changes following traumatic brain injury[J]. J Trauma, 1989, 29:1203-1210.
11 朱雨岚, 苏芳, 陈鹤, 等. 缺氧大鼠脑组织中的15-脂加氧酶表达与定位研究[J]. 中国临床康复, 2005, 9:90-93.
12 朱雨岚, 单宏丽, 李倩, 等. 15-羟廿碳四烯酸对缺氧性大鼠颈内动脉环的收缩作用及机制[J]. 中国药理学通报, 2005, 21:1327-1332.
13 Kawata H, Hirano K, Nishimura J, et al. The mechanism underlying the contractile effect of a chemotactic peptide, formyl-met-leu-phe on the guinea-pig Taenia coli[J]. Br J Pharmacol, 2005,145:353-363.
14 韩维娜, 李湘晖, 姜著英, 等. 15-HETE对兔肺动脉平滑肌钾离子通道的影响[J]. 生理学报, 2004, 56:717-722.
15 朱雨岚, 陈莉, 朱延梅, 等. 缺氧抑制脑动脉Kv2.1通道作用机制的研究[J]. 中风与神经疾病杂志, 2010,27:4-7.
16 Zhu Y, Chen L, Liu W, et al. Hypoxia-induced 15-HETE enhances the constriction of internal carotid arteries by down-regulating potassium channels[J]. J Neurol Sci, 2010, 295:92-96.
【点睛】
在缺氧诱导的脑动脉收缩中,脑动脉平滑肌细胞上的15-LOX表达增加,15-HETE生成量增加,对Kv通道的抑制作用增强。

