浙江饮用水源地浮游动物群落特征及环境响应
徐杭英,于海燕, 韩明春 ,黄平沙,李共国,*
1 浙江省环境监测中心,杭州 310007 2 浙江万里学院生物与环境学院,宁波 315100
浙江饮用水源地浮游动物群落特征及环境响应
徐杭英1,于海燕1, 韩明春1,黄平沙2,李共国2,*
1 浙江省环境监测中心,杭州 310007 2 浙江万里学院生物与环境学院,宁波 315100
2010年1月至2011年10月,对浙江省16个饮用水源地(H1—H8为河网型,K1—K8为水库型)的浮游动物群落进行季节调查。共记录浮游动物优势种(属)21种(轮虫8种、枝角类5种、剑水蚤5种和哲水蚤3种),各类群第一优势种分别为针簇多肢轮虫(Polyarthratrigla)、长额象鼻溞(Bosminalongirostris)、粗壮温剑水蚤(Thermocyclopsdybowskii)和汤匙华哲水蚤(Sinocalanusdorrii)。2年间,河网和水库浮游动物平均密度分别为345.2 L-1和199.4 L-1,生物量分别为0.667 mg/L和0.421 mg/L。各类群密度百分比例均以轮虫和桡足类无节幼体为主,甲壳动物以剑水蚤为主。经逐步回归分析表明,浮游动物群落密度(生物量)与河网水质因子(P<0.01)之间相关性比水库(P<0.05)更密切,总磷和氨氮分别入选了河网和水库所有有效的回归方程中。通径分析和决策系统分析表明,河网的总磷和叶绿素a含量对浮游动物群落变动具有正效应,溶解氧具有负效应;总磷含量是影响河网群落变动的最重要因子,叶绿素a含量则是影响群落增长最主要的限制因子。河网剑水蚤、无节幼体和轮虫群落的密度(生物量)与水体综合营养指数TLIc密度(TLIc生物量)之间有显著的线性回归关系(P<0.001),无节幼体密度构成了TLIc密度变动的限制因子,轮虫生物量成为TLIc生物量变动的限制因子,而剑水蚤是一类最重要、稳定的水质指示群落,这对于筛选浮游动物群落的一些拓展性监测指标具有重要的参考作用。
饮用水源地;浮游动物;逐步回归分析;通径分析;TLIc
饮用水水库占浙江省51%城乡饮用水源地,供水人口达62%,但库区污染源和人类活动已对水库水源地水质安全构成威胁[1]。溪、江、河流型饮用水源地,水质更易受到富营养化和突发污染事件的影响[2- 3]。近年来的一些研究表明,利用浮游动物类群的协调性[4]、群落的扩展性参数[5- 6]等方法均可作为水质监测的指示器,Jeppesen等[7]还建议欧盟将浮游动物作为一个敏感的生态质量元素包涵在水环境框架指令(Water Framework Directive)中参与评估。但至今尚无一个强有力的浮游动物群落监测指标能与水体营养度相匹配,在营养水平较低的饮用水源地的相关研究则更少,其水质评价主要还是以化学监测为主,生物学评价工作仅限于底栖动物和菌落总数[8- 9]。因此,本文以地处亚热带的浙江省两类饮用水源地——河网型与水库型为研究对象,比较和分析了浮游动物群落特征及其对环境变化的响应,以期为浮游动物群落结构监测水质奠定基础。
1 材料与方法
1.1 站位布设与采样方法
根据浙江省饮用水源地主要由大江、大溪、河流和水库等组成特点,将由大江、大溪、河流等流速较大的水源地归为河网型,选取其中8个水源地作为河网型采样站(H1—H8);水流速较缓的水库(型)水源地也选取8个采样站(K1—K8),共16个浮游动物采样站(图1)。

图1 浙江饮用水源地浮游动物采样点分布Fig.1 Distribution of zooplankton sampling stations in the drinking water sources, Zhejiang
于2010年1月至2011年10月逐季(1月、4月、7月和10月中旬)采样,由全省各地方监测站定点、定时(9∶00—11∶00时)分别采样与送样,采样和计数按《淡水浮游生物研究方法》[10]进行,定量样品用2.5 L采水器分别于该样站取水口的上、下水层,各采10 L水样,用25号筛绢制成的浮游生物网(网孔孔径64 μm)过滤浓缩,当即用福尔马林(约40%甲醛溶液)固定,终浓度为5%,带回实验室镜检。同时测定水体pH值、溶解氧DO、总氮TN、总磷TP、氨氮NH4-N和叶绿素Chl.a等理化参数。
1.2 标本鉴定与计算方法
轮虫、枝角类和桡足类分别按王家楫[11]、蒋燮治和堵南山[12]、沈嘉瑞[13]鉴定,生物量计算主要参照章宗涉和黄祥飞[10]、陈雪梅[14]。桡足幼体和成体数量按该种桡足类成体出现频率乘以样本总数计算。各类浮游动物的优势种分别按每个种在各自类群中的优势度值(Y)来确定,公式为:Y= (ni/N) ×fi,ni为第i种的个体数,N为该类群的总密度,fi为该种出现的频度。Y≥0.02时为优势种[15]。水体综合营养状态指数(TLIc)参考王明翠等[16]计算。
1.3 统计分析
浮游动物群落与水环境因子之间的逐步回归分析,分别以浮游动物Zoop(Zooplankton)、轮虫Roti(Rotifera)、枝角类Clad(Cladocera)、剑水蚤Cycl(Cyclopoida)、哲水蚤Cala(Calanoida)和无节幼体Naup(Nauplius)的密度(生物量)为因变量,以水质DO、pH、TN、TP、NH4-N和Chl.a含量为自变量,进行逐步回归分析。水体TLIc与群落之间的逐步回归分析,则以TLIc密度(TLIc生物量)为因变量,以各类群浮游动物密度(生物量)为自变量,进行逐步回归分析[17]。计算自变量对因变量影响相对重要性的统计数-通径系数,将相关系数分解为直接作用系数和间接作用系数,通过对通径系数绝对值的比较就可确定对因变量有显著影响的自变量的主次顺序[18]。并通过计算决策系数,把各自变量对响应变量的综合作用进行排序,以确定主要决策变量和限制变量[19],以上计算分析均应用DPS(Data Processing System)数据处理系统完成。
2 结果
2.1 饮用水源地理化参数
16个饮用水源地中,以河网型的H7、H8站的TN、TP和NH4-N含量最高,均极显著地高于其他各站(P<0.01),其中,尤其以河网水(除H4站)的TP含量极显著地高于水库水(P<0.01);而H7、H8站的DO含量最低(P<0.01)。pH值以H5、H6站为最高,Chl.a含量以K4站极显著地高于H1—H4站、K1站(表1)。另外,TN∶TP比值以K6、K7站极显著地高于H1、H5—H8站(P<0.01)。

表1 2010—2012年水质参数(平均值±标准差)Table 1 Water quality parameters in the sampling stations in the drinking water sources during 2010—2012 (mean ± SD)
2.2 群落优势种和富营养化指示种
2010—2011年间有21种(属)浮游动物(轮虫8、枝角类5、剑水蚤5和哲水蚤3)达到优势种程度(表2),各类群的第一优势种分别为针簇多肢轮虫(Polyarthratrigla)、长额象鼻溞(Bosminalongirostris)、粗壮温剑水蚤(Thermocyclopsdybowskii)和汤匙华哲水蚤(Sinocalanusdorrii)。2011年河网型水体轮虫、剑水蚤的优势种均比2010年增加了1种,而枝角类和哲水蚤的优势种分别减少了3种和1种;2011年水库轮虫的优势种比2010年增加了2种,而枝角类、剑水蚤和哲水蚤的优势种均减少了1种。
2010年河网水体中,咸淡水种中华哲水蚤(Calanussinicus)仅出现在10月份的H5—H6站,最高密度达102.0 个/L,该两水厂取水口还有较多的中华窄腹剑水蚤(Limnoithonasinensis)。种群平均密度(优势度)较高的还有晶囊轮虫(Asplanchnasp.)13.9 个/L(0.017),主要是H8站7月种群密度达392.0 个/L所致;矩形龟甲轮虫(Keratellaquadrata)10.4 个/L(0.017)和中华窄腹剑水蚤2.5 个/L(0.016)等。2011年水库中的中华窄腹剑水蚤仅分布在1月份的K5、K6站,汤匙华哲水蚤则在K5站的种群密度达88.0 个/L。
由表2可见,河网和水库中具有富营养化指示作用的优势种分别为8种和6种。此外,富营养化指示种还有其它臂尾轮虫(Brachionusspp.)、轮虫属(Rotaria)、矩形龟甲轮虫、沟痕泡轮虫(Pompholyxsulcata)、暗小异尾轮虫(Trichocercapusilla)、简弧象鼻溞(Bosminacoregoni)和圆形盘肠溞(Chydorussphaericus)等。河网型水源地中,水体TLIc值随着群落富营养化指示种出现频次的增加而上升,两者之间呈极显著的正相关性(P<0.01),而水库型水源地中此两者无明显相关性(图2)。

表2 饮用水源地浮游动物优势种的种群密度/L-1及其优势度(Y)Table 2 Zooplankton dominant species, population density and dominance(Y)in the drinking water sources

图2 河网型、水库型水源地富营养状态指示种出现频次与TLIc之间的相关性Fig.2 Relationships between TLIc and the occurrence frequency of indicator species of trophic state in the rivers and reservoirs
2.3 浮游动物群落特征
2年间,河网和水库浮游动物平均密度分别为345.2 个/L和199.4 个/L(表3),其中以体形较小的轮虫和桡足类无节幼体为主,甲壳动物中则以剑水蚤为主,枝角类次之,哲水蚤最少。各类浮游动物密度在两类水体中的分布,剑水蚤在河网所占的百分比例较高,哲水蚤比例则在水库较高,其他类密度的百分比例相差较小。河网浮游动物密度变幅为17.2 个/L(H4站)—1619.1 个/L(H8站);水库变幅51.3 个/L(K1站)—663.2 个/L(K8站)。
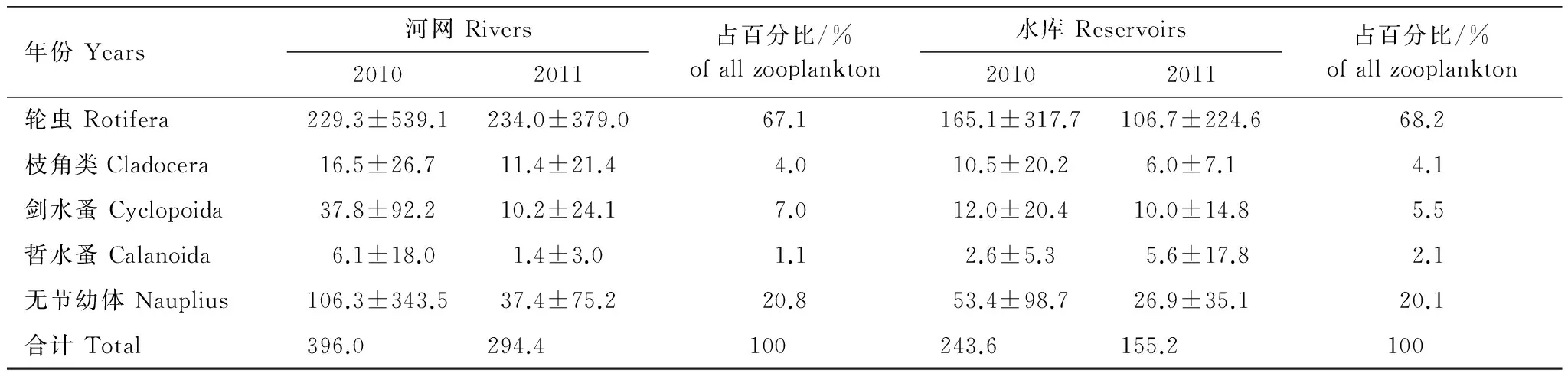
表3 2010—2011年河网和水库各类浮游动物平均密度/L-1(±标准差)Table 3 Each group density of zooplankton in the rivers and reservoirs during 2010—2012 (mean ± SD)
河网和水库浮游动物平均生物量分别为0.667 mg/L和0.421 mg/L(表4)。2010年7月的H7、H8站温剑水蚤大量繁殖,生物量分别达到2.660 mg/L和2.126 mg/L,2011年1月的K1、K2站汤匙华哲水蚤生物量分别达2.929 mg/L和1.396 mg/L。因此,除2010年河网的剑水蚤和2011年水库的哲水蚤生物量最高外,其余均以轮虫为主。河网剑水蚤生物量所占的百分比例是水库的2倍,而水库的哲水蚤生物量所占的百分比例是河网的2倍。河网浮游动物年平均生物量变幅为0.028 mg/L(2011年H4站)—2.456 mg/L(2010年H8站);水库变幅为0.025 mg/L(2010年K7站)—1.167 mg/L(2010年K2站)。
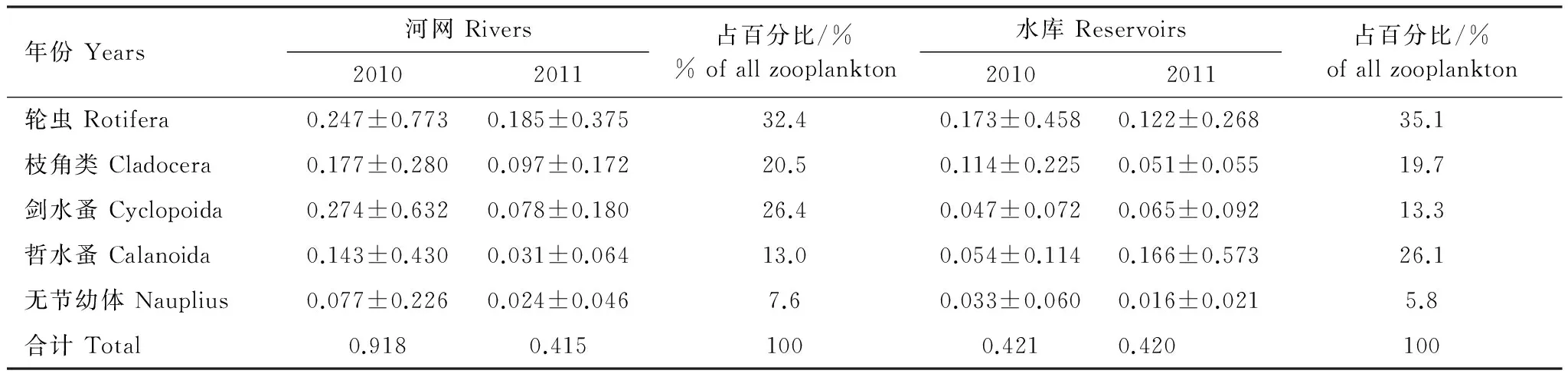
表4 2010—2011年河网和水库各类浮游动物平均生物量/(mg/L)(±标准差)Table 4 Each group biomass of zooplankton in the rivers and reservoirs during 2010—2012 (mean ± SD)
各类浮游动物密度(生物量)在河网、水库中的变动很大,河网群落密度的变异系数在161.8%(2010年枝角类)—325.5%(2010年无节幼体),生物量的变异系数在158.2%(2010年枝角类)—313.0%(2010年轮虫)之间;水库群落密度的变异系数在130.5%(2011年无节幼体)—317.9%(2010年哲水蚤),生物量的变异系数在107.8%(2011年枝角类)—345.2%(2011年哲水蚤)之间。这些变异分别来自空间和时间上的差异,统计分析结果表明:2年间,轮虫密度(生物量)在河网的不同水源地中分别存在显著(P<0.05)、极显著(P<0.01)的差异,而在不同水库之间无显著差异。另外,2010年(河网间)、2011年(水库间)剑水蚤的生物量存在显著(P<0.05)差异。较大的季节变异多发生于浮游甲壳动物,如2010年河网之间的枝角类、2011年水库之间的枝角类和哲水蚤,它们的密度和生物量有显著(P<0.05)的季节变化。河网的枝角类、剑水蚤和哲水蚤在7月、10月的密度(生物量)显著大于1月、4月,而水库中的枝角类、剑水蚤和哲水蚤则在1月份有较高的种群。
2.4 水质参数对浮游动物群落的影响
经逐步回归分析表明,河网水质参数与浮游动物群落之间的相关性比水库更紧密(表5),枝角类、哲水蚤与水质参数之间的回归方程均不理想。TP和NH4-N分别入选了河网和水库所有回归方程。影响河网各类浮游动物群落年均变动主要由DO、TP和Chl.a含量综合作用的结果,根据这些因子各相关系数的组成效应,将它们与浮游动物群落密度(生物量)的相关系数剖分为直接作用和通过其它因子的间接影响两部分进行通径分析[18]。如表6所示,水体TP含量对群落密度(生物量)变动的直接作用最大,其余依次为Chl.a和DO含量。其中,TP含量对群落变动的直接作用大于间接作用,而Chl.a和DO含量对群落变动的间接作用均大于它们直接作用,且分别表现为正向和负向的综合作用,间接作用效应主要通过TP含量而发生。由些可见,河网TP含量可以作为一个非常重要的直接影响浮游动物群落密度(生物量)变动的参数。影响水库浮游动物生物量的直接作用和综合作用效应均以DO因子为最大,其次为NH4-N因子,且均为正向。

表5 2010—2011年河网和水库水质参数对各类浮游动物密度N和生物量B的逐步回归分析Table 5 Stepwise multiple regression between zooplankton density (biomass) and the water environmental factors in the rivers and reservoirs during 2010—2012

表6 影响河网浮游动物密度变动的主要水质因子的相关与通径分析Table 6 Correlation and path analysis between the density of zooplankton and main water quality parameters in the rivers
鉴于各水质因子变量对群落变动的直接影响和总影响排序可能会不同,在此引入决策系数的概念,即用决策系数把各自变量对响应变量的综合作用进行排序,以确定主要决策变量和限制变量[19]。经计算,河网前述3个因子变量对群落密度的决策系数为:TP(0.549)>DO(-0.396)>Chl.a(-0.590);对群落生物量的决策系数为:TP(0.103)>DO(-0.541)>Chl.a(-0.687)。TP的决策系数为正值、且最大,说明对群落密度(生物量)变动的综合作用最大,是影响群落动态最主要的决策因素;而DO和Chl.a对应的决策系数为负值,说明是群落变动主要的限制因子。其中,Chl.a的决策系数最小,是影响群落增长最主要的限制因子。影响水库群落动态最主要的决策因素是NH4-N含量,pH值是其主要限制因子。
2.5 浮游动物群落对水体营养状态的响应
各类群浮游动物密度N(个/L)和生物量B(mg/L)对河网水体TLIc的逐步回归分析结果如下:
TLIc密度= 43.850+0.005NRoti+0.306NCycl- 0.034NNaup
(P= 0.0002,R= 0.9138, 决定系数=0.835)
TLIc生物量= 45.510-0.008BRoti+0.018BCycl+ 0.072BNaup
(P= 0.0001,R= 0.9222, 决定系数=0.850)
相关系数和通径分析见表7,剑水蚤群落密度对TLIc密度变动的直接作用最大,其余依次为无节幼体和轮虫。
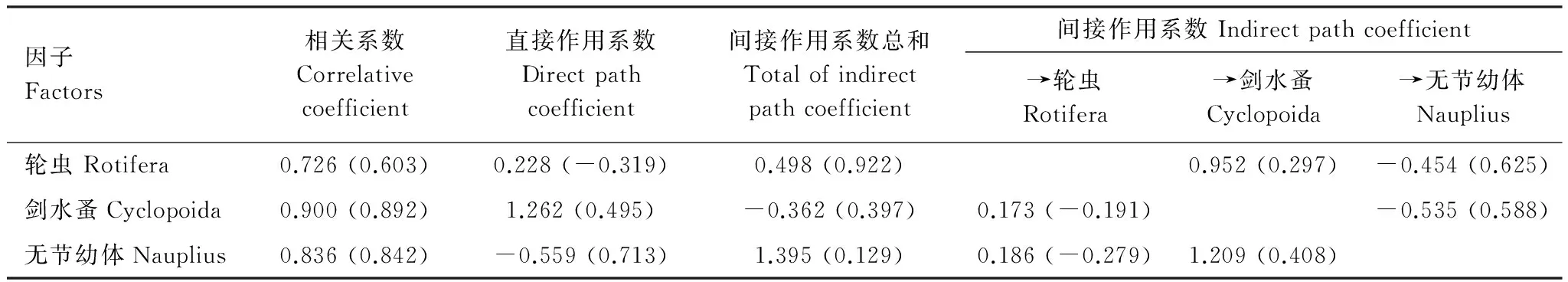
表7 影响河网综合营养指数TLIc密度(TLIc生物量)变动的主要群落的相关与通径分析Table 7 Correlation and path analysis between the TLIc密度(TLIc生物量)and main group of zooplankton in the rivers
其中,无节幼体和轮虫密度对TLIc密度变动的间接作用大于直接作用,且均为正效应,间接作用效应主要通过剑水蚤(繁殖产卵和为其提供食物)而发生;无节幼体生物量对TLIc生物量变动的直接作用最大,其余依次为剑水蚤和轮虫。其中,轮虫对TLIc生物量变动的间接作用大于直接作用,且综合作用结果为正效应,间接作用效应主要通过无节幼体(食物竟争)而发生。由此,可将剑水蚤和无节幼体视作对于水体富营养化响应非常重要的群落。同样经计算前述3个因子变量对TLIc密度的决策系数为:剑水蚤(0.678)>轮虫(0.280)>无节幼体(-1.248),影响TSIc密度变动最主要的决策因素是剑水蚤密度,主要的限制因子是无节幼体密度;对TLIc生物量的决策系数为:无节幼体(0.693)>剑水蚤(0.678)>轮虫(-0.487),影响TLIc生物量变动的主要决策因素是无节幼体和剑水蚤的生物量,主要的限制因子是轮虫生物量。2010—2011年水库各类群浮游动物密度(N)和生物量(B)对水体TSIc的逐步回归分析均无效(P>0.05)。
进一步的季节变化分析表明,河网冬季(1月)轮虫、春季(4月)无节幼体和夏季(7月)剑水蚤密度(生物量)与TLIc密度(TLIc生物量)值之间均有极显著的正相关性(n=16,P<0.01),秋季(10月)哲水蚤(2010年)、轮虫(2011年)的密度(生物量)与TLIc密度(TLIc生物量)值之间分别有显著的负、正相关性(n=8,P<0.05)。水库仅冬季(1月)无节幼体、春季(4月)枝角类和哲水蚤(负相关)密度(生物量)与水体TLIc密度(TLIc生物量)值之间有显著的相关性(n=16,P<0.05)。
3 讨论
3.1 饮用水源地浮游动物群落特征
河网和水库在浮游动物的优势种组成上有明显的差异,如河网中特有的富营养化指示种有角突网纹溞、裸腹溞和近邻剑水蚤,而水库则出现一些清水性环境指示种类,如圆筒异尾轮虫、颈沟基合溞等(表2)。年间变化表现为轮虫优势种类增加了,而浮游甲壳动物优势种类在减少的趋势,预示着饮用水源地富营养化的加重[20]。随着富营养化水平的提高,对环境敏感的哲水蚤种群下降直至消失,伴随着剑水蚤群落的上升[6]。浙江饮用水源地中,河网剑水蚤所占的生物量百分比例是哲水蚤的2倍,水库则恰好与之相反。河网浮游动物中具富营养化指示功能的优势种较多,群落平均密度和生物量也分别比水库高出73.1%和58.4%(表3,表4)。由此可见,饮用水源地浮游动物的群落特征与其水环境质量密切相关。另外,在枯水大潮期,海水入侵不同程度地影响着钱塘江饮用水源地诸多取水口的水质(如含氯度)[21],中华哲水蚤是东海桡足类优势种,该种群在H5—H6站10月份的出现可作为饮用水受钱塘江潮汐影响的指示生物。中华窄腹剑水蚤是我国河流中发现的土著种类,对咸度剧变的适应性强,具有较强的生态入侵能力,可成为抽水水库的优势浮游甲壳类[22]。
3.2 浮游动物群落与水环境因子的关系
河网水体的TN含量极高,平均值(3.363±1.65) mg/L超过Ⅴ类水标准的1.68倍。除H7、H8站NH4-N含量极显著地高(表1),提示该两站不断受到新近有机物的污染外,其他各站NH4-N(0.392±0.246) mg/L和TP(0.102±0.042) mg/L含量均达到或接近Ⅱ类水标准;水库TN(0.809±0.510) mg/L、NH4-N(0.113±0.110) mg/L分别低于Ⅲ类、Ⅱ类水质浓度限值,TP(0.017±0.009) mg/L含量则达到Ⅰ类水标准。可见,饮用水源地的TN含量过度,TP含量相对较低。除H5—H8站外,其它饮用水源地的氮磷比均大于30,为磷限制型水体[23],这可能导致河网TP是影响浮游动物群落最大的水质因子,并且Chl.a、DO因子均通过TP分别对群落产生正、负向效应的原因。Jayalakshmy等[24]认为海水中DO含量是影响海洋哲水蚤乳点水蚤(Pleuromamma)种群丰度最大的水质因子,这与本文的研究结果相似,即在营养水平较低的水库中,DO含量对浮游动物生物量的直接作用和综合作用效应均最大。但决策分析表明,影响水库群落生物量变动最主要的决策因素是NH4-N含量,而并非磷限制型水体中的TP,这是否与水库中极低的TP含量,而NH4-N浓度适中有关,还有待于进一步研究。另外,K3站(部分水域)2010年首次开展渔业资源增养殖放流,投放约9 t滤食性的花白鲢后,浮游动物密度的季节波动明显加剧,哲水蚤种群也随之消失。尽管水体的Chl.a含量下降了56.8%,而TN平均含量却从2010年的0.088 mg/L上升到2011年的0.898 mg/L,相应的氮磷比从6.47上升到68.65,氮磷比变动的标准差甚至超过了平均值(表1),一年之际水体也由氮限制型转变为磷限制型。可见,人类的生产活动对饮用水源地群落和水质影响之甚。
3.3 浮游动物群落对饮用水源地富营养的响应
在贫营养的岩溶湖泊水体中,浮游甲壳动物的种类数、密度和生物多样性指数均低于非岩溶湖泊中[25],这与营养水平较低的水库中浮游动物优势种类略少、密度和生物量小于营养水平较高的河网相一致;Guimares等论述了一种温剑水蚤(Thermocyclopsdecipiens)具有富营养化指示作用,可作为水生生物监测工具[26]。Beaugrand[27]通过划分海洋哲水蚤物种组合指标(依据适合生存温度、空间的异质性),并记录其长期的南北迁移变化,以监测海洋生态系统对气候变化的响应,认为该物种组合指标含有丰富的信息,并具有敏感性。本研究获得的轮虫、剑水蚤和无节幼体群落对河网综合营养指数TLIc响应拟合的回归方程(P<0.001),也可看作是一个群落组合指标。其中,剑水蚤密度(生物量)的变异系数处于中等水平,且密度(236.3%—243.9%)和生物量(230.7%—230.8%)变异系数波动范围均极小,促使其成为一类最重要和稳定的水质指示群落;而河网无节幼体密度的平均变异系数(261.8%)最大,构成了TLIc密度变动的限制因子,轮虫生物量的平均变异系数(257.9%)最大,成为TLIc生物量变动的限制因子。另外,浮游动物群落内部之间的捕食模式,即剑水蚤对纤毛虫原生动物和枝角类的捕食率显著高于轮虫,臂尾轮虫有较高的生物多样性归因于其披有被甲的保护[28],以及无节幼体和轮虫对TLIc密度变动的间接作用效应(主要)分别通过剑水蚤的繁殖产卵和捕食轮虫而实现(表7),这从另一侧面说明了剑水蚤是浮游动物中最稳定的群落。哲水蚤具有与轮虫和剑水蚤呈现逆向的分布格局,它们在营养水平较低的水体中更丰富,而轮虫和剑水蚤则在营养较高的水体中分布更多[20,29]。水库中哲水蚤占浮游动物生物量百分比例是河网的2倍,并且最大的群落变异表现为生物量上的波动(表4),可见个体差异较大的后生浮游动物作为水质监测器在一定程度上会影响其稳定性,这也是许多学者试图要解决的问题,如依据各种功能特性划分的物种组合指标[27]、对群落基础数据进行转换而成的拓展性指标[5- 6],诸如轮虫富营养指示种生物量%、甲壳动物富营养指示种生物量%、枝角类与桡足类的数量(NClad/NCope)或剑水蚤与哲水蚤的生物量(BCycl/BCala)之比,甲壳动物与轮虫的生物量之比(BCrust/BRoti)等指标的提出,本研究结果“剑水蚤是最重要、稳定的水质指示群落”对于筛选上述拓展性指标具有重要的指导作用。
[1] 周芬, 卢晓燕. 浙江省水库饮用水源地安全保障措施研究. 中国农村水利水电, 2009, (8): 37- 40.
[2] 秦伯强, 王小冬, 汤祥明, 冯胜, 张运林. 太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策. 地球科学进展, 2007, 22(9): 896- 906.
[3] 王东宇, 张勇. 2006年中国城市饮用水源突发污染事件统计及分析. 安全与环境学报, 2007,7(6): 150- 155.
[4] Bini L M, da Silva L C F, Velho L F M, Bonecker C C, Lansac-Tha F A. Zooplankton assemblage concordance patterns in Brazilian reservoirs. Hydrobiologia, 2008, 598(1): 247- 255.
[6] Vandysh O I. Zooplankton as an Indicator of the state of lake ecosystems polluted with mining wastewater in the Kola Peninsula. Russian Journal of Ecology, 2004, 35(2): 110- 116.
[7] Jeppesen E, Nõges P, Davidson T A, Haberman J, Nõges T, Blank K, Lauridsen T L, Søndergaard M, Sayer C, Laugaste R, Johansson L S, Bjerring R, Amsinck S L. Zooplankton as indicators in lakes: a scientific-based plea for including zooplankton in the ecological quality assessment of lakes according to the European Water Framework Directive (WFD). Hydrobiologia, 2011, 676(1): 279- 297.
[8] 张钰, 谷孝鸿. 江苏五市饮用水源地底栖动物调查及水质评价. 淮阴工学院学报, 2006, 15(3): 57- 59.
[9] 朱岩. 常州城市饮用水源水环境质量生物学评价. 科技资讯, 2007, (34): 131- 132.
[10] 章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991 .
[11] 王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961: 23- 284.
[12] 蒋燮治, 堵南山. 中国动物志(淡水枝角类). 北京: 科学出版社, 1979: 79- 273.
[13] 沈嘉瑞. 中国动物志(淡水桡足类). 北京: 科学出版社, 1979: 53- 420.
[14] 陈雪梅. 淡水桡足类生物量的测算. 水生生物学集刊, 1981, 7(3): 397- 408.
[15] 李强, 安传光, 马强, 徐霖林, 赵云龙. 崇明东滩潮间带潮沟浮游动物的种类组成及多样性. 生物多样性, 2010, 18(1): 67- 75.
[16] 王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47- 49.
[17] 唐启义, 冯明光. DPS数据处理系统——实验设计、统计分析及数据挖掘. 北京: 科学出版社, 2002: 636- 644.
[18] 陈鹏, 叶辉, 刘建宏. 云南瑞丽桔小实蝇成虫种群数量变动及其影响因子分析. 生态学报, 2006, 26(9): 2801- 2809.
[19] 袁志发, 周静芋, 郭满才, 雷雪芹, 解小莉. 决策系数——通径分析中的决策指标. 西北农林科技大学学报, 2001, 29(5): 131- 133.
[20] 王晓辉, 望甜, 林秋奇, 韩博平. 华南地区典型抽水型水库后生浮游动物群落的种类组成与结构. 生态学报, 2009, 29(1): 456- 465.
[21] 孙浙英, 孙志林, 许丹. 钱塘江饮用水源地含氯度受潮汐与径流影响分析. 人民长江, 2013, 44(9): 11- 14.
[22] 望甜, 王晓辉, 韩博平. 一座抽水水库中中华窄腹剑水蚤种群动态及其对浮游甲壳类群落结构的影响. 湖泊科学, 2009, 21(1): 112- 118.
[23] 彭近新, 陈慧君. 水质富营养化与防治. 北京: 中国环境科学出版社, 1988: 15- 47.
[24] Jayalakshmy K V, Saraswathy M, Nair M. Effect of water quality parameters on the distribution ofPleuromamma(Copepoda-Calanoida) species in the Indian Ocean: a statistical approach. Environmental Monitoring and Assessment, 2009, 155(1/4): 373- 392.
[25] Stankovic I, Ternjej I, Mihaljevic Z, Furac L, Kerovec M. Crustacean plankton community (Crustacea: Copepoda and Cladocera) in gypsum karst lakes and their relation to abiotic parameters. Hydrobiologia, 2011, 666(1): 145- 153.
[26] Landa G G, Barbosa F A R, Rietzler A C, Maia-Barbosa P M.Thermocyclopsdecipiens(Kiefer, 1929) (Copepoda, Cyclopoida) as indicator of water quality in the state of Minas Gerais, Brazil. Brazilian Archives of Biology and Technology, 2007, 50(4): 695- 705.
[27] Beaugrand G. Monitoring marine plankton ecosystems. Ⅰ: Description of an ecosystem approach based on plankton indicators. Marine Ecology Progress Series, 2004, 269: 69- 81.
[28] Kumar R. Effects ofMesocyclopsthermocyclopoides(Copepoda: Cyclopoida) predation on the population growth patterns of different prey species. Journal of Freshwater Ecology, 2003, 18(3): 383- 393.
[29] Nogueira M G. Zooplankton composition, dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), São Paulo, Brazil. Hydrobiologia, 2001, 455(1/3): 1- 18.
Characteristics of the zooplankton community and their association with environmental factors in drinking water sources, Zhejiang Province, China
XU Hangying1, YU Haiyan1, HAN Mingchun1, HUANG Pingsha2, LI Gongguo2,*
1ZhejiangEnvironmentMonitoringCenter,Hangzhou310007,China
2CollegeofBiologicalandEnvironmentalSciences,ZhejiangWanliUniversity,Ningbo315100,China
This study aimed to understand the characteristics of zooplankton community structure and their association with environmental factors in different sources of drinking water. A seasonal investigation was conducted on zooplankton from two drinking water sources (8 rivers and 8 reservoirs) in Zhejiang Province, China, from January 2010 to October 2011. A total of 21 dominant species (genus) of zooplankton (8 Rotifera, 5 Cladocera, 5 Cyclopoida, and 3 Calanoida) were recorded. The primary dominant species in each group of zooplankton werePolyarthratrigla,Bosminalongirostris,Thermocyclopsdybowskii, andSinocalanusdorrii, respectively. Nine of the dominant species (genera) were at the same time indicator species of water trophic state. The more frequently that indicator species of trophic state occurred, the more comprehensive the trophic level index (TLIc) (P< 0.01) of the rivers was. Over the 2-year study period, the average density of zooplankton in the rivers and reservoirs was 345.2 L-1and 199.4 L-1, respectively, while the biomass was 0.667 mg/L and 0.421 mg/L, respectively. Rotifer and copepod nauplii dominated both the rivers and reservoirs, representing 87.9% and 88.3% density, respectively. Crustaceans were mainly Cyclopoida, which had 2 times the biomass of Calanoida in the rivers, whereas Calanoida had 2 times the biomass of Cyclopoida in the reservoirs. The river community density (biomass) coefficient of variation ranged between 158.2% and 325.5%, while that of reservoirs ranged between 107.8% and 345.2%. The results of the stepwise regression analysis showed that the correlative coefficient between the density (biomass) of the zooplankton community and the water quality factors was much higher in the rivers (P< 0.01) than in the reservoirs (P< 0.05). Total phosphorus (TP) and ammonia nitrogen primarily occurred in the rivers and the reservoirs in all effective regression equations, respectively. Path and decision coefficient analysis showed that TP and chlorophyll a (Chl.a) content in the rivers had a positive effect on the population dynamics of the zooplankton community (rotifers, copepod nauplii, and Cyclops), whereas dissolved oxygen content had a negative effect. TP was the most important factor affecting population dynamics of rotifers, copepod nauplii, and Cyclops in the rivers, whereas Chl.a was the most important factor limiting the communities growth. The reservoir fishery resources aquaculture might cause zooplankton abundance to decline, the Calanoida community to gradually disappear, and the water trophic state to transform from nitrogen limitation conditions to phosphorus limitation conditions. The river community (rotifers, copepod nauplii, and Cyclops) density (biomass) had a significant linear regression relationship with the water trophic indexTLIcDensity(TLIcBiomass) (P< 0.001). Copepod nauplii density constituted a limiting factor forTLIcDensity, due to its maximum average coefficient of variation (261.8%). Rotifer biomass constituted a limiting factor forTLIcBiomass, due to its maximum average coefficient of variation (257.9%). The average variation coefficient of Cyclops density (biomass) was moderate, with small fluctuations; thus, this group represented the most important and stable water quality indicator. The study results provide an important reference for selecting specific expansion indicators of the zooplankton community in water quality monitoring. None of the zooplankton community density (biomass) groups in the reservoirs had any significant linear regression relationships with the waterTLIc(P> 0.05).
drinking water sources; zooplankton; stepwise regression analysis; path analysis; comprehensive of trophic level index
2013- 12- 24;
日期:2015- 04- 14
10.5846/stxb201312243014
*通讯作者Corresponding author.E-mail: ligongguo@tom.com
徐杭英,于海燕, 韩明春,黄平沙,李共国.浙江饮用水源地浮游动物群落特征及环境响应.生态学报,2015,35(21):7219- 7228.
Xu H Y, Yu H Y, Han M C, Huang P S, Li G G.Characteristics of the zooplankton community and their association with environmental factors in drinking water sources, Zhejiang Province, China.Acta Ecologica Sinica,2015,35(21):7219- 7228.
——以“不同咖啡因饮料对水蚤心率的影响”为例

