水引发对油松种子和幼苗的生理效应及其作用机理
贺红娟,管桦,张存莉
西北农林科技大学生命科学学院, 杨凌 712100
水引发对油松种子和幼苗的生理效应及其作用机理
贺红娟,管 桦,张存莉*
西北农林科技大学生命科学学院, 杨凌 712100
为了解决油松种子在直播造林中发芽率低、幼苗抗旱性差的问题,研究了油松种子水引发的方法及引发对其种子和幼苗的生理效应,并对水引发后幼苗的抗旱机理进行了探索。结果表明:油松种子水引发的最佳条件为10 ℃,闭光条件下分批给种子加水,加水总量为种子初始质量的30%,引发10 d。水引发可显著(P<0.05)降低种子的半数发芽天数和硬实率,显著提高种子的发芽指数、最终发芽率和活力指数;水引发种子的可溶性糖及可溶性蛋白含量相比对照也得到提高。水引发可增加油松幼苗的茎粗、鲜重及根长,降低其相对苗高;并极显著(P<0.01)提高了幼苗过氧化氢酶、过氧化物酶和根内脱氢酶活性,降低了游离氨基酸含量。干旱胁迫下,引发种子的幼苗脯氨酸和可溶性糖含量分别高于对照39.6%、118.9%,丙二醛含量低于对照93.4%,均达极显著水平。综合分析认为,水引发提高了种子可溶性糖及可溶性蛋白含量为种子萌发提供了保障,从而提高了种子发芽率,并通过增强幼苗抗氧化酶活性、降低丙二醛含量,进而增强幼苗抗氧化系统的功能,最终明显提高其抗旱性。
油松;水引发;生理效应;种子萌发;干旱胁迫
种子引发是为种子萌发进行生理准备的一种播前种子处理技术[1],其基本原理是通过水合方式对温度、种子水分和萌发时间等进行渗透调控,引发后的种子可回干储存,也可直接播种。水引发是在控制给水条件下使种子定量吸水,达到促进萌发且不引起吸涨伤害的浸种技术[2]。在引发过程中种子膜系统、遗传物质DNA被修复,打破休眠,同时RNA含量大大提高,促进了蛋白质的合成,使其处于准备萌发状态[3-4]。种子引发可改善种子发芽特性,增强种子的抗逆性,加快出苗速率,使出苗一致[5- 8]。引发处理对种子萌发及其幼苗抗逆性的研究,在大豆[9]、小麦[7,10]等作物种子中均有报道,而对林木种子的研究较少。
目前全球荒漠化面积日益扩大,严重威胁着人类的生存和发展。直播造林速度快、省劳力、适用于人烟稀少、人工造林困难的边远山区,已成为进行荒漠化治理的重要途径。油松(Pinustabulaeformis)抗干旱瘠薄,具有较高的生态稳定性与生产力水平,是直播造林的重要树种,但在荒漠环境下油松种子萌发率低且种苗抗干扰能力差,制约着直播造林的成效。为了解决这一问题,本论文对油松种子的水引发方法、引发前后种子和幼苗的生理效应及引发后幼苗的抗旱机理进行了研究,旨在为直播造林提供技术支撑和理论指导。
1 材料与方法
1.1 供试材料及处理
油松种子2008年10月采于山西吕梁市,清洗后选种,风干后存于4 ℃冰箱,备用。种子初始含水量为9.05%,千粒重为48.78 g。
1.2 油松种子水引发单因素试验
1.2.1 引发光照条件的考察
随机取种50粒,精确称重后置于内有2层湿润滤纸的培养皿内并加盖。在室温下,分别在每日光照12 h和暗培养条件下进行吸水试验,4次重复。吸水期间,每隔16 h取种并吸干其表面水分称重,分析光照对种子吸水和萌动情况的影响。吸水率以吸水重占种子初始重量的百分率表示。
1.2.2 引发种子吸水量和加水时段的考察
经过筛选同法培养种子,根据种子吸水曲线图,确定种子引发的吸水总量和不同时段种子吸水量。
1.2.3 引发持续时间的考察
设定(5±1)、(10±1)、(15±1)、(20±1)℃ 4个温度梯度,依照1.2.2试验获得的不同时间段的吸水总量范围,设置5个加水量梯度,将121 g油松种子装入引发器(29.5 cm ×22 cm×4 cm)中。引发期间,依据1.2.2确定的种子不同时段的吸水量,将水分批加入引发器中,搅匀后用扎有小孔的塑料薄膜封口。每次加水之后,充分摇动引发器,使种子均匀吸水;每天观察种子,记录不同条件下种子出现萌动的时间。
1.3 种子引发的优化试验
设定的(5±1)、(10±1)、(15±1)、(20±1)℃ 4个温度梯度,与1.2确定的种子加水量、引发时间三因素随机组合,进行种子引发试验。将引发后的种子进行发芽试验,以种子最终发芽率、发芽指数为指标,确定种子引发的最适温度、水分和时间。
种子的发芽试验:引发结束后,选取大小一致的种子,采用培养皿纸上发芽法[11]做萌发试验,水量为正好有层水膜包裹种子为宜,每皿50粒种子,设4个重复,置入于(25±1)℃恒温培养间中,每天12 h光照,种子发芽过程中适量喷水,直到引发种子发芽率稳定为止;以常规处理种子(始温45 ℃的水,浸泡24 h)为对照,同法进行发芽培养。
① 最终发芽率
GP=(最终发芽种子数/供试种子数)× 100%
②发芽指数
GI=∑(Gt/Dt)
式中,Gt为不同时间的发芽数,Dt为相应发芽天数
③水引发临界阐值
SV=(GP+GI)/2
式中,SV是种子GP和种子GI的综合评价值。SV值越大,表明引发效果越好。
1.4 种子的生理指标测定
根据1.3筛选的条件引发油松种子后,测定种子的生理指标,试验设4次重复,每个重复测3组。可溶性糖采用蒽酮比色法测定,丙二醛(MDA)含量采用硫代巴比妥酸比色法测定,游离脯氨酸采用茚三酮显色法测定,可溶性蛋白质采用考马斯亮蓝G-250染色法测定[12-13]。比色均采用UV-1700型可见紫外分光光度计测定。
1.5 萌发试验
取引发和对照种子与1.3同法进行纸床发芽,10次重复,逐日统计发芽数,计算最终发芽率,发芽指数,硬实率,活力指数,并统计半数发芽天数:
硬实率=(硬粒数/供试种子数)× 100%
活力指数=发芽率 ×苗鲜重
半数发芽天数(the 50% seeds germination days,T50):种子达最终发芽率50%所需要的时间。
1.6 引发后幼苗形态和生理效应
纸床发芽培养7d后,选择发芽良好的油松种子移入营养钵(口径×高:13 cm×15 cm)中培养,每钵12粒,4次重复,营养钵中土壤为深层土与营养基质(购于西北农林科技大学新天地设施农业开发有限公司,有机质≥50%、腐殖酸≥20%、pH值=5.5—6.5)按2∶1配比而成。继续培养14 d,待幼苗生长稳定后,每个重复选10株,游标卡尺测量其地径、苗木高度和根长,电子天平(精确度0.0001 g)测定苗鲜重,计算相对苗高值(相对苗高为苗木高度与苗木地径之比)。并测定幼苗过氧化物酶(POD)、过氧化氢酶(CAT)、根系脱氢酶活性和游离氨基酸含量[12],每个重复测3组。
1.7 引发后幼苗的抗旱效应
将上述培养14 d的幼苗,进行水分干旱胁迫。采用分子量为6000的聚乙二醇(PEG)溶液控制形成特定的水势梯度,以模拟水分胁迫条件。PEG溶液浓度与水势之间的换算关系按Michel和Kaufmann的经验公式计算和配制[14],即:
Ψs=-(1.18 × 10-2)C-(1.18 × 10-4)C2+(2.67 × 10-4)CT+(8.39 × 10-7)C2T
式中,Ψs为水势(bar),C为浓度(%),T为实验温度(℃)。
本试验设置-1.0 Mpa的胁迫,其水势为-10 bar。第一次浇灌PEG溶液时要使其充分湿润土壤,为保持水势恒定,每天浇灌-1.0 MPa PEG溶液,胁迫8 d后测定幼苗的脯氨酸、可溶性糖及丙二醛含量。对照为常规处理后受水分胁迫的油松幼苗,方法同上。
1.8 数据处理
采用Microsoft Excel 录入数据、作图,进行t-检验;采用SPSS 13.0 进行指标间相关性回归分析。
2 结果与分析
2.1 种子引发的光照条件
室温条件下,在0—48 h,光培养与暗培养种子的萌动趋势相近,萌动率基本相同;48 h后,光培养种子萌动率迅速上升,而暗培养种子的萌动率小幅度上升后进入滞缓期(图1)。光培养种子的萌动变化快,进入萌发滞缓期时间过长,不利于种子引发条件的控制和引发种子的贮藏,因此油松种子引发适宜暗培养。
2.2 种子引发吸水总量及不同时段吸水率
在25 ℃,暗培养条件下,种子吸水率和萌动率见图2。由图可知,16 h为油松种子初始萌动时间,吸水率为26.3%;当萌动率大幅增加至26%时,吸水总量大约是种子初始质量的39%。0—16 h为种子的快速吸涨期,其吸水量约占吸水总量的68%;16—104 h为种子吸水滞缓期,吸水量占种子吸水总量的32%。故水引发加水量应为种子初始质量的26%—39%。考虑到种子呼吸,在引发器上留有缝隙时水分的蒸发损失,设定引发过程中加水量应为种子初始质量的30%—60%。
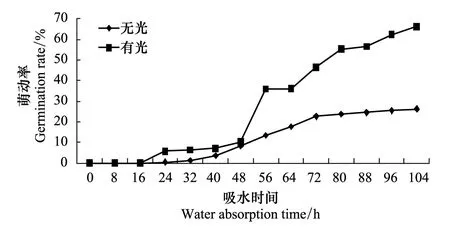
图1 暗培养及光照培养条件下油松种子萌动变化 Fig.1 Changes of germination in the dark and light cultivation for Pinus tabulaeformis seed
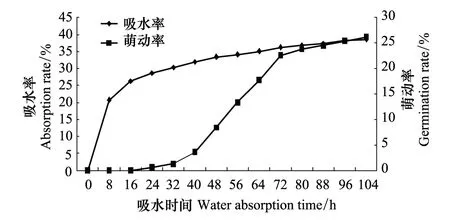
图2 油松种子的吸水率及萌动率变化 Fig.2 Changes of water absorption and germination for Pinus tabulaeformis seed
2.3 种子引发的时间范围
不同温度和加水量引发种子的初始萌动时间见表1,在(5±1)℃培养下,在不同加水量条件下,10 d内种子均已萌发;(10±1)℃培养下,加水总量为油松种子初始质量的30%和35%时,未观测到萌发的种子;当处理温度为(15±1)、(20±1)℃时,加水总量为30%条件下,种子未萌发,但出现了一定数量的霉变种子。在不同温度和加水量组合处理中的各个萌动组,种子初始萌发的时间有差异,时间介于4—10 d。由温度为(10±1)、(15±1)、(20±1)℃,加水量为30%,种子未萌发的试验组分析得出,油松种子水引发的初始时间为6 d左右。

表1 不同处理下种子萌动天数 (种子露白时间)/dTable 1 seeds buding days for different treatments seeds germination time:day/d)
“—”: 种子的萌动时间超过10 d
2.4 种子引发的优化试验
根据2.2确定的种子吸水量为种子初始质量的30%—60%,设定加水量分别为种子初始质量的30%、35%、40%、50%、60% 5个梯度;根据2.3确定的种子引发初始时间,逐天设定时间梯度,并分别与设定的(5±1)、(10±1)、(15±1)和(20±1)℃ 4个温度梯度组合,共设计74个处理,依据2.2确定加水时段,0—16 h加入吸水总量的的68%;16—104 h加入吸水量总量的32%,暗培养情况下进行种子引发,引发效果见表2。
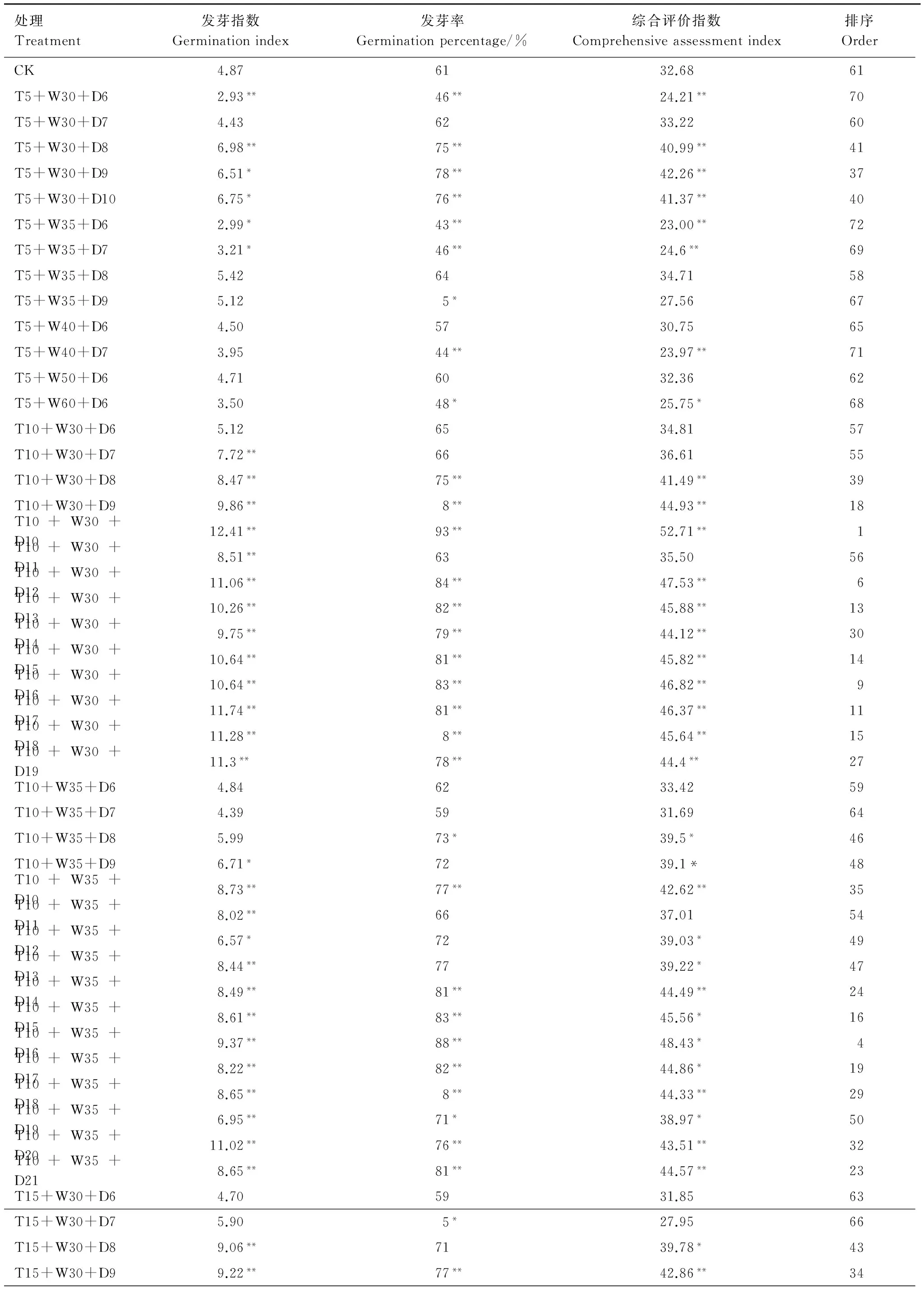
表2 不同条件下引发油松种子的发芽率和发芽指数及综合评价Table 2 Germination percentage, germination index in different conditions of water priming of primed Pinus tabulaeformis seeds and comprehensive assessment
从种子的发芽指数、发芽率及综合评价指数来看,种子引发的最佳条件为T10+W30+D10。因此确定油松种子水引发最佳条件为:暗培养,引发温度为10 ℃,引发时间为10 d,加水量为种子初始质量的30%,分批加水,在引发0、8、16、40、64 h和88 h时分别加入总水量的53.6%、14.5%、14.5%、8.3%、5.7%、3.4%。
2.5 引发后油松种子和幼苗的形态及生理变化
水引发油松种子及引发种子的幼苗各项指标的测定结果见表3,引发后种子可溶性糖及可溶性蛋白含量分别比对照提高了25.2%,18.0%,差异极显著;种子脯氨酸和丙二醛含量与对照无统计差异。水引发油松种子相比对照,T50和硬实率分别极显著降低了37.5%,48.8%,活力指数显著提高了16.8%,发芽指数及发芽率分别极显著提高了42.8%,18.2%。引发后幼苗相对苗高比对照降低了34.7%,茎粗和苗鲜重分别比对照提高了30.9%和105.4%,差异均极显著;植株CAT和根系脱氢酶的活性比对照分别增长了31.2%和70.6%,POD比对照活性增加了9.4倍,游离氨基酸(100克样品中氨基态氮)含量比对照下降了41.67%,差异均极显著。
2.6 引发幼苗的抗旱效应
干旱胁迫下引发后油松幼苗脯氨酸含量为0.016%,可溶性糖含量为0.57%,与对照(0.0097%、0.11%)相比,分别提高了39.6%和118.9%,差异均极显著;引发后幼苗丙二醛含量为0.17 μmol/g,与对照(2.58 μmol/g)相比,降低了93.4%,差异极显著。
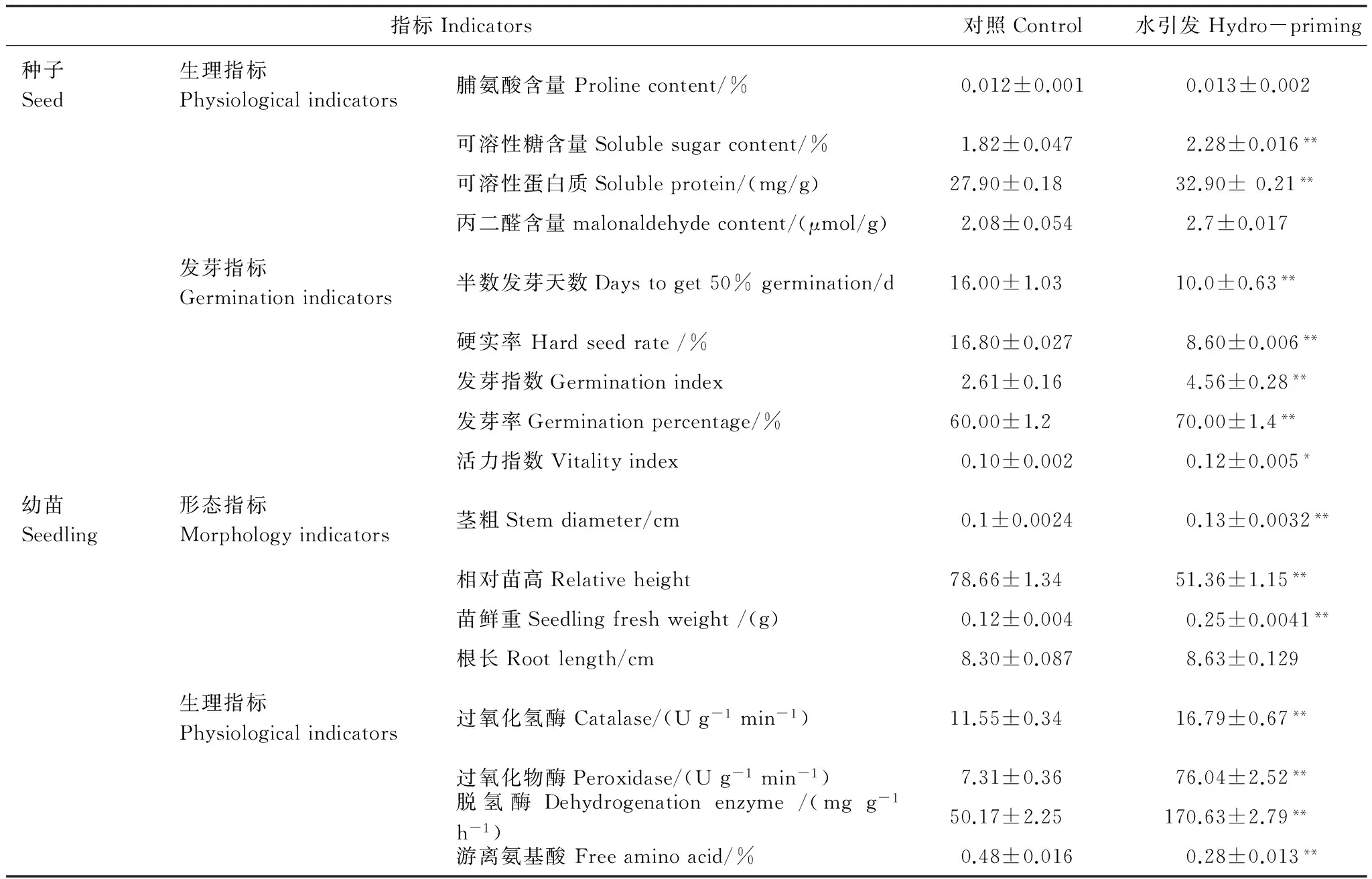
表3 水引发后油松种子及其培养21天的幼苗各项生理形态指标Table 3 Physiological and morphological indicators of Pinus tabulaeformis seeds of water priming and seedlings cultivated 21 days
表中数据均为均值±标准误,生理指标n=12,发芽指标n=10,形态指标n=40,**表示处理组与对照组差异极显著(P<0.01),*表示处理组与对照组差异显著(P<0.05)
2.7 相关性分析结果
将引发后油松种子和幼苗及干旱胁迫下幼苗的各项生理指标进行相关性分析,结果见表4。由表可知,种子的脯氨酸含量与幼苗CAT活性呈极显著(P<0.01)正相关,但种子MDA含量与其显著(P<0.05)负相关;种子可溶性糖含量与幼苗CAT显著正相关、与POD和脱氢酶活性呈极显著正相关、与游离氨基酸含量呈极显著负相关;种子可溶性蛋白质含量则与幼苗POD活性呈显著正相关,与游离氨基酸含量呈显著负相关。种子可溶性糖和可溶性蛋白质含量与胁迫幼苗脯氨酸含量呈极显著正相关,分别与幼苗MDA含量呈极显著、显著负相关;种子可溶性糖含量与胁迫幼苗可溶性糖含量呈显著正相关。
将水引发后的幼苗与其干旱胁迫后幼苗的各项生理指标进行相关分析,结果见表5。由表可知,幼苗POD和脱氢酶活性与胁迫后幼苗植株内的脯氨酸和可溶性糖含量均呈极显著正相关,与MDA含量呈极显著负相关;幼苗游离氨基酸含量与胁迫下幼苗的脯氨酸和可溶性糖含量呈极显著负相关,与MDA含量呈极显著正相关。
3 讨论与结论
3.1 油松种子水引发方法
引发时间因引发剂、溶液渗透势、温度、或物种的不同而异,可在2—21 d之间变化[15],这与本试验引发10 d的结果相符。引发温度一般在15—20 ℃[15],有的在较低温度(5 ℃)引发效果较好[16-17],这与本研究的10 ℃有差异,这种差异可能是由物种的生物学特性决定的。种子吸水速率也是影响引发效果的一个重要因素[18]。本试验通过定时、定量加水控制种子吸水速度和吸水量,防止种子因吸水过快或过多而造成的吸涨伤害,从而保护了种子细胞膜结构,避免了内溶物的流失。本试验首次研究了油松水引发过程是否需要光照,试验表明油松水引发适宜在暗培养下进行,这可能与油松的生物学特性有关。

表4 油松种子与幼苗及干旱胁迫后幼苗各项生理指标的相关分析Table 4 Correlation analysis of tested indicators of Pinus tabulaeformis seeds and seedlings and seedlings under water stress

表5 幼苗与干旱胁迫后幼苗各项生理指标间的相关分析Table 5 Correlation analysis of tested indicators of seedlings and seedlings under drought stress
本研究表明油松种子水引发的最适条件:10 ℃条件下暗培养,引发10 d,加水量为种子初始质量的30%,分批加水。
3.2 水引发提高油松种子活力的机制
可溶性糖是调节渗透胁迫的小分子物质,又是植物代谢的基础物质[19],水引发油松种子可溶性糖含量极显著提高了25.2%,为其种子萌发提供了能量基础。水引发种子的可溶性蛋白含量较对照极显著提高了18.0%,通过对水稻种子在谷粒充盈过程中蛋白质的表达进行研究,发现持续上调的蛋白质主要参与淀粉合成[20],而种子响应水分处理的差异表达蛋白质主要参与能量代谢和蛋白质定位[21]。可见种子内部可溶性蛋白质在种子萌发中主要参与能量代谢和物质的合成,促进细胞生长。水引发可提高油松种子的发芽指数、最终发芽率和活力指数,降低种子的T50,T50越小说明种子萌发时间越集中、发芽一致性越好。水引发可显著降低油松种子的硬实率,表明水引发可以破除油松种子的硬实。水引发启动油松种子的萌发机制可能是:水引发处理提高了种子内部可溶性糖和可溶性蛋白质的积累量,促进物质的合成和细胞生长,并且调动能量代谢,为种子内部代谢活动提供能量和物质基础。
3.3 水引发提高油松幼苗活力的机制
引发可以提高幼苗CAT、POD等保护酶活性,使其抵抗逆境的能力提高[22-23],比如用丁二胺引发烟草种子能够增加寒冷胁迫下烟草幼苗中抗氧化酶的活性[24]。CAT普遍存在于植物组织中,是重要的保护酶之一,微体中产生的H2O2可通过其得到清除[25]。而根系脱氢酶活力是植物根系活力的一种量度,代表了根细胞的活力,是植物健康生长的标志,酶活性越高,说明植株生长越健壮[26]。水引发后的油松幼苗CAT、POD及根系脱氢酶活性均有极显著提高,与文献结果一致[24],说明水引发提高了幼苗抗氧化系统的功能,增强了幼苗根系生长活力。水引发后油松幼苗的茎粗和苗鲜重均极显著提高,根长也有所增加,相对苗高值则有所下降,表明水引发可增强幼苗的健壮度。胚根突破种皮后,胚生长时优先利用的物质便是自身的脂肪酸、还原糖、氨基酸等[27-28]。本试验引发处理的幼苗可能先行大量动用了自身的游离氨基酸来完成其他蛋白质的合成和转化,因此水引发幼苗植株内的游离氨基酸含量显著低于对照。
将水引发后油松种子和幼苗各项生理指标进行相关性分析(表4)的结果表明引发种子高可溶性糖含量可以提高幼苗CAT、POD和根系脱氢酶活性;引发种子高可溶性蛋白含量可以提高幼苗POD活性。因此,水引发提高油松幼苗活力的机制可能是:水引发加速了油松种子内部可溶性糖的积累和代谢,提高了可溶性蛋白质水平,进而提高幼苗CAT、POD、脱氢酶活性,并加速游离氨基酸分解利用,完成酶的合成和转化,使幼苗的茎粗、相对苗高和苗鲜重等形态指标得到增强。
3.4 水引发提高油松幼苗抗旱性的机制
MDA是过氧化的最终产物,又是一种高活性的脂质过氧化物,能交联脂类、核酸、糖类及蛋白质,从而进一步对质膜的结构和功能造成不良的影响,使其电解质泄漏量增加,影响细胞膜的流动性及其与酶的结合力[29]。在水分胁迫下,水引发处理的油松幼苗丙二醛含量极显著低于对照93.4%,表明水引发幼苗的膜系统稳定性增强,有利于增强幼苗活力,进而提高幼苗的抗旱性;引发幼苗的脯氨酸和可溶性糖含量分别高于对照39.6%、118.9%,表明水引发可提高油松幼苗在干旱胁迫下的基础代谢物质。
将水引发油松种子与其干旱胁迫后幼苗的生理指标进行相关性分析(表4)的结果表明种子内部高可溶性糖和可溶性蛋白质水平,有利于提高胁迫后幼苗的脯氨酸含量,降低MDA含量,并对胁迫时幼苗内部可溶性糖的积累有一定作用,从而减轻了幼苗膜脂过氧化作用的能力,提高苗株的抗旱性和持水性。通过对向日葵种子进行水引发,发现引发能够促进干旱胁迫下种子的萌发及幼苗的生长[30],与本试验结果相符。将水引发后的油松幼苗与干旱胁迫后幼苗的各项生理指标进行相关性分析(表5)的结果表明在幼苗生长初期,高水平的POD和根系脱氢酶活性、低游离氨基酸水平是干旱胁迫下提高幼苗脯氨酸和可溶性糖含量,降低MDA含量的前提。由此推测,水引发提高油松幼苗抗旱性的生理调节机制可能是:水引发可促进种子内部可溶性糖的积累和利用,提高可溶性蛋白质含量,增强幼苗POD和根系脱氢酶活性,加速游离氨基酸的利用,并使幼苗在干旱胁迫后植株内可溶性糖含量稳定提高,调节其脯氨酸的累积速率,增加细胞原生质浓度,降低了MDA对幼苗的伤害,提高苗株的抗旱性和持水性,从而更好的应对不良环境。
综上所述,油松种子通过水引发,使种子的发芽率和幼苗的抗旱性得到大幅度提高,为在世界范围内实现绿化造林、解决荒漠化问题提出了一条有效途径,值得深入研究。
[1] Heydecker W, Higgins J, Gulliver R L. Accelerated germination by osmotic seed treatment. Nature, 1973, 246(5427): 42- 44.
[2] 刘慧霞, 王彦荣. 水引发对紫花苜蓿种子萌发及其生理活动的影响. 草业学报, 2008, 17(4): 78- 84.
[3] 任淑娟, 喻方圆, 徐丽萍. 引发对马尾松种子细胞周期和发芽率的影响. 南京林业大学学报: 自然科学版, 2012, 36(5): 51- 55.
[4] 宋柏权, 范有君, 闫志山, 孙秀才, 刘娜, 赵海英, 杨骥. 种子引发技术对甜菜纸筒育苗出苗的影响. 作物杂志, 2012, (6): 135- 138.
[5] 阮松林, 薛庆中. 植物的种子引发. 植物生理学通讯, 2002, 38(2): 198- 202.
[6] Nayyar H, Wallia D P, Kaistha B L. Performance of bread wheat (Triticumaestivum)seed primed with growth- regulators and inorganic salts. The Indian Journal of Agricultural Sciences, 1995, 65(2): 112- 116.
[7] Nawaz F, Ashraf M.Y, Ahmad R, Waraich E A. Selenium (Se)seed priming induced growth and biochemical changes in wheat under water deficit conditions. Biological Trace Element Research, 2013, 151(2): 284- 293.
[8] Rahimi A. Seed priming improves the germination performance of cumin (CuminumsyminumL.)under temperature and water stress. Industrial Crops and Products, 2013, 42: 454- 460.
[9] 顾龚平, 吴国荣, 陆长梅, 周长芳, 左吉吉, 魏锦城. PEG处理对大豆幼苗活力及活性氧代谢的影响. 中国油料作物学报, 2000, 22(2): 26- 30.
[10] Farooq M, IrfanM, Aziz T, Ahmad I, Cheema S A. Seed priming with ascorbic acid improves drought resistance of wheat. Journal of Agronomy & Crop Science, 2013, 199(1): 12- 22.
[11] International Seed Testing Association (ISTA). International rules for seed testing. Seed Science and Technology, 1999, 27(Supplement): 27- 32, 174- 182.
[12] 李合生. 植物生理生化的试验原理和技术. 北京: 高等教育出版社, 1999.
[13] 高俊凤. 高级植物生理学实验指导. 北京: 高等教育出版社, 2006.
[14] Burlyn B E, Michel M R. The osmotic potential of polyethylene glycol 6000. Plant Physiology, 1973, 51(5):914- 916.
[15] Khan A A. Preplant physiological seed conditioning. Horticultural Reviews, 1992, 13(1): 131- 181.
[16] Heydecker W, Higgins J, Turner Y J. Invigoration of seeds. Seed Science and Technology, 1975, 3: 881- 888.
[17] 傅家瑞. 种子生理. 北京: 科学出版社, 1985: 335- 375.
[18] 王彦荣. 种子引发的研究现状. 草业学报, 2004, 13(4): 7- 12.
[19] Foy C D, Chaney R L, White M C. The physiology of metal toxicity in plants. Annual Review of Plant Physiology, 1978, 29(1): 511- 566.
[20] Xu C P, Sullivan J H, Garrett W M, Caperna T J, Natarajan S. Impact of solar ultraviolet-B on the proteome in soybean lines differing in flavonoid contents. Phytochemistry, 2008, 69(1): 38- 48.
[21] Pawlowski TA. Proteomics of European beech (FagussylvaticaL.)seed dormancy breaking: influence of abscisic and gibberellic acids. Proteomics, 2007, 7(13): 2246- 2257.
[22] 王彦荣, 张建全, 刘慧霞, 胡小文. PEG引发紫花苜蓿和沙打旺种子的生理生态效应. 生态学报, 2004, 24(3): 402- 408.
[23] 朱志玉. 沙引发及抗寒剂处理对水稻种子发芽及幼苗抗寒性的影响 [D]. 浙江: 浙江大学, 2002.
[24] Xu S C, Hu J, Li Y P, Ma W G, Zhang Y Y, Zhu S J. Chilling tolerance inNicotianatabacuminduced by seed priming with putrescine. Plant Growth Regulation, 2011, 63(3): 279- 290.
[25] Ushimaru T, Kanematsu S, Shibasaka M, Tsuji H. Effect of hypoxia on the antioxidative enzymes in aerobically grown rice (Oryzasatiba)seedlings. Physiologia Plantarum, 1999, 107(2): 181- 187.
[26] Michelet B, Boutry M. The plasma membrane H+-ATPase, a highly regulated enzyme with multiple physiological functions. Plant Physiology, 1995, 108(1): 1- 6.
[27] 邱倩倩, 李明, 姚东伟, 陈磊, 朱月林. 蛭石引发对NaCl单盐胁迫下辣椒种子萌发和幼苗抗氧化特性的影响. 上海农业学报, 2009, 25(3): 47- 50.
[28] 马艳华, 宋瑜, 张洪荣. 烯效唑对黑麦草抗旱生理特性的影响. 草业科学, 2009, 26(5): 169- 173.
[29] 梁强, 叶艳萍, 桂杰, 娄予强, 韦继敏, 李杨瑞. 喷施黄腐酸对干旱胁迫下甘蔗苗期叶绿素荧光参数及丙二醛的影响. 广西植物, 2009, 29(4): 527- 532.
[30] Kaya M D, Okçu G, Atak M, ÇklY, KolsarcÖ. Seed treatments to overcome salt and drought stress during germination in sunflower (HelianthusannuusL.). European Journal of Agronomy, 2006, 24(4): 291- 295.
Physiological effects and mechanisms ofPinustabulaeformisseeds and seedlings by hydro-priming
HE Hongjuan,GUAN Hua, ZHANG Cunli*
CollegeofLifeSciences,NorthwestAgricultureandForestryUniversity,Yangling712100,China
The hydro-priming technique was adopted forPinustabulaeformisseeds to solve the poor emergence and drought resistance of direct seeding in the present study. The effect of hydro-priming on the seed, seedling, and the drought resistance mechanism of the primed seedling were also explored. The results showed that the optimal condition for hydro-priming was at 10 °C for 10 days under dark condition, and in the presence of 30% additional water to the original seed mass. Specifically, a succession of total water percentages (53.6%, 14.5%, 14.5%, 8.3%, 5.7%, and 3.4%)was added at 0 h, 8 h, 16 h, 40 h, 64 h, and 88 h after starting priming, respectively. The effects of hydro-priming onP.tabulaeformisseeds were documented in comparison to the control. First, the 50% seed germination days and hard seed rate of primed seeds were significantly reduced by 37.5% and 48.8%, respectively. The germination index, the final germination percentage, and seed vitality index were also improved by 42.8%, 18.2%, and 16.8%, respectively. Soluble sugar and soluble protein content of primed seeds increased by 25.2% and 18.0%, respectively. These results demonstrated that the hydro-priming technique improved the performance ofP.tabulaeformisseeds. Second, the relative plant height of hydro-primed seedlings decreased by 34.7%. Stem diameter, fresh seedling weight, and root length increased by 30.9%, 105.4%, and 3.9%, respectively. Third, catalase and peroxidase activity in seedlings and the dehydrogenation enzyme in the root increased by 31.2%, 9.4 times, and 70.6%, respectively. Free amino acid content declined by 41.4%. These results show that the physiological indexes of hydro-primed seedlings were considerably different to those of non-primed, with hydro-priming strengtheningP.tabulaeformisseedlings. Finally, under drought stress, proline and soluble sugar content in seedlings from primed seeds were significantly enhanced by 39.6% and 118.9%, respectively. In contrast, malondialdehyde content significantly decreased by 93.4%. The results indicate that the increased soluble sugar and soluble protein content in hydro-primed seeds greatly enhances seed germination and seed germination rates. On the other hand, the function of the seedling antioxidant system requires further improvement by increasing seedling antioxidase activity and decreasing malondialdehyde content, which significantly enhance seedling drought resistance.
Pinustabulaeformis; hydro-priming; physiological effect; seed germination; drought resistance
国家自然科学基金项目(30970003)
2014- 01- 20;
日期:2015- 04- 14
10.5846/stxb201401200147
*通讯作者Corresponding author.E-mail: zhangcunli529@163.com
贺红娟,管桦,张存莉.水引发对油松种子和幼苗的生理效应及其作用机理.生态学报,2015,35(21):7033- 7042.
He H J,Guan H, Zhang C L.Physiological effects and mechanisms ofPinustabulaeformisseeds and seedlings by hydro-priming.Acta Ecologica Sinica,2015,35(21):7033- 7042.

