ADC值在鉴别血管外皮细胞瘤与脑膜瘤中的应用
李 桥 周碧婧 何慧瑾,2 冯晓源
2 上海市浦东医院放射科
颅内血管外皮细胞瘤(hemangiopericytomas,HPC)是一种罕见的脑膜间质来源肿瘤,占原发性颅内肿瘤的0.4%[1]。HPC可发生于身体任何部位[2],以下肢、腹膜后和头颈部最多见。中枢神经系统HPC被认为具有一定恶性倾向和侵袭性,易原位复发及远处转移[3],因此HPC的临床治疗方法与脑膜瘤尤其是良性脑膜瘤颇为不同,术前准确诊断对于制定合适的治疗方案有着重要意义。
HPC与脑膜瘤在常规影像学上的表现有很多相似点,常规MRI往往难以准确鉴别两者。磁共振弥散加权成像(diffusion weighted imaging,DWI)及表观弥散系数(apparent diffusion coefficient,ADC)目前广泛应用于肿瘤分级及疗效监测[4-5]。而关于ADC在HPC与脑膜瘤鉴别诊断中的价值研究较少,HPC与不同亚型脑膜瘤的ADC值比较鲜有报道。本文通过回顾性分析经手术病理证实的颅内HPC病例的MRI表现,比较HPC与不同亚型脑膜瘤平均ADC(mean ADC,mADC)及 标 化ADC值(normalized ADC,NADC),旨在提高对该病的认识及术前诊断准确性。
方 法
1.临床资料
搜集我院2008年12月到2014年8月期间15例手术病理证实的中枢神经系统血管外皮细胞瘤(29~77岁,平均47.2岁)及126例脑膜瘤进行回顾性研究分析。血管外皮细胞瘤中4例为术后3~6年复发。脑膜瘤中上皮型脑膜瘤(WHO I级)26例(30~69岁,平均49.5岁)、纤维型脑膜瘤(WHO I级)25例(36~70岁,平均52.9岁)、血管瘤型脑膜瘤(WHO I级)19例(32~74岁,平均54.7岁)、砂砾型脑膜瘤(WHO I级)12例(30~66岁,平均53.1岁)、过渡型脑膜瘤(WHO I级)13例(49~65岁,平均59.3岁)、非典型脑膜瘤(WHO II级)21例(33~75岁,平均57.6岁)及间变型脑膜瘤(WHO III级)10例(8~72岁,平均57.5岁)。所有患者均在MRI检查一周内行肿瘤切除术,切除组织送复旦大学附属华山医院神经病理科进行病理诊断。所有切除组织均在福尔马林中固定后行石蜡包埋切片。切片组织行苏木素-伊红染色,S-100,EMA,GFAP,CD34,PR,Vimentin及MIB-1免疫组化染色,根据2007版WHO中枢神经系统肿瘤分类,确定肿瘤类型。
2.MRI检查方法
所有患者使用美国GE公司生产的Signa Horizon3T超导磁共振进行检查。所有患者均行常规MRI检查及增强扫描。扫描参数如下:T1WI(TR/TE,2025ms/15ms),T2WI(TR/TE,3600ms/155ms),FLAIR(TR/TE/TI/NEX,8500ms/120ms/2100ms/1),DWI(TR/TE,4800ms/minimum,b值0和1000s/mm2),矩 阵256×256,层 厚6mm,层 间 隔2cm,FOV 24cm×24cm。注射对比剂后,行横断、矢状面扫描,增强检查所用对比剂为国产钆喷酸葡胺注射液(Gd-DTPA),剂量为0.1mmol/kg。
3.图像处理方法
ADC值由DWI图像通过GE AW 4.6工作站Functool软件计算得到。ADC值测量由一名影像学医师独立完成并遵循盲法测量原则,选取肿瘤三个不同层面,在每个层面肿瘤实性部分选取同等大小感兴趣区(96~104mm2)测量ADC值(分别记为T1、T2、T3),在对侧正常白质(normal-appearing white matter,NAWM)区域选取相同面积感兴趣区测量ADC值(WM),1个月后由同一位影像学医师按照上述方法进行第二次测量,计算两次测量平均值。
4.数据分析
统计学处理应用SPSS 18.0统计分析软件包。利 用 公 式(T1+T2+T3)/WM/3计 算NADC,(T1+T2+T3)/3计算mADC值。脑膜瘤按不同亚型分组,对HPC及不同亚型组的mADC及NADC分别进行独立样本t检验。对脑膜瘤组及HPC组发病年龄分别进行独立样本t检验。对脑膜瘤组及HPC组性别分布进行χ2检验。P<0.05为差异有统计学意义。
结果
1.流行病学特征
本研究中15例HPC患者,平均发病年龄47.2岁,低于脑膜瘤组患者平均发病年龄57.1岁,且两者差值具有统计学差异(P<0.05)。15例HPC中,男女比例为3:2,男性多于女性;而在脑膜瘤组中,女性多于男性,两组男女分布差异具有统计学意义(P<0.05)。
2.影像学特征
本组15例HPC患者,肿瘤最大径线约11.5cm,平均径线(肿瘤最大层面最大径及其垂直径线平均值)5.2cm(表1)。其中12例呈分叶状改变,12例出现囊变区域,8例出现硬脑膜尾征,12例肿瘤内出现流空血管影,7例病灶以窄基底与硬脑膜相连,出现“蘑菇征”。其MRI一般表现为T1等或低或等低混杂信号,T2呈等或高或等高混杂信号,DWI呈稍高或高信号,增强后为明显不均匀强化(图1)。
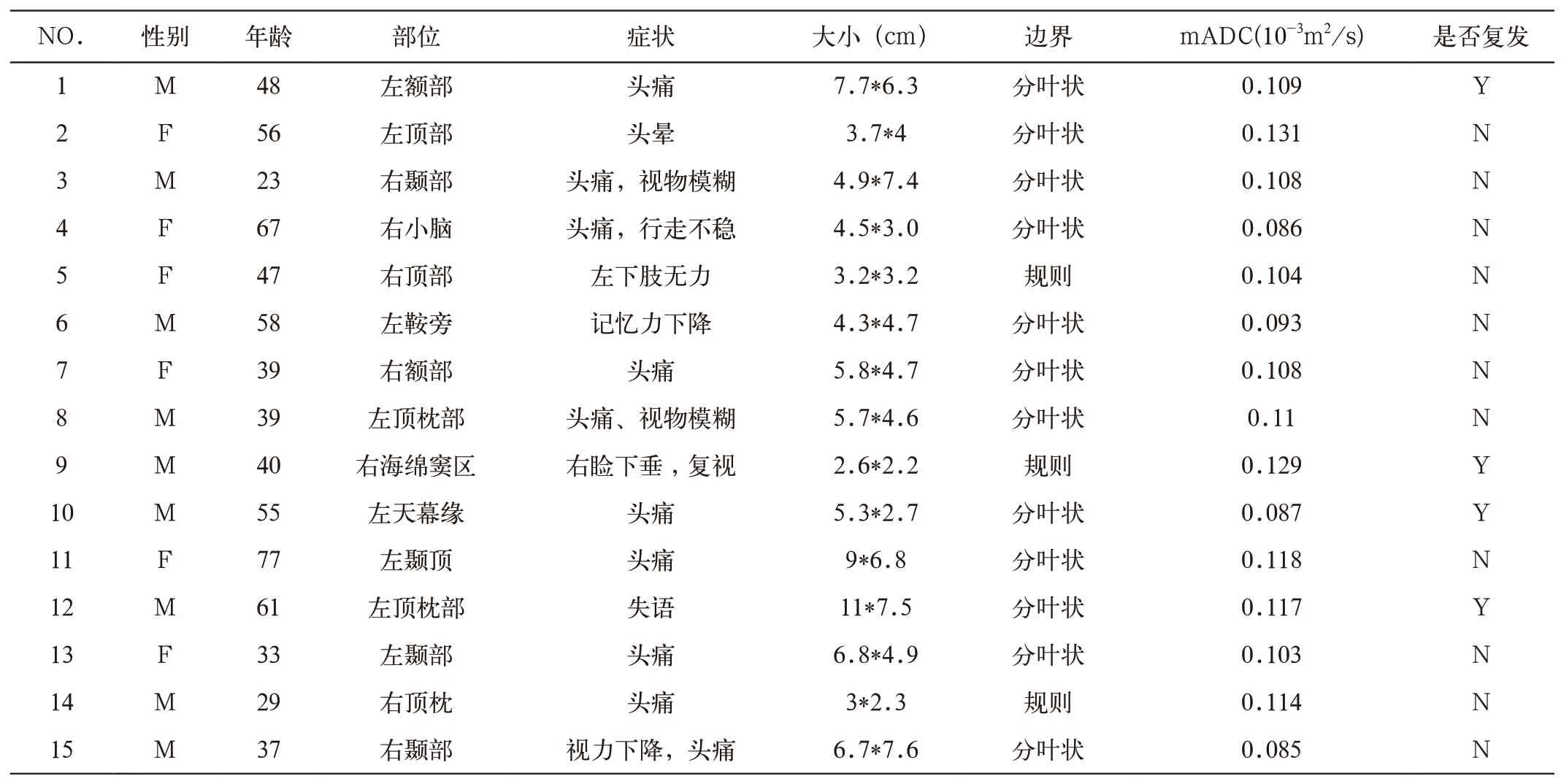
表1 HPC患者临床资料
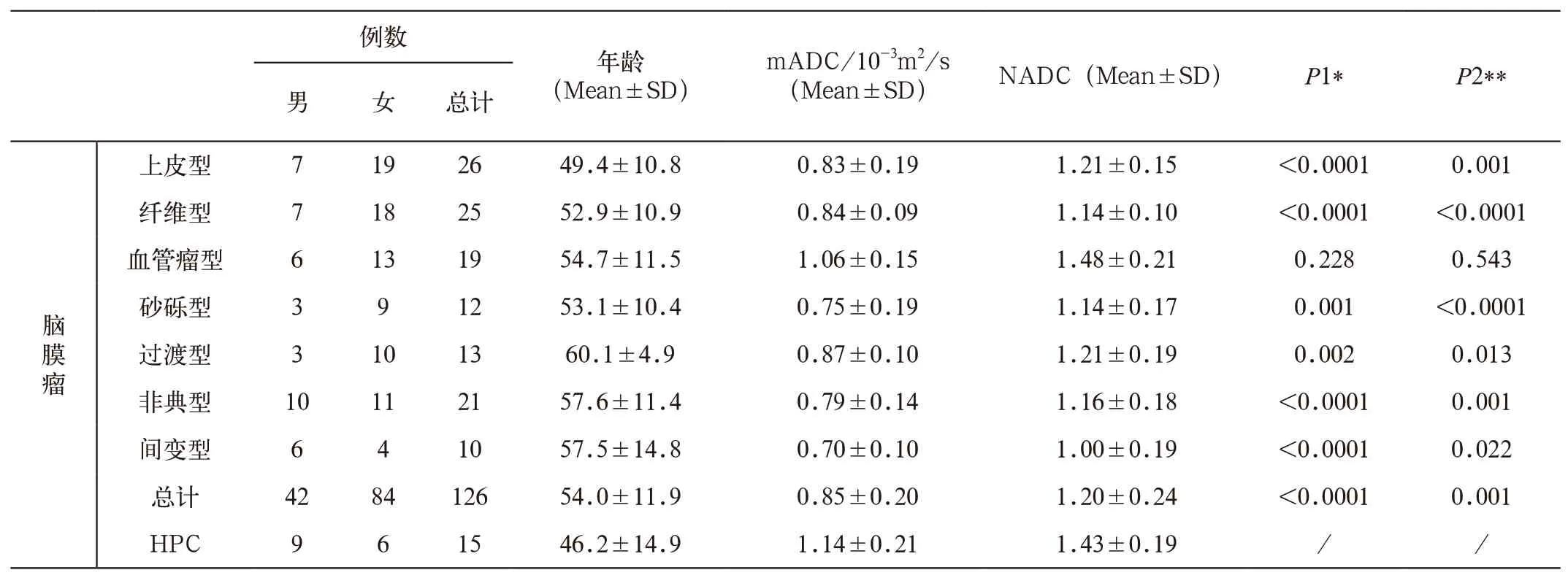
表2 HPC与不同亚型脑膜瘤ADC值比较结果
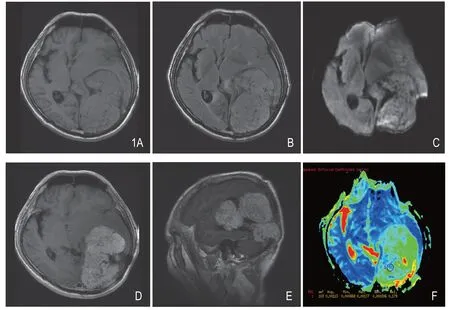
图1 男性,61岁,出现运动性伴感觉性失语3个月,MRI示左顶枕部异常信号占位,T1WI(A)呈等低信号,T2-FLAIR(B)呈稍高信号,DWI(C)呈稍高信号,增强后(D.横断位;E.矢状位)呈不均匀明显强化,瘤内见血管流空影,局部伴有坏死囊变。术后病理证实为血管外皮细胞瘤,WHO II级。ADC图(F)显示肿瘤组织ADC值(1.130×10-3m2/s)明显高于周围组织。
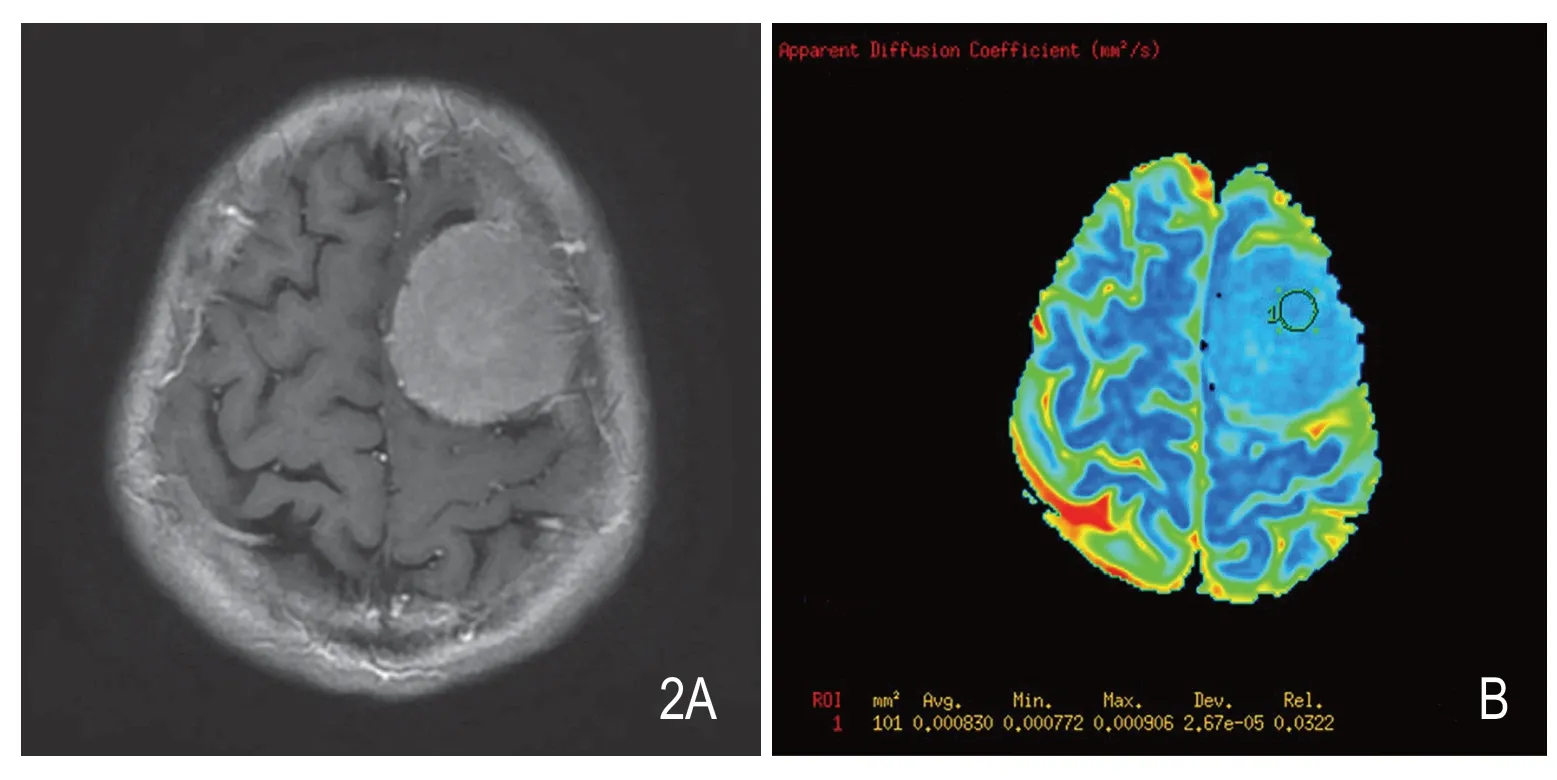
图2 男性,61岁,左额部异常信号占位,增强后(A)呈明显均质强化,ADC图(B)显示肿瘤组织ADC值(0.830×10-3m2/s)略高于周围正常白质。术后病理证实为上皮型脑膜瘤,WHO I级。
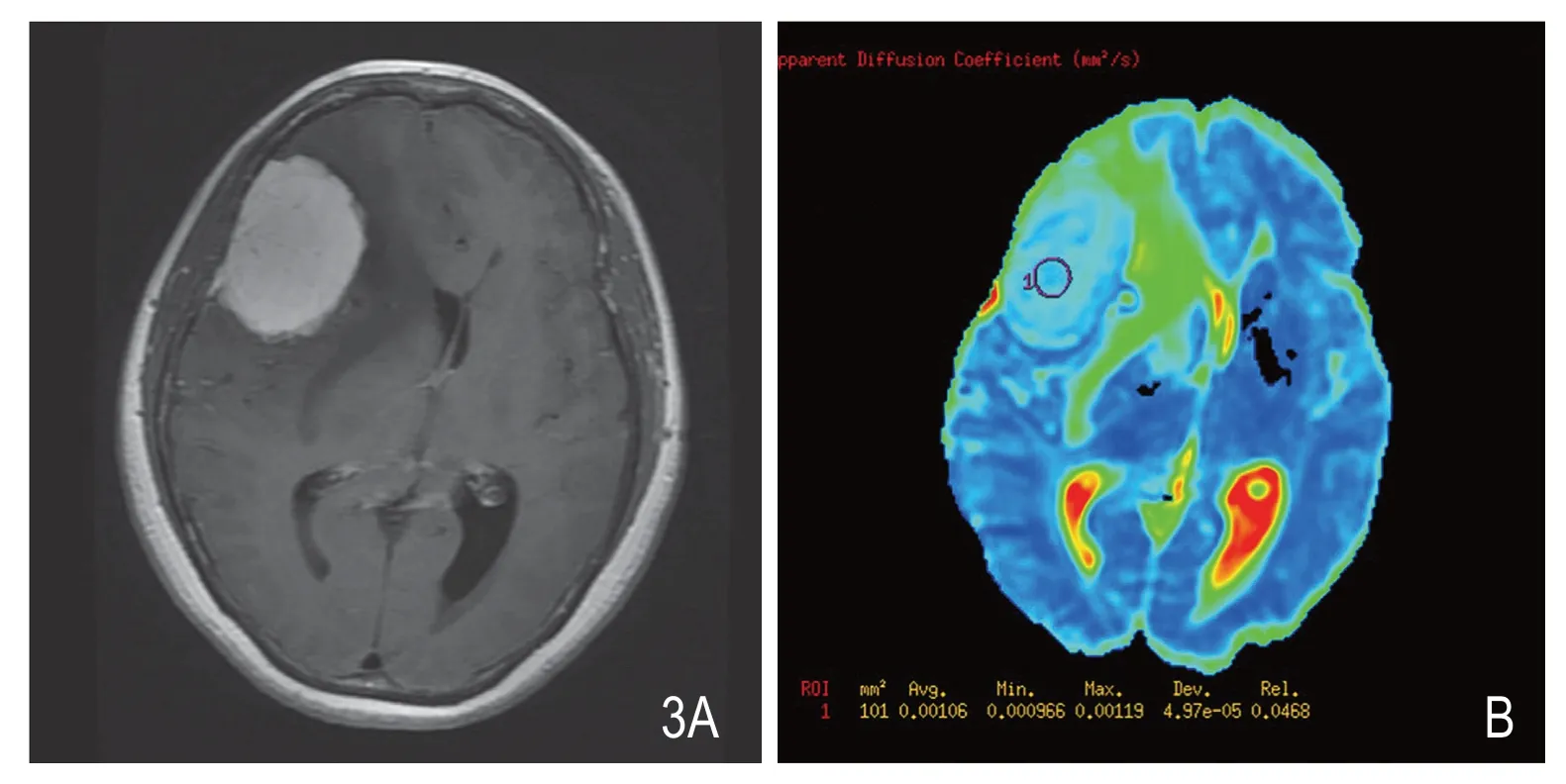
图3 女性,52岁,右额部异常信号占位,增强后(A)呈明显均质强化,肿瘤内可见血管流空影。ADC图(B)显示肿瘤组织ADC值(1.060×10-3m2/s)高于周围正常白质,周围水肿组织ADC值升高更明显。术后病理证实为血管瘤型脑膜瘤,WHO I级。
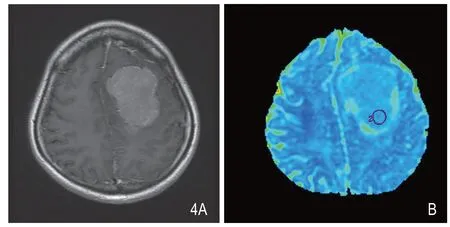
图4 男性,45岁,右额部异常信号占位,增强后(A)呈明显强化,肿瘤局部与正常脑组织分界不清。ADC图(B)显示肿瘤组织ADC值(0.823×10-3m2/s)局部略高于周围正常白质,周围伴有明显水肿。术后病理证实为非典型脑膜瘤,WHO II级。
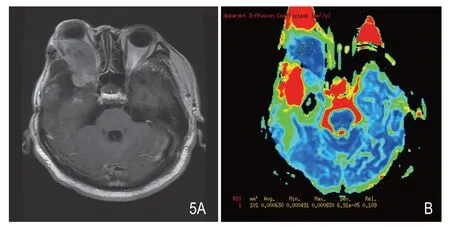
图5 男性,56岁,右眶后部异常信号占位,增强后(A)呈明显不均质强化,肿瘤局部与正常脑组织分界不清。ADC图(B)显示肿瘤组织ADC值(0.630×10-3m2/s)低于周围正常白质。术后病理证实为间变型脑膜瘤,WHO III级。
3.ADC测量结果
本组15例HPC病例mADC值分别高于脑膜瘤各亚型组,其中HPC与上皮型,纤维型,过渡型,砂砾型,非典型型,间变型脑膜瘤mADC的差值分别具有统计学意义(P<0.05),而HPC与血管瘤型脑膜瘤之间的差值无统计差异(P>0.05)。HPC病例NADC分别高于上皮型,纤维型,过渡型,砂砾型,非典型型,间变型脑膜瘤且其差值分别具有统计学意义(P<0.05),而HPC的NADC略低于血管瘤型脑膜瘤,但差值不具有统计学意义(P>0.05)(表2,图1 F,图 2~5)。
讨 论
HPC由Stout和Murray[6]在1942年首次报道。颅内HPC起源于脑膜间质毛细血管壁Zimmerman周细胞,为紧贴毛细血管网状纤维膜排列的梭形细胞,既往被划分为脑膜瘤的一个亚型,根据2007版中枢神经系统肿瘤分类,HPC属于脑膜间质-非脑膜上皮细胞肿瘤。
1.颅内HPC的临床及影像学特点
与脑膜瘤相比,HPC 常好发于男性,平均发病年龄较低。本组患者平均发病年龄为47.2岁,低于脑膜瘤患者;同时男性患者多于女性,与脑膜瘤组也具有显著差异,与文献报道相符[7-9]。HPC首发症状与确诊时间间隔较脑膜瘤短,一般为4个月左右[8-9]。
病理诊断显示HPC血供较丰富,显微镜下可看到肿瘤组织内丰富的裂隙样血管,呈树突状或鹿角样改变。而由于肿瘤生长过快致局部血供不足、瘤内血管破坏等原因,肿瘤内部可呈现出血、坏死、囊变等。HPC的典型MRI表现具有一定特点,通常呈分叶状,丰富的血管流空、肿瘤内密度或信号不均匀、无肿瘤内钙化和骨质增生、局部颅骨呈溶骨性破坏[10-11]。HPC的影像学表现与其病理分级相关[12]。本研究纳入的均为WHO II级肿瘤,因此其影像学特征具有较大一致性。“硬脑膜尾征”是脑膜瘤的特征MRI表现,由于肿瘤组织长期、慢性刺激脑膜组织造成脑膜增厚、血管及纤维母细胞增殖形成,而硬膜尾征除了与肿瘤本身位置有关外,还和硬膜局部受侵状态和血管反应性增生有关[13]。本组HPC中有8例(50%)出现硬脑膜尾征,考虑可能由于肿瘤生长较缓慢造成,可见脑膜尾征在HPC中并非罕见,与既往报道相符。“蘑菇征”是指病灶伸向脑实质,肿瘤组织在颅内侵犯部位的直径明显大于附着在硬膜上基底部,类似“蘑菇状”,病理上为肿瘤向颅内各个不同方向生长,生长速度或遇到的阻力不一致所致,是HPC具有一定恶性程度的间接征象,在恶性脑膜瘤中也可出现[14],为HPC的与良性脑膜瘤的鉴别提供一定价值。
2.ADC值的意义
磁共振弥散加权成像利用水分子的弥散运动特性成像,反映人体组织的微观几何结构以及细胞内外水分子的转运变化。脑组织的表观扩弥散受多种因素影响,包括细胞构成、神经元破坏程度、血管源性水肿、细胞内外间隙比值等。细胞构成是影响颅内肿瘤ADC值的决定因素,水分子在肿瘤组织中的弥散能力与肿瘤的级别相关。多项研究表明,ADC值在判断胶质瘤分级中有着重要的意义,可以鉴别WHO II级与III级、IV级胶质瘤[15-16]。Liu等[7]认为最低ADC值区(Min ADC)代表肿瘤细胞密集点,在HPC和脑膜瘤的鉴别中有一定价值。Li等认为不典型脑膜瘤和HPC的平均ADC值具有统计学差异,但未将其他亚型脑膜瘤与HPC进行比较。由于不同的个体正常白质组织的ADC值存在一定变化[17-18],因此本组研究中同时采用平均ADC值和标化ADC(平均ADC/正常白质ADC)进行比较,其中NADC旨在消除个体组织学差异,保持了较好的均质性。同时由于不同亚型脑膜瘤的病理学差异,本研究将HPC与不同亚型脑膜瘤比较,结果更加具有特异性和针对性。
生物组织中水分子弥散能力与细胞外/细胞内间隙比值相关,与良性肿瘤相比,恶性肿瘤核分裂象增加,坏死明显,胞核较大,细胞体积较小且胞内蛋白数量增多,核质比增高,造成细胞外间隙减少,阻碍水分子弥散,非典型脑膜瘤及间变型脑膜瘤恶性程度较高,因此水分子弥散受限,ADC值明显降低。同时肿瘤内纤维组织也可影响ADC值,纤维型及上皮型脑膜瘤中纤维组织成分较多,因此造成水分子弥散程度降低。本研究发现,非典型脑膜瘤及间变型脑膜瘤的mADC、NADC均低于HPC,其差值具有统计学意义。考虑HPC虽然属于WHO II级肿瘤,但由于肿瘤内富含血管组织,血供丰富,因此弥散受限程度降低。Kang等[19]认为WHO IV级胶质瘤内坏死囊变较多,因此水分子弥散频率增加,影响肿瘤组织ADC值,抵消由细胞密集导致的ADC值减低,最终造成III级与IV级胶质瘤平均ADC值无显著性差异。本研究中15例HPC中12例出现坏死囊变,因此考虑其ADC值增高与坏死区域亦相关,同时MRI无法鉴别病理形态上的微囊变,ROI中可能包含微囊变区域,因此最终影响HPC的ADC值。常规MRI上非典型脑膜瘤及间变型脑膜瘤具有形态不规则、瘤脑界面不清,信号不均匀,多呈明显不均匀强化,肿瘤内多见流空血管影,可出现邻近组织受侵等特点[20-21]。DWI病变多呈高及稍高信号,病变周围水肿及硬膜尾征并无特异性,与HPC较难鉴别,而两类肿瘤的ADC值具有明显差异,因此在鉴别诊断中具有较大意义,我们推断HPC在DWI上呈现的高或稍高信号可能与T2穿透效应(b=0 mm/s)相关,而恶性脑膜瘤DWI高信号与细胞密集、弥散受限有关,两者的DWI高信号成因颇为不同。相较于常规DWI,ADC图能够更加准确反映肿瘤组织的微观构成,颅内HPC的ADC值显著高于恶性脑膜瘤,因此ADC值在HPC与恶性脑膜瘤鉴别中有着重要意义。
此外,本研究显示血管瘤型脑膜瘤与HPC的mADC值、NADC值无显著统计学差异,与既往报道相符,考虑可能与两者肿瘤内均含有丰富的血管组织相关。血管瘤型脑膜瘤在常规MRI上信号较均匀,增强后呈现明显均质强化,同时肿瘤形态较规则,瘤脑界面清晰锐利,凭借上述征象可与HPC相鉴别。
本研究的局限性在于仅利用ADC值对HPC及脑膜瘤进行鉴别。目前多项研究表明,弥散加权成像包括弥散张量成像中部分各向异性(anisotropy,FA),轴向弥散(axial diffusivity,AD)及径向弥散(radial diffusivity,RD)等多个参数都可以为颅内肿瘤的分级及鉴别诊断提供一定的参考价值,可以考虑引入HPC的后续研究中。
总之,颅内HPC的影像学表现不同于脑膜瘤,具有一定的特征性。HPC与除血管瘤型以外的其余6种亚型脑膜瘤的ADC值具有显著性差异。ADC值在HPC与脑膜瘤的鉴别诊断,尤其是与恶性脑膜瘤的鉴别中有着重要的临床意义,可有效提高HPC术前鉴别诊断准确性。
[1]Kleihues PC,Avenee WK.World Health Organization classification of tumours:pathology and genetics of tumours of the nervous system.Lyon:IARC Press,2000:175.
[2]Koch M,Nielsen G P,Yoon S S.Malignant tumors of blood vessels:angiosarcomas,hemangioendotheliomas,and hemangioperictyomas.J Surg Oncol,2008,97:321-329.
[3]Scheithauer B W,Fuller G N,VandenBerg S R.The 2007 WHO classification of tumors of the nervous system:controversies in surgical neuropathology.Brain Pathol,2008,18:307-316.
[4]Perdikakis E,de Bree E,Giannikaki E,et al.Pelvic hemangiopericytoma:the role of diffusion weighted imaging in targeting the biopsy site and in monitoring the tumour response to radiotherapy.Radiol Oncol,2011,45:22-26.
[5]Server A,Graff B A,Josefsen R,et al.Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T.Eur J Radiol,2014,83:e156-e165.
[6]Stout A P,Murray M R.Hemangiopericytoma:A Vascular Tumor Featuring Zimmermann's Pericytes.Ann Surg,1942,116:26-33.
[7]Liu G,Chen Z Y,Ma L,et al.Intracranial hemangiopericytoma:MR imaging findings and diagnostic usefulness of minimum ADC values.J Magn Reson Imaging,2013,38:1146-1151.
[8]Alen J F,Lobato R D,Gomez P A,et al.Intracranial hemangiopericytoma:study of 12 cases.Acta Neurochir,2001,143:575-586.
[9]Fountas K N,Kapsalaki E,Kassam M,et al.Management of intracranial meningeal hemangiopericytomas:outcome and experience.Neurosurg Rev,2006,29:145-153.
[10]张 颉,杜固宏.中枢神经系统血管外皮细胞瘤106例临床分析.中华神经外科杂志,2010,26:935-937.
[11]刘梅丽,韩 彤,刘 力,等.中枢神经系统血管外皮细胞瘤的MRI表现与病理分析.中国医学计算机成像杂志,2007,13(6):389-396.
[12]Mama N,Ben A A,Hasni I,et al.MR imaging of intracranial hemangiopericytomas.J Neuroradiol,2014,41:296-306.
[13]Wallace E W.The dural tail sign.Radiology,2004,233:56-57.
[14]New P F,Hesselink J R,O'Carroll C P,et al.Malignant meningiomas:CT and histologic criteria,including a new CT sign.AJNR,1982,3:267-276.
[15]Server A,Graff B A,Josefsen R,et al.Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T.Eur J Radiol,2014,83:E156-E165.
[16]Kickingereder P,Wiestler B,Sahm F,et al.Primary Central Nervous System Lymphoma and Atypical Glioblastoma:Multiparametric Differentiation by Using Diffusion-,Perfusion-,and Susceptibilityweighted MR Imaging.Radiology,2014,272:843-850.
[17]Liu L,Yin B,Geng D Y,et al.Comparison of ADC values of intracranial hemangiopericytomas and angiomatous and anaplastic meningiomas.J Neuroradiol,2014,41:188-194.
[18]Jurkiewicz E,Grajkowska W,Nowak K,et al.MR imaging,apparent diffusion coefficient and histopathological features of desmoplastic infantile tumors-own experience and review of the literature.Childs Nerv Syst,2014.
[19]Kang Y,Choi S H,Kim Y J,et al.Gliomas:Histogram analysis of apparent diffusion coefficient maps with standard-or high-b-value diffusion-weighted MR imaging--correlation with tumor grade.Radiology,2011,261:882-890.
[20]Tan L A,Boco T,Johnson A K,et al.Magnetic resonance imaging characteristics of typical and atypical/anaplastic meningiomas-Case series and literature review.Br J Neurosurg,2014:1-5.
[21]朱庆强,王中秋,朱文荣,等.非典型脑膜瘤的MRI诊断.放射学实践,2011,26:151-154.

