水分胁迫下内生真菌球毛壳ND35对冬小麦苗期生长和抗旱性的影响
丛国强, 尹成林, 何邦令, 李 玲, 高克祥
山东农业大学植物保护学院, 山东省农业微生物重点实验室, 泰安 271000
水分胁迫下内生真菌球毛壳ND35对冬小麦苗期生长和抗旱性的影响
丛国强, 尹成林, 何邦令, 李 玲, 高克祥*
山东农业大学植物保护学院, 山东省农业微生物重点实验室, 泰安 271000
为明确不同水分条件下内生真菌对冬小麦苗期生长和抗旱性的影响,以抗旱型小麦品种山农16和水分敏感型小麦品种山农22为材料,利用荧光定量PCR技术检测小麦干旱诱导基因脱水素wzy2的表达量来了解冬小麦在干旱胁迫下相关基因的表达差异,通过测定相关生理指标与酶活性来判断小麦发育及其在干旱胁迫下的生理响应状况。结果表明,与正常水分ND35组相比,接种球毛壳菌(Chaetomiumglobosum)ND35的干旱处理组小麦的根冠比、总蛋白含量、脯氨酸含量及丙二醛含量等指标显著提高,小麦叶片含水量和可溶性糖含量有所降低。在干旱处理组中,球毛壳菌ND35可以显著提高小麦山农16的根长和山农22的株高,接种球毛壳ND35的山农16脯氨酸含量、可溶性糖含量、过氧化氢酶活性比对照组均显著提高,丙二醛含量比对照组降低9.0%,但差异不显著;山农22脯氨酸含量和过氧化氢酶活性比对照组显著提高,丙二醛含量和可溶性糖含量比对照组有所降低,但可溶性糖含量差异不显著;相对定量检测数据显示,接种球毛壳ND35后,两种小麦脱水素wzy2基因的表达量较对照组均能够显著提高。综合分析说明内生真菌球毛壳ND35可以促进冬小麦苗期根系和植株发育,小麦提前进入三叶期,增强小麦避旱性,同时提高小麦根系活力,增强小麦耐旱性;提高个体细胞内水分、糖分、脯氨酸含量,降低丙二醛的氧化性损伤,增强过氧化氢酶活性,从而提高两种冬小麦对干旱胁迫的耐受能力;球毛壳ND35促进小麦干旱诱导相关基因wzy2 的表达量,进而提高抗旱相关蛋白的表达,从而提高两种冬小麦耐脱水性和对干旱胁迫的适应性。
小麦; 苗期生长; 内生真菌; 球毛壳ND35; 水分胁迫; 脱水素基因表达
由于淡水资源匮乏和地理分布不均,干旱条件成为植物最常见的逆境条件,也成为制约粮食产量的世界性难题。因此,减轻干旱胁迫对小麦生产的损失成为农业科学研究的热点。科研工作者从内生真菌与植物、土壤等生理生态现象的观察和描述,深入到内生真菌与植物、环境之间作用机理及其互作影响的研究,并取得突破性进展。例如,内生真菌拟茎点霉(Phomopsisorchidophila)能明显提高土壤中纤维素酶和木质素酶活性,加快凋落物纤维素和木质素的降解,协同土壤中的土著微生物群落改善土壤环境,促进养分循环[1]。内生真菌对多年生黑麦草(Loliumperenne)、高羊茅(Festucaarundinacea)等禾草植物抗旱性影响的研究也表明[2-3],内生真菌可以通过促进宿主植物根系发育、叶片生长、气孔开闭、渗透调节和抗氧化保护系统等一系列生理生化反应诱导植物提高对干旱胁迫的抗性[4-6]。但有关内生真菌与植物干旱诱导基因表达及其影响植物干旱胁迫适应性的研究相对较少。
球毛壳菌(Chaetomiumglobosum)ND35菌株作为一个分离于健康毛白杨(Populustomentosa)的内生真菌优势菌株。已有报道证明,球毛壳菌 ND35菌株能够促进植株生长、提高防御酶活性[7-10]。脱水素(Dehydrin)是一种广泛存在于高等植物的干旱诱导蛋白。已有研究表明,植物的抗旱与脱水素的表达量之间有一定的关系[11],wzy2是从小麦中克隆出来的一种脱水素基因,并已成功构建和应用实时荧光定量PCR方法。而且,实时荧光定量PCR技术是一种特异性强、高敏感性的定量检测基因表达的有效方法,此方法在微生物的检测、基因表达研究等方面具有重要的应用价值[12]。本试验采用控制水分质量法模拟不同水分条件,接种内生真菌球毛壳菌ND35,通过测定不同水分条件下小麦植株的形态生理生化指标来明确小麦对干旱胁迫下的生理响应,并在分子水平检测内生真菌影响小麦干旱诱导基因wzy2的表达差异。综合探讨分析内生真菌球毛壳菌ND35对冬小麦植株生长及其对小麦干旱适应性的影响。旨在探讨内生真菌对于促进禾谷类作物植株生长,提高其干旱适应性的作用机制,同时为发掘有益生物资源和推进植物内生菌在宿主体外的应用提供理论依据。
1 材料与方法
1.1 试验材料
试验于2012年10月—2013年7月在山东省农业微生物重点实验室进行。供试小麦品种为抗旱型的山农16[13]和水分敏感型的山农22,栽培基质为过30 目筛的沙土。栽培沙土pH值 7.19,有机质0.46 g/kg,全氮含量0.12 g/kg,全磷含量0.15 g/kg,全钾含量16 g/kg,速效氮11 mg/kg,速效磷24 mg/kg,速效钾为46 mg/kg。种植盆规格30 cm×20 cm×6 cm,每盆装灭菌的沙土2.5 kg,干旱处理盆中营养液比重占土壤最大持水量的30%(栽培沙土总质量2.66 kg),常规处理盆中营养液比重占土壤最大持水量的60%(栽培沙土总质量2.84 kg),充分混匀准备进行小麦苗期培养。营养液根据参考文献[14]改进了配方浓度(表1)。

表1 营养液配方浓度
供试真菌为球毛壳菌ND35菌株,其孢子粉制备方法:将平板培养好已经产孢的球毛壳菌ND35菌株配制成浓度为1.0×106cfu/mL的孢子悬浮液,按10 mL/kg的剂量接种到事先灭菌熟化处理过的麦粒上,在25 ℃下培养15—20 d,晾干后粉碎麦粒得到孢子粉。
采用血球计数板计数孢子含量。取制备好的孢子粉1.0 g,加入100 mL无菌水加以稀释,将盖玻片盖在血球计数板计数室上面,用细口滴管吸取少量充分振荡混匀的菌液,加1滴在盖玻片上,让菌液由盖玻片与计数板的缝隙间渗入计数室,静置片刻,待孢子自然沉降并稳定后开始计数,每次计数做3个重复,取平均值。
1.2 试验方案
将小麦种子在20 ℃保湿催芽后,选择发芽势均匀一致的种子播种于沙土层下1 cm。在种子表面施加浓度为5500 cfu/g的孢子粉0.3 g/粒种子。株距×行距=2 cm×2 cm,共设4个处理:(1)干旱+CK;(2)干旱+ND35;(3)正常+CK;(4)正常+ND35。每个试验处理150株,种植完逐个种植盆编号称重并记录。
水分管理:所有处理组按控制质量法进行管理,每天逐个称重干旱处理组和正常水分处理组中的花盆,加水至与播种时记录的重量恒重,浇水时间在清晨和日落后1 h完成。试验重复两次,第1次于2012年10月17日播种,11月22日采样;第2次于2013年3月7日播种,4月12日采样,室温培养35 d,期间观察小麦生长状况,保存样品进行后续试验检测,其中每个处理取10株小麦液氮速冻,保存于-80 ℃冰箱备用。
1.3 测定项目及方法
1.3.1 小麦苗高、根长及相对含水量的测定
将各处理小麦地上部苗高(cm)和地下部根长(cm)分别编号测量记录,以30 株为1组称量鲜重(g)并编号记录,将小麦植株在105 ℃下杀青1 h,然后在70 ℃下烘干至恒重,称量每组小麦干重(g)、小麦地上部干重(g)和根干重(g),计算小麦鲜重含水量(%)和根冠比。计算公式如下:
根冠比=根干重(g)/地上部干重(g);鲜重含水量(%)= [(Wf-Wd)/Wf]×100%
式中,Wf为鲜重(g);Wd为干重(g)。
1.3.2 小麦生理学特性指标的测定
以下生理学特性指标测定均参照王学奎《植物生理生化实验原理和技术》[14]中的方法。
(1)小麦根系活力测定 采用TTC法,取不同处理小麦根尖0.3 g,放入10 mL烧杯中,加入0.4%TTC溶液和磷酸缓冲液(1/15 mol/L,pH值 7)各5 mL,37 ℃下暗保温1 h,此后加入1 mol/L硫酸 2 mL,终止反应。将根取出,吸干水分,加入乙酸乙酯4 mL,一起在研钵内磨碎以提取甲腙,最后加乙酸乙酯定容到10 mL,于分光光度计485 nm波长下测定。
(2)游离脯氨酸含量的测定 采用酸性茚三酮法,取不同处理的新鲜小麦叶片0.5 g放入具塞试管,加3%磺基水杨酸5 mL,沸水浴中提取10 min。吸取滤液2 mL加入2 mL冰醋酸及2 mL酸性茚三酮,沸水浴显色30 min。冷却后用甲苯萃取,于分光光度计520 nm波长下比色测定。
(3)小麦叶片总蛋白含量测定 采用考马斯亮蓝 G-250 法,取不同处理的新鲜小麦叶片1.0 g放入研钵,加2 mL蒸馏水研磨匀浆,再用5 mL蒸馏水清洗,转移至离心管,25 ℃下放置1 h,然后在4000 r/min离心20 min,上清液转入10 mL容量瓶定容。吸取蛋白质提取液0.1 mL,加入5 mL考马斯亮蓝 G-250 蛋白试剂,放置2 min后在595 nm波长下比色测定。
(4)可溶性糖含量测定 采用苯酚法,取不同处理的小麦叶片0.3 g放入刻度试管,加入5—10 mL蒸馏水,封口后置沸水浴30 min(提取2次),冷却后过滤并定容到25 mL容量瓶。吸取待测液0.5 mL加1.5 mL蒸馏水,按顺序加1 mL 9%苯酚溶液,摇匀后迅速加入5 mL浓硫酸,混匀,在室温下放置30 min,在485 nm波长下比色测定。
(5)丙二醛(MDA)含量测定 采用硫代巴比妥酸(Thiobarbituric acid, TBA)法,取不同处理的小麦叶片0.5 g,加入5%三氯乙酸(TCA)5 mL,研磨后所得匀浆在 3000 r/min下离心10 min。取上清液2 mL,加2 mL 0.67% TBA,混合后在100 ℃水浴锅上煮沸30 min,冷却后离心,分别取上清液在450 nm、532 nm和600 nm处测定吸光度。
(6)过氧化氢酶(CAT)活性测定 采用紫外吸收法,取不同处理的小麦叶片0.5 g,加入3 mL 4 ℃下预冷的pH值 7.8的磷酸缓冲液少量,研磨匀浆,转移至25 mL容量瓶定容,混合均匀后将容量瓶置5℃冰箱中10 min,取上部清液于4000 r/min下离心15 min,上清液即为过氧化氢粗提液。取0.2 mL粗酶液,加入pH值 7.8的磷酸缓冲液1.5 mL和蒸馏水1.0 mL,混合置于25 ℃下预热,逐管加入0.1 mol/L的H2O20.3 mL,立即计时,并迅速倒入比色皿中,在240 nm下测定吸光度,间隔1 min中读数1次,共测定4 min,计算酶活性。
1.3.3 小麦脱水素基因wzy2表达差异相对定量检测
(1)总RNA的提取和反转录的合成
总RNA提取按照Trizol试剂(TransGen)说明书进行,从总RNA中进行逆转录获得cDNA。具体方法按照Fast Quant RT Kit (With gDNase) 进行:在经DEPC处理过的PCR管中加入总RNA 1 μg,5× g DNA buffer 2 μL,10× Fast RT Buffer 2 μL,RT Enzyme Mix 1μL,FQ-RT Primer Mix 2 μL,加入DEPC处理的灭菌水至20 μL体系,混合均匀后,置于42 ℃反转录孵育反应15 min,95 ℃孵育反应3 min,以消除转录酶的活性,反转录后的cDNA贮存于-80℃冰箱。
(2)小麦脱水素基因标准曲线和目的基因的定量
实时定量PCR采用Tiangen公司SuperReal PreMix Plus (SYBR Green)试剂盒。25 μL反应体系包含SuperReal PreMix Plus (2×) 12.5 μL,浓度为10 mmol/L的上、下游引物各0.75 μL,cDNA 2 μL,加灭菌ddH2O至25 μL。反应于Bio-Rad PCR仪(型号i QTM5)上进行聚合酶链式反应(Polymerase chain reaction, PCR)扩增,每个样品做3次平行反应,采用两步法PCR扩增标准程序。反应条件为94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火延伸30 s,循环40次。结束后进行65—95 ℃融解曲线分析,荧光波长为490 nm。
在样品定量PCR扩增的同时,将cDNA样品稀释至原浓度的10-1、10-2、10-3、10-4及10-5,形成5个浓度梯度标准品。采用同样的方法分别以这5个不同的浓度标准品为模板进行定量PCR扩增,制作标准曲线。
各cDNA样品分别以目标基因wzy2引物和内参基因β-actin引物进行定量PCR扩增。引物序列设计参考文献[15],对退火温度做了调整,由 生工生物工程(上海)股份有限公司合成,如表2所示。
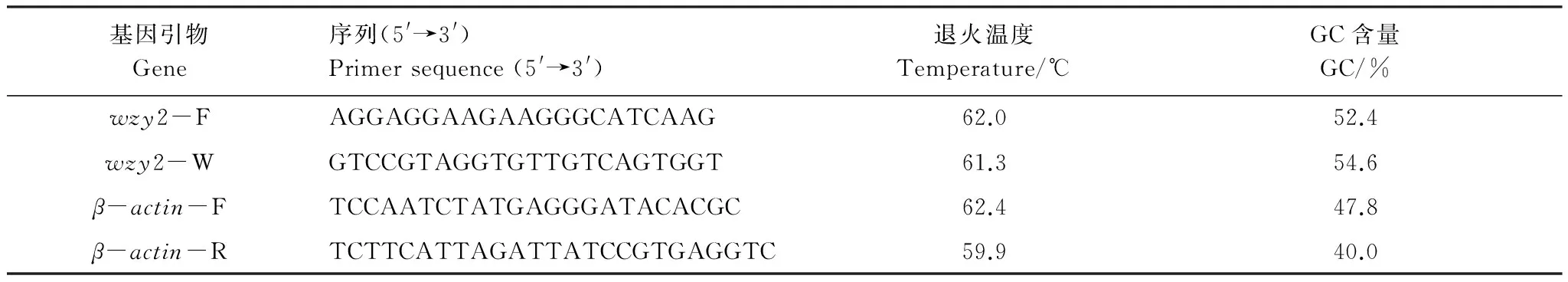
表2 脱水素基因 wzy2序列及内参基因肌动蛋白基因 β-actin引物
(3)荧光定量PCR数据分析方法
用相对定量方法分析PCR扩增结果。根据扩增曲线,在Excel软件上进行相对定量研究和统计分析,确定每个基因在反应管中荧光信号达到设定阈值时所经历的循环数(Ct)。以β-actin为对照基因,校正PCR模板的拷贝数。相对定量采用2-ΔΔCt方法计算[16],即相对倍数(relative quantification)=2-ΔΔCt sample。具体计算公式:
ΔCtsample=Ctsample-Ctactin
ΔΔCtsample= 处理组(ΔCtsample)-对照组(ΔCtsample)
式中,Ct为每个PCR反应管中的荧光信号达到设定的阈值时所经历的循环数;Ctsample为样品中wzy2基因的荧光信号达到设定的阈值时所经历的循环数;Ctactin为样品中β-actin基因的荧光信号达到设定的阈值时所经历的循环数。
1.4 数据处理
用 Excel 2010软件进行数据整理和作图,用DPS数据分析软件进行统计分析,采用 LSD法进行差异显著性检验(α=0.05)。
2 结果与分析
2.1 球毛壳菌ND35对小麦苗期生长及相关指标的影响
与正常水分管理相比,水分胁迫处理使两种小麦苗期苗高、根长均减小,但根冠比明显提高,差异达到显著水平。干旱处理组中,接种球毛壳菌ND35的抗旱型小麦山农16的苗高、根长、根冠比及总蛋白含量分别比对照组提高4.0%、17.5%、7.7%和16.0%,其中根长,根冠比及总蛋白量差异达到显著水平;干旱条件下,接种球毛壳菌ND35的水分敏感型小麦山农22的苗高、根长、总蛋白量差异均达到显著水平,分别比对照组提高15.2%、6.9%、43.2%(表3),根冠比差异未达到显著水平。说明在干旱胁迫条件下,接种球毛壳菌ND35能够促进抗旱型小麦的根系发育,促进水分敏感型小麦的植株生长,均能增加两种小麦的植株蛋白质含量。在正常水分条件下,接种球毛壳菌ND35也能够明显提高两种小麦的根系活力。

表3 不同水分条件下,球毛壳菌ND35对不同小麦品种苗高、根长、根冠比、根系活力和蛋白质含量的影响
2.2 球毛壳菌ND35对小麦抗旱相关生理指标的影响
与正常水分管理相比,干旱条件下的小麦叶片中脯氨酸和丙二醛含量明显增多,差异达到极显著性水平(P<0.01),而可溶性糖和叶片含水量明显降低。在干旱处理组中,球毛壳菌ND35处理的两种小麦脯氨酸含量和叶片含水量与对照组相比均达到差异显著水平(P<0.05),而山农16丙二醛含量与对照相比差异不显著。接种球毛壳菌ND35的山农16的脯氨酸含量、叶片含水量和过氧化氢酶活性分别比对照组提高40.7%、2.7%和124.47%,山农22分别提高46.4%、2.7%和23.02%,而山农16的叶片丙二醛含量相对于对照组降低9.0%,山农22的叶片丙二醛含量降低43.0%。而在正常水分条件下,两种小麦叶片的脯氨酸含量、丙二醛含量及叶片含水量分别与对照组相比差异不显著(表4)。以上结果表明,干旱胁迫条件下,接种球毛壳菌ND35的小麦渗透势比对照组有所提高,叶片含水量相对增加,丙二醛含量降低则说明接种ND35的两种小麦对干旱逆境的过氧化伤害程度降低。

表4 不同水分条件下,球毛壳ND35对不同小麦品种可溶性糖、脯氨酸、丙二醛、叶片含水量和过氧化氢酶活性的影响
2.3 wzy2基因表达差异相对定量分析
2.3.1 wzy2标准曲线的建立

图1 脱水素基因wzy2的定量PCR扩增标准曲线Fig.1 The standard curve of wzy2 quantitative PCR

图2 脱水素基因wzy2的目的片段融解曲线的单峰图Fig.2 The single peak melting curve graph of the wzy2
如图1所示,试验建立的目的基因wzy2的标准曲线是cDNA浓度梯度的lg值对Ct值作图,其相关系数为0.996,接近于1,相关性很好,基本符合相对定量2-ΔΔCt对样品的要求。

图3 脱水素基因wzy2的目的片段荧光定量PCR扩增曲线图 Fig.3 The fluorescence quantitative PCR curve of the amplification fragment of wzy2
2.3.2 引物特异性检验及扩增曲线
从图2、图3可以看出,定量PCR鉴定的目的基因扩增条件、引物设计均符合要求,PCR的产物特异性强,无非特异性片段产生。
2.3.3 干旱条件下,球毛壳菌ND35对苗期不同敏感型小麦脱水素表达量的影响
按照相对定量 2-ΔΔCt方法对山农16,山农22小麦脱水素基因PCR结果转化成表达量,为了直观,将测定的数据制作成柱状图,结果如图4所示。
从图4 RT-PCR结果可以看出,30%土壤相对含水量条件下,ND35处理均能提高两种小麦的脱水素基因wzy2表达量,其中山农16抗旱型小麦脱水基因的表达量是对照组的2.21倍,山农22敏感型小麦的表达量是对照组2.53倍。说明,干旱胁迫条件下,球毛壳菌ND35可以明显提高小麦脱水素wzy2基因的表达量,而且对不同敏感型小麦的作用效果存在差异。

图4 球毛壳ND35对不同小麦品种脱水素基因wzy2表达量的影响Fig.4 Effects of Chaetomium globosum ND35 on expression of wzy2 in different wheat varieties
3 讨论
3.1 球毛壳菌ND35促进小麦根系和植株生长及其对抗旱性的影响
根系作为水分吸收的主要器官,与植物抗旱性的形成具有密切关系。因此,植物的根系生长状况是衡量其抗旱性的重要指标,影响其对土壤水分的吸收和利用[17]。多数研究认为,发达的根系可提高植物吸水效率,增强其抗旱性能,如抗旱性大豆具有较大的根系[18]。Redman等人研究表明,内生菌的定殖促进了水稻的根部生长和发育,影响了植物体内营养在根和芽中的分配,内生菌共生的植物优先将营养分配给根部,而根部的发育则有利于植物对氮素的吸收和利用[19]。此外,叶片相对含水量作为植物抗旱性的关键指标,能够准确说明植株的干旱适应性。过去的研究证明,球毛壳菌ND35对杨树、黄瓜和板栗根系的发育具有明显促进作用[20-21]。本试验结果显示,山农16小麦ND35处理组根系的平均长度、根冠比和植株总蛋白含量相对于对照组更高,山农22小麦ND35处理组平均苗高大于对照组,植株含水量也大于对照组;正常水分条件下,两种小麦的苗高、根长和根系活力比对照组均显著提高,这些数据表明球毛壳菌ND35处理的不同水分敏感型小麦的植株生长和个体对干旱的适应性均强于对照组。此外,球毛壳菌ND35处理的小麦生长效率普遍提高,提前进入三叶期。因此,球毛壳菌ND35促进两种小麦品种根系发育所引起的小麦对水分和养分吸收利用能力的提高,以及个体生长期的提前所引起的小麦避旱能力的提高可能是影响小麦抗旱性的重要原因。
3.2 球毛壳菌ND35对增强小麦抗旱性的影响
干旱条件发生时,土壤水势的降低会迫使植物失水,从而对小麦造成直接或间接伤害。小麦在根部积累渗透胁迫物质可以降低植物细胞水势,达到减少植株失水的目的。比较普遍的调节物质是脯氨酸、可溶性糖、脱落酸及生长调节酶的活性,这些生理指标在植物抵御干旱胁迫、盐害等非生物胁迫方面发挥着重要作用[22]。万里强等研究,抗旱性强的黑麦品种叶片的脯氨酸含量显著增加[23]。一些研究还表明,干旱胁迫条件下,菌根植物具有较高的脯氨酸积累[24]。本试验中,干旱胁迫下的两种小麦叶片脯氨酸含量明显高于正常水分组。一方面,不同小麦品种间脯氨酸含量的变化和品种本身的遗传有关,从而表现出合成脯氨酸的潜力有所不同[25]。另一方面,在不同的遗传条件下,接种球毛壳菌ND35均可以提高小麦的脯氨酸含量。说明在干旱条件下,球毛壳菌ND35可以促进小麦脯氨酸积累,在维持细胞渗透势方面起到积极作用。另外,处理组中的叶片可溶性糖含量及过氧化氢酶活性比对照组均有不同程度的提高。叶片中的可溶性糖能够增强细胞内渗透压,对植株抗旱,抗盐发挥不可替代的作用。过氧化氢酶可以分解过氧化氢,最大限度地减少羟自由基的形成。MDA是细胞膜过氧化的主要产物之一,对膜和细胞中的许多生物功能分子如蛋白质、核酸和酶等均有很强的破坏作用,其含量多少可作为细胞膜过氧化程度的指标之一[26],而本试验中球毛壳菌ND35处理组MDA含量比对照组均有不同程度的降低。以上生理指标表明,在干旱胁迫条件下,处理组小麦的抗旱性比对照组均有不同程度的增强,反映出较高水平的抗旱适应性。
3.3 球毛壳菌ND35提高小麦wzy2基因表达对耐旱性的影响
小麦在生长发育进程中,干旱胁迫能诱导许多基因的表达,来缓解由于干旱所造成小麦机体损伤。这种由于调控因子引起的分子效应可能是植物耐旱机制的关键。随着基因组学、蛋白质组学和微生物分子生物学技术的日趋成熟,关于内生菌提高植物抗性基因表达的报道陆续发布。Sherameti 等研究发现,在干旱胁迫下,接种印度梨形孢(Piriformosporaindica)的拟南芥植株RD29A、ERA1、DREB2A、CBL1等抗逆性相关基因的表达都有不同程度的上调,而在未接菌的植株中的表达相对滞后[27];Sun 等人的研究表明内生菌在甘蓝体内定殖后,会促进甘蓝叶片中抗旱相关基因的表达,并提高抗旱相关蛋白的表达,从而赋予甘蓝更强的抗旱能力[28];Ownley 等人发现内生菌的侵染能增强植物抗病基因的表达[29]。因此,研究相关干旱诱导基因在胁迫条件下其mRNA水平的表达,很大程度上为揭示作物的抗旱机制提供了不可缺少的信息。现有的研究认为脱水素是一种常见的干旱诱导基因,与植物耐脱水性密切相关。一方面,脱水素在植物受到干旱失水时,能够部分代替水分子,保持细胞液处于溶解状态,从而稳定细胞的结构[30];另一方面,脱水素还起到分子伴侣和亲水性溶质作用,在水分胁迫条件下可以稳定蛋白质的结构并保持其功能,所以脱水素基因在干旱胁迫植株中大量表达[31]。本试验结果表明,在干旱胁迫条件下,接种球毛壳菌ND35的两种小麦品种的wzy2基因的表达量较对照组均显著提高。由此说明球毛壳菌ND35可能通过上调干旱诱导基因wzy2的表达量,提高小麦耐脱水性来适应个体对干旱胁迫响应,从而提高小麦的耐旱能力,这也为球毛壳菌ND35提高小麦干旱适应性提供了依据。
综上所述,本试验说明接种球毛壳菌ND35能够促进两种不同水分敏感型小麦的根系和植株发育,协调个体细胞内物质来提高小麦的耐旱和避旱能力,上调干旱诱导基因表达,从而提高个体对干旱胁迫的适应性。具体从3个方面得到验证:(1)球毛壳菌ND35促进小麦根系和植株生长,小麦生长效率提高,提前进入三叶期,增强小麦避旱性,同时提高小麦根系活力,增强小麦耐旱性;(2)球毛壳菌ND35提高小麦细胞内水分,糖分,脯氨酸含量,降低丙二醛造成的细胞膜氧化伤害,增强过氧化氢酶活性,这些对维持和提高小麦正常渗透势,增强小麦耐旱性起到关键作用。(3)通过荧光定量手段检测发现,球毛壳菌ND35会促进小麦脱水素基因wzy2的表达,进而提高抗旱相关蛋白的表达,使小麦获得更强的耐脱水性和抗旱能力。另外,根系作为首先感应水分胁迫的器官,球毛壳菌ND35是否增加根系细胞对干旱胁迫的感应能力,是否增加植物对干旱胁迫信号的传导以及是否对更多品种小麦的抗旱性产生同样的效果,有待深入研究。
[1] Chen Y, Xie X G, Ren C G, Dai C C. Degradation of N-heterocyclic indole by a novel endophytic fungusPhomopsisliquidambari. Bioresource Technology, 2013, 129: 568-574.
[2] Hesse U, Schöberlein W, Wittenmayer L, Förster K, Warnstorff K, Diepenbrock W, Merbach W. Effects ofNeotyphodiumendophytes on growth, reproduction and drought-stress tolerance of threeLoliumperenneL. genotypes. Grass and Forage Science, 2003, 58(4): 407-415.
[3] Elmi A A, West C P, Robbins R T, Kirkpatrick T L. Endophyte effects on reproduction of a root-knot nematode (Meloidogynemarylandi) and osmotic adjustment in tall fescue. Grass and Forage Science, 2000, 55(2): 166-172.
[4] 李飞, 李春杰. 内生真菌对禾草类植物抗旱性的影响. 草业科学, 2006, 23(3): 57-62.
[5] 石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展. 生态学报, 2006, 26(7): 2395-2401.
[6] Swarthout D, Harper E, Judd S, Gonthier D, Shyne R, Stowe T, Bultman T. Measures of leaf-level water-use efficiency in drought stressed endophyte infected and non-infected tall fescue grasses. Environmental and Experimental Botany, 2009, 66(1): 88-93.
[7] 米士伟, 戴杨, 刘晓光, 孟庆果, 高克祥, Mendgen K. 球毛壳 ND35 菌株在宿主植物上的侵染定殖. 植物保护学报, 2011, 38(6): 493-498.
[8] 印敬明, 刘晓光, 万慧, 肖守华, 高克祥, 王庆华. 螺旋毛壳(Chaetomiumspirale)ND35 防病促生作用初探. 莱阳农学院学报: 自然科学版, 2006, 23(4): 272-275.
[9] 孟庆果, 刘晓光, 高克祥, 康振生, 王海清. 球毛壳 ND35 在杨树的定植及对酶活性的影响. 植物保护学报, 2009, 36(1): 91-92.
[10] 米士伟. 球毛壳ND35在宿主植物上的侵染定殖及其菌肥研制初探. [D]. 泰安: 山东农业大学, 2012
[11] 张薇, 胡尚连. 小麦高分子量谷蛋白12亚基基因mRNA的定量分析. 种子, 2006, 25(5): 35-37, 40-40.
[12] Roche J, Hewezi T, Bouniols A, Gentzbittel L. Real-time PCR monitoring of signal transduction related genes involved in water stress tolerance mechanism of sunflower. Plant Physiology and Biochemistry, 2009, 47(2): 139-145.
[13] 刘鹏, 张洪勇, 陈雪燕, 孙敬福, 裴艳婷, 李惠荣, 杨秀凤, 王玮. 抗旱高产小麦新品种—山农16. 麦类作物学报, 2011, 31(2): 388-388.
[14] 王学奎. 植物生理生化实验原理和技术 (第二版). 北京: 高等教育出版社, 2006: 118-281.
[15] 赵鑫, 张林生. 小麦脱水素基因wzy2表达量实时荧光定量PCR方法的建立和应用. 西北植物学报, 2011, 31(5): 1045-1049.
[16] Shi J F, Mao X G, Jing R L, Pang X B, Wang Y G, Chang X P. Gene expression profiles of response to water stress at the jointing stage in wheat. Agricultural Sciences in China, 2010, 9(3): 325-330.
[17] 丁红, 张智猛, 戴良香, 康涛, 慈敦伟, 宋文武. 干旱胁迫对花生根系生长发育和生理特性的影响. 应用生态学报, 2013, 24(6): 1586-1592.
[18] 杨秀红, 吴宗璞, 张国栋. 对肥水条件反应不同的大豆品种根系性状的比较研究. 中国油料作物学报, 2001, 23(3): 23-25.
[19] Redman R S, Kim Y O, Woodward C J D A, Greer C, Espino L, Doty S L, Rodriguez R J. Increased fitness of rice plants to abiotic stress via habitat adapted symbiosis: a strategy for mitigating impacts of climate change. PLoS One, 2011, 6(7): e14823.
[20] Yu X Y, Meng Q G, Ren S D, Liu Z Y, Wang M Y, Gao K X. Effect ofChaetomiumglobosumND35 on plant growth and preliminary study of its biocontrol efficacy. Journal of Anhui Agricultural Sciences, 2009, 37(34): 16900-16902.
[21] 孟庆果. 内生菌球毛壳ND35在寄主植物中的侵染过程及其定殖后对植物的影响与分子检测 [D]. 泰安: 山东农业大学, 2009.
[22] Armengaud P, Thiery L, Buhot N, March G G, Savouré A. Transcriptional regulation of proline biosynthesis inMedicagotruncatulareveals developmental and environmental specific features. Physiologia Plantarum, 2004, 120(3): 442-450.
[23] 万里强, 李向林, 石永红, 何峰, 贾亚雄. PEG胁迫下4个黑麦草品种生理生化指标响应与比较研究. 草业学报, 2010, 19(1): 83-88.
[24] Ruiz-Lozano J M, Azcon R, Gomez M. Effects of arbuscular-mycorrhizalGlomusspecies on drought tolerance: physiological and nutritional plant responses. Applied and Environmental Microbiology, 1995, 61(2): 456-460.
[25] 张述义, 邵嘉鸣, 李新凤, 刘玲玲, 刘慧. 水分胁迫对小麦芽和根中脯氨酸含量及电导率的影响. 干旱地区农业研究, 2013, 31(3): 150-154.
[26] 赵宏伟, 李秋祝, 魏永霞. 不同生育时期干旱对大豆主要生理参数及产量的影响. 大豆科学, 2006, 25(3): 329-332.
[27] Sherameti I, Tripathi S, Varma A, Oelmüller R. The root-colonizing endophytePirifomosporaindicaconfers drought tolerance inArabidopsisby stimulating the expression of drought stress-related genes in leaves. Molecular Plant-Microbe Interactions, 2008, 21(6): 799-807.
[28] Sun C, Johnson J M, Cai D G, Sherameti I, Oelmüller R, Lou B G.Piriformosporaindicaconfers drought tolerance in Chinese cabbage leaves by stimulating antioxidant enzymes, the expression of drought-related genes and the plastid-localized CAS protein. Journal of Plant Physiology, 2010, 167(12): 1009-1017.
[29] Ownley B H, Gwinn K D, Vega F E. Endophytic fungal entomopathogens with activity against plant pathogens: ecology and evolution. BioControl, 2010, 55(1): 113-128.
[30] 王君丹, 胡鸢雷,魏晓, 于鹏之, 车代弟, 林忠平. 脱水素基因转化的矮牵牛对干旱胁迫的反应. 分子植物育种, 2004, 2(3): 369-374.
[31] Dhanaraj A L, Slovin J P, Rowland L J. Isolation of a cDNA clone and characterization of expression of the highly abundant, cold acclimation-associated 14 kDa dehydrin of blueberry. Plant Science, 2005, 168(4): 949-957.
Effect of the endophytic fungusChaetomiumglobosumND35 on the growth and resistance to drought of winter wheat at the seedling stage under water stress
CONG Guoqiang, YIN Chenglin, HE Bangling, LI Ling, GAO Kexiang*
ShandongKeyLaboratoryforAgriculturalMicrobes,CollegeofPlantProtection,ShandongAgriculturalUniversity,Tai′an271000,China
Endophytes are microbes that live in plant tissues without substantively harming them selves.They are ubiquitous in most plant species, latently residing in or actively colonizing the tissues.To clarify the effect of endophytic fungus on the growth and resistance to drought of winter wheat at the seedling stage under different water conditions, two wheat varieties, Shannong No. 16 and Shannong No. 22, were used as test materials. The dehydrinwzy2 belonging to the dehydration-responsive encoding gene was detected to master different expression of winter-wheat-related genes under drought stress by using a fluorescence quantitative PCR technique. The growth and development of plant and physiological responses under drought stress were investigated by measuring the related physiological indicators and enzyme activity. The results showed that, compared with ND35 groups treated with the normal water,ChaetomiumglobosumND35 could significantly improve root-shoot ratio, proline content, protein content, and malondialdehyde (MDA) content of two wheat varieties in the drought group. The water content and soluble sugar content of leaves were reduced slightly in two wheat varieties. In the drought treatment group,C.globosumND35 could promote root growth of Shannong No. 16 and increase the plant height of Shannong No. 22. The proline content, soluble sugar content, and catalase (CAT) activity of Shannong No. 16 treated withC.globosumND35 group were increased more than in the control group, while the MDA was reduced by 9.0%. Proline and CAT activity increased and there was an indistinctive difference in soluble sugar content in Shannong No. 22, while the MDA content was reduced. The relative quantitative expression ofwzy2 gene was examined. The results showed that dehydrin gene expression in the two wheat varieties inoculated withC.globosumND35 was increased significantly, compared with that of the control group. Above all, the endophytic fungusC.globosumND35 could promote seedling root and plant growth, the wheat could develop into three-leaf stage earlier, and resistance to dehydration was enhanced. In addition, wheat root vigor was improved and resistance to drought was increased. The individual water content, sugar content, and proline content in cells were increased, oxidative damage caused by malondialdehyde was reduced, and the activity of catalase was enhanced, thus improving wheat tolerance to drought stress. The expression of related geneswzy2 in quantity was obviously increased in wheat inoculated withC.globosumND35, and then the expression of resistance to drought-related proteins was improved. As a result, resistance and adaptability to drought stress were improved in winter wheat plants.
wheat; seedling growth; endophytic fungus;ChaetomiumglobosumND35; water stress; dehydrin gene expression
国家自然科学基金(30872024); 山东省科技发展计划(2010GNC10911)
2014-01-20;
日期:2014-11-19
10.5846/stxb201401200153
*通讯作者Corresponding author.E-mail: kxgao@sdau.edu.cn
丛国强, 尹成林, 何邦令, 李玲, 高克祥.水分胁迫下内生真菌球毛壳ND35对冬小麦苗期生长和抗旱性的影响.生态学报,2015,35(18):6120-6128.Cong G Q, Yin C L, He B L, Li L, Gao K X.Effect of the endophytic fungusChaetomiumglobosumND35 on the growth and resistance to drought of winter wheat at the seedling stage under water stress.Acta Ecologica Sinica,2015,35(18):6120-6128.

