南亚热带格木、马尾松幼龄人工纯林及其混交林生态系统碳氮储量
罗 达, 史作民, 王卫霞, 刘世荣, 卢立华, 明安刚, 于浩龙
1 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091 2 中国林业科学研究院热带林业实验中心, 凭祥 532600 3 广西友谊关森林生态系统定位观测研究站, 凭祥 532699
南亚热带格木、马尾松幼龄人工纯林及其混交林生态系统碳氮储量
罗 达1, 史作民1, *, 王卫霞1, 刘世荣1, 卢立华2, 3, 明安刚2, 3, 于浩龙2, 3
1 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091 2 中国林业科学研究院热带林业实验中心, 凭祥 532600 3 广西友谊关森林生态系统定位观测研究站, 凭祥 532699
研究比较了南亚热带6年生格木(Erythrophleumfordii)、马尾松(Pinusmassoniana)幼龄人工纯林及马尾松与格木混交林生态系统碳氮储量及其分配特征。结果表明,生态系统总碳储量依次为马尾松-格木混交林(137.75 t/hm2)>格木纯林(134.07 t/hm2)>马尾松纯林(131.10 t/hm2),总氮储量则为格木纯林(10.19 t/hm2)>马尾松-格木混交林(8.68 t/hm2)>马尾松纯林(7.01 t/hm2)。3种人工林生态系统碳氮库空间分布基本一致,绝大部分储存于0—100 cm土壤层,平均占生态系统总储量的81.49%和96.91%,其次为乔木层(分别占17.52%和2.69%),林下植被和凋落物层所占比例最小。林地土壤碳主要集中于表土层,其中0—30 cm土层平均碳储量为52.52 t/hm2,占土壤总碳储量(0—100 cm)的47.99%,土壤氮的分布则无明显规律。相比于纯林,与固氮树种混交的营林方式表现出更大的碳储存能力。3种幼龄人工林生态系统较低的地上与地下部分碳氮分配比,表明其仍具有较强的碳氮固持潜力。
碳氮储量; 幼龄林; 固氮树种; 人工林经营; 南亚热带
森林生态系统对二氧化碳的固持作用被认为是恢复自然生态系统碳平衡,减缓全球气候变暖趋势的一个重要机制[1]。然而,森林碳库大小与碳固持能力因林分年龄、树种组成、土壤类型、气候条件及经营管理方式而异[2-3]。在长期的生产经营过程中,通过造林、再造林和人工林经营管理提高森林生态系统的碳固持能力已被人们广泛的接受[4]。
人工林正逐步成为世界森林资源的关键组分,并在整个森林可持续经营管理过程中发挥着重要作用。多目标经营的人工林能降低天然林日益减少带给人类的压力,补偿部分本由天然林所提供的生态系统服务功能,并能通过有效的碳固存来缓解全球气候变化[5]。在我国亚热带地区,造林、再造林已成为商业林生产的重要手段。然而,随着大规模、持续的单一人工针叶林(如马尾松(Pinusmassoniana)和杉木(Cunninghamialanceolata)等)或桉树(Eucalyptussp.)等外来树种短周期工业用材林的发展,造成了我国人工林存在的诸如生物多样性丧失,土壤肥力退化,生态系统稳定性降低等问题[6]。因此,许多不同功能型的树种(如乡土珍贵阔叶树种和固氮树种等)被用于人工林的营建[7]。前人研究表明,与固氮树种混交可实现诸如加快土壤养分循环速率[8-9],改善土壤肥力[10],提高林分生产力[11-12]和碳储量[13-14]的目的。Johnson[15]的研究也证实固氮树种的引入显著提高了土壤的碳储存能力。
目前,有关不同人工林生态系统碳氮储量的研究国内外已有较多报道[16-19]。然而,这些报道大多是基于不同林分、不同林龄或不同经营管理方式而开展,如王卫霞等[16]研究了广西热林中心白云实验林场平均林龄为32a的格木(Erythrophleumfordii)、红锥(Castanopsishystrix)和马尾松3种人工纯林生态系统平均碳氮储量及其空间分布特征;不同林龄的长白落叶松(Larixolgensis)和不同林龄的红椎人工林乔木层、土壤层和生态系统碳储量均随着林龄的增长而持续增加[17-18];樟树(Cinnamomumcamphor)人工林林下植被抚育增加了植被碳储量,但降低了土壤和生态系统总碳储量[19]。然而,对固氮树种营建幼龄人工纯林和混交林后,其生态系统碳氮储量及其分配特征的研究却相对缺乏。为此,本文以南亚热带具有相同经营历史与立地条件的3种不同类型人工林生态系统(格木纯林,马尾松-格木混交林,马尾松纯林)为对象,研究比较不同经营模式下人工林生态系统的碳氮储量及其分配特点,旨在为该地区人工林经营过程中如何提高生产力和碳氮固持能力的树种选择与经营方式提供科学参考。
1 研究地点与方法
1.1 研究区概况
研究地点位于广西西南边陲的中国林业科学研究院热带林业实验中心大青山实验场(22°10′ N,106°42′ E),地处南亚热带季风气候区的西南部,属湿润半湿润气候。境内光照、水热资源丰富,干湿季节明显。年均气温20.5—21.7 ℃,极端高温40.3 ℃,极端低温-1.5 ℃;≥10 ℃活动积温6000—7600 ℃。年均降雨量1200—1500 mm,年蒸发量1261—1388 mm,相对湿度80%—84%。地貌类型以低山丘陵为主,坡度25°左右。土壤为砖红壤性红壤,土层深100 cm,腐殖质厚1 cm[20]。
选择该区域2006年营建的格木纯林、马尾松纯林及马尾松与格木混交林生态系统为研究对象。格木、马尾松均为该区域主要的造林、再造林树种,且格木为该地区主要的乡土固氮珍贵阔叶树种,可通过自身固氮根瘤将大气氮转化为可利用含氮化合物。研究区造林地均为马尾松采伐迹地,立地条件基本一致。混交林为隔行隔株混交,即一行马尾松、一行马尾松与格木隔株种植,混交比例为3∶1,长方形配置。格木林林下草本以海金沙(Lygodiumjaponicum)、五节芒(Miscanthusfloridulus)和铁芒萁(Dicranopterisdichotoma)为优势种,极少见灌木,林下植被总盖度为25%;马尾松与格木的混交林林下草本以海金沙、蔓生莠竹(Microstegiumvagans)和弓果黍(Cyrtococcumpatens)为优势种,灌木优势种为杜茎山(Maesajaponica),灌木草本总盖度为80%;马尾松林林下草本优势种为蔓生莠竹、弓果黍和淡竹叶(Lophatherumgracile),灌木优势种为杜茎山,灌木草本总盖度为85%。试验林分基本情况见表1。
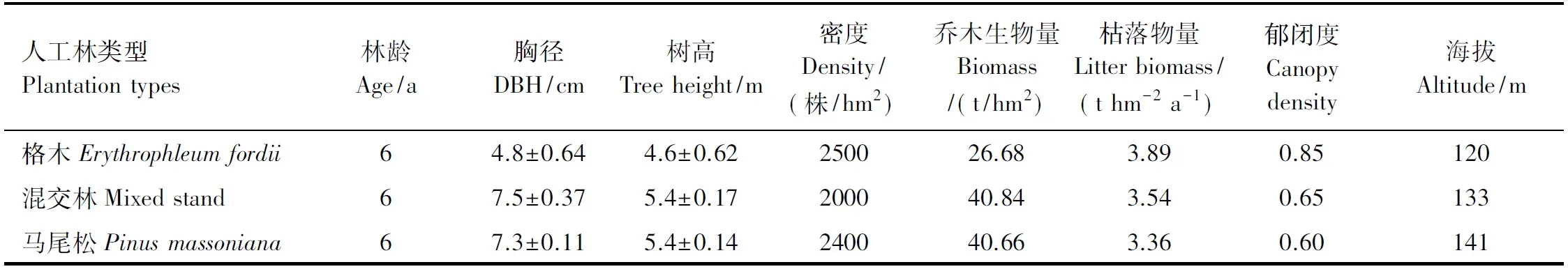
表1 研究样地林分基本情况
1.2 研究方法
1.2.1 标准地设置
按坡位上、中、下于每种林分内分别设置5个大小为20 m × 20 m的样方。在每个20 m × 20 m样方中按对角线方向设置5个2 m × 2 m的小样方用于林下灌木生物量的调查,同样的方法设置1 m × 1 m的草本和枯落物生物量小样方各5个。
1.2.2 乔木、灌木、草本及枯落物生物量测定
对标准地内格木进行每木检尺,根据每木检尺结果,按径级选取26株标准木(样方外)进行生物量测定。标准木伐倒后,地上部分分别测定树叶、树枝和树皮鲜重,树干以2 m为区分段,分段测定鲜重,地下部分采用“全挖法”测定树根鲜质量[16]。同时,按不同器官采集伐倒木各器官的分析样品,实验室80 ℃下烘干至恒重,测定含水率并按器官计算干重。最终根据标准木的各器官干重生物量实测数据,建立格木各器官生物量方程(表2)。马尾松则根据张仕光等[21]所建立的生物量预测模型直接估算各器官生物量。
采用“收获法”实测小样方中灌木和草本地上、地下两部分及枯落物现存量鲜重,并取混合样,实验室烘干计算含水率和干重。
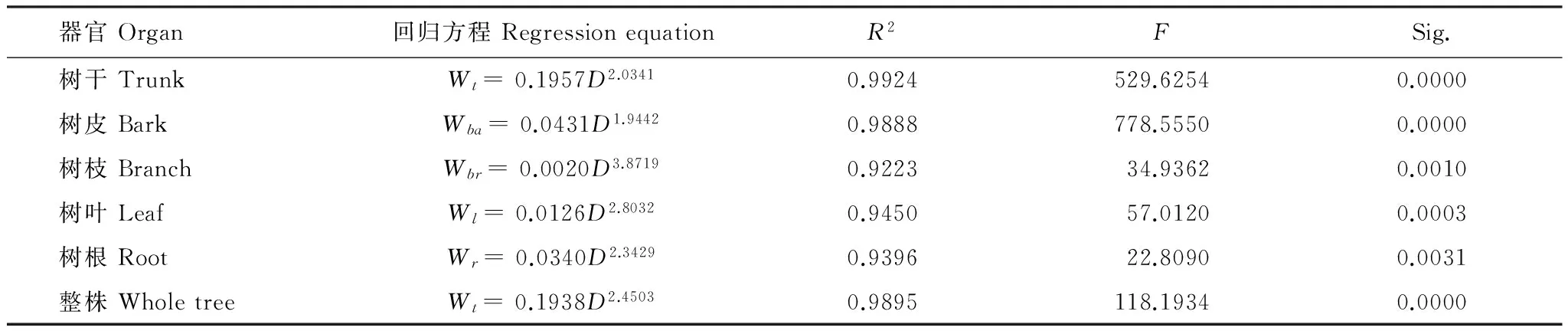
表2 格木人工林单株生物量回归方程
1.2.3 样品采集与分析
在设置的每个20 m × 20 m样方内随机选取5个土壤剖面,沿剖面按0—10 cm、10—30 cm、30—50 cm、50—75 cm和75—100 cm将土壤分为5层,100 cm3的环刀取样,105 ℃下烘干至恒重测定各层土壤容重。此外,取各层土壤混合样和林下植被及枯落物各组分混合样,土样去根系与粗石,风干、磨碎过100目筛;植物样品80 ℃下烘干、粉碎过60目筛。
所有土壤和植物样品的有机碳含量均采用重铬酸钾氧化外加热法测定;全氮含量采用凯氏定氮法测定[22]。格木和马尾松乔木各器官碳氮含量直接引用王卫霞等[16]的分析结果。
1.2.4 碳氮储量计算
植被层各组分(包括乔木、灌木、草本和枯落物)碳氮储量由各自碳氮含量与干重生物量之积计算而得。
土壤总有机碳和总氮储量计算公式如下[23]:
(1)
(2)
式中,TC和TN分别为总有机碳和总氮储量(t/hm2);Ci和Ni分别为第i层土壤有机碳和氮含量(g/kg);Li为第i层土壤厚度(cm);BDi为第i层土壤容重(g/cm3);0.1为单位转换系数。
人工林生态系统碳氮储量根据植被层各组分与土壤各层碳氮储量之和计算。
1.2.5 数据处理分析
采用单因素方差分析(one-way ANOVA)检验不同人工林各组分碳氮含量和储量间的差异性,并用最小显著差异法(LSD)进行多重比较。所有方差分析均在统计分析软件SPSS 16.0中进行,显著性差异均在P0.05水平。
2 结果与分析
2.1 人工林生态系统植被层碳氮储量及空间分布
根据植被层各组分碳氮含量计算出各人工林生态系统植被层各组分有机碳氮储量(表3)。格木纯林植被层有机碳储量为18.25 t/hm2,显著低于马尾松-格木混交林(27.99 t/hm2)和马尾松纯林(28.31 t/hm2)(P<0.05)。格木纯林植被层氮储量(0.35 t/hm2)则明显高于马尾松混交林(0.26 t/hm2)和马尾松纯林(0.19 t/hm2)(P<0.05)(表3)。
格木、混交林和马尾松林乔木层碳储量分别为17.61、26.26 t/hm2和26.69 t/hm2;氮储量则分别为0.33、0.22 t/hm2和0.15 t/hm2。格木人工林林下灌草碳氮储量分别为0.253 t/hm2和0.009 t/hm2,明显低于马尾松-格木混交林(分别为1.177 t/hm2和0.029 t/hm2)和马尾松纯林(分别为1.219 t/hm2和0.031 t/hm2)(P<0.05)。3种人工林枯落物层碳储量无显著差异,而氮储量则是格木人工林(0.016 t/hm2)明显高于马尾松混交林(0.011 t/hm2)和马尾松纯林(0.008 t/hm2)(P<0.05)(表3)。
3种人工林植被层各组分空间分配格局表明,植被层碳储量主要集中在乔木层,占植被层总储量的95.2%,林下灌草和枯落物碳储量所占比例非常小,二者总量约为植被层总储量的5.0%。乔木各器官中,树干作为主体部分,占乔木层碳储量的54.04%,其次为树根(16.61%),其他部分(树叶、树枝和树皮)占29.35%。植被层氮储量同样主要集中在乔木层,占植被层总储量的85.6%。乔木层各器官氮储量的分布与碳储量有所不同,树叶占主要部分(占乔木层的37.7%—42.5%),树干、树根、树枝和树皮所占比例相当。
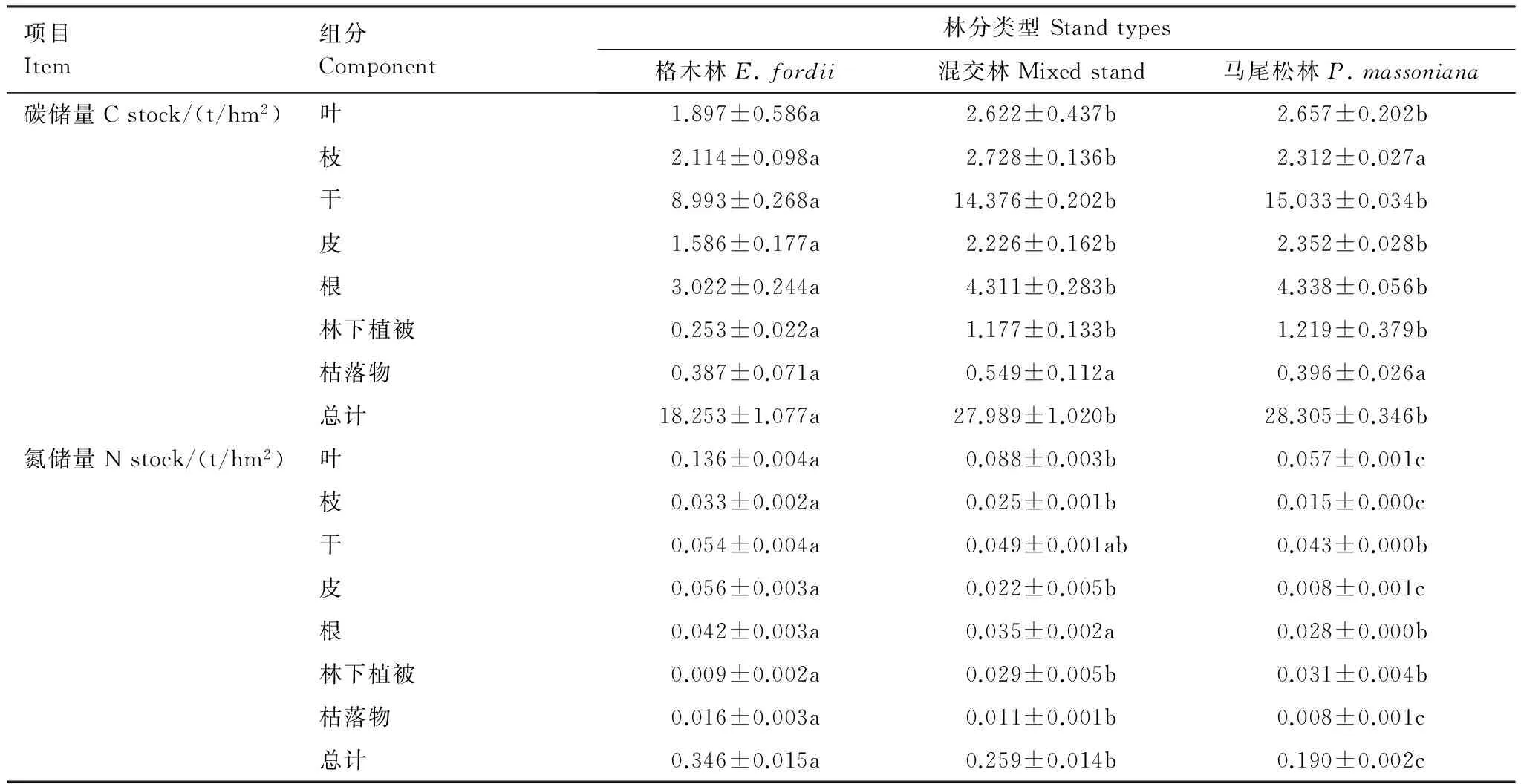
表3 不同人工林植被层碳氮储量
2.2 人工林生态系统土壤层碳氮储量及空间分布
2.2.1 土壤层碳氮含量
不同林分土壤各层碳氮含量分析结果见表4。从3种林分看,土壤各层有机碳和氮含量依次均为格木纯林>混交林>马尾松纯林。方差分析结果表明,固氮树种格木纯林和非固氮树种马尾松纯林土壤氮含量差异显著(P<0.05);而3种人工林土壤有机碳含量差异不显著。
从林分各层土壤有机碳和氮含量看,0—10 cm表层土壤碳氮平均含量均最高,分别为17.84 g/kg和1.06 g/kg,明显高于其它各层(P<0.05),并呈现随土层深度增加含量明显降低的规律(表4)。
2.2.2 土壤层碳氮储量及分配格局
根据土壤各层碳氮含量计算出各人工林生态系统土壤各层和总碳氮储量(表5)。不同人工林中,土壤各层有机碳储量差异不显著,氮储量则为格木纯林显著高于马尾松纯林(P<0.05)。格木纯林0—100 cm土壤有机碳和氮储量分别为115.82 t/hm2和9.84 t/hm2,高于马尾松-格木混交林(分别为109.76 t/hm2和8.42 t/hm2),显著高于马尾松纯林(分别为102.79 t/hm2和6.82 t/hm2)(P<0.05)(表5)。
3种人工林土壤碳储量的空间分布基本一致,均随土层深度增加而降低。格木、混交林和马尾松林林地0—10 cm土壤碳储量分别占土壤总碳储量(0—100 cm)的19.21%、18.60%和19.04%,0—30 cm土壤碳储量分别为55.43、52.37 t/hm2和49.76 t/hm2,占土壤总碳储量的47.86%、47.71%和48.41%,对土壤碳储量的贡献最大。土壤氮的空间分布则无明显规律,格木、混交林和马尾松林林地0—30 cm土壤氮储量分别占土壤总氮储量的38.72%、37.77%和40.03%(表5)。
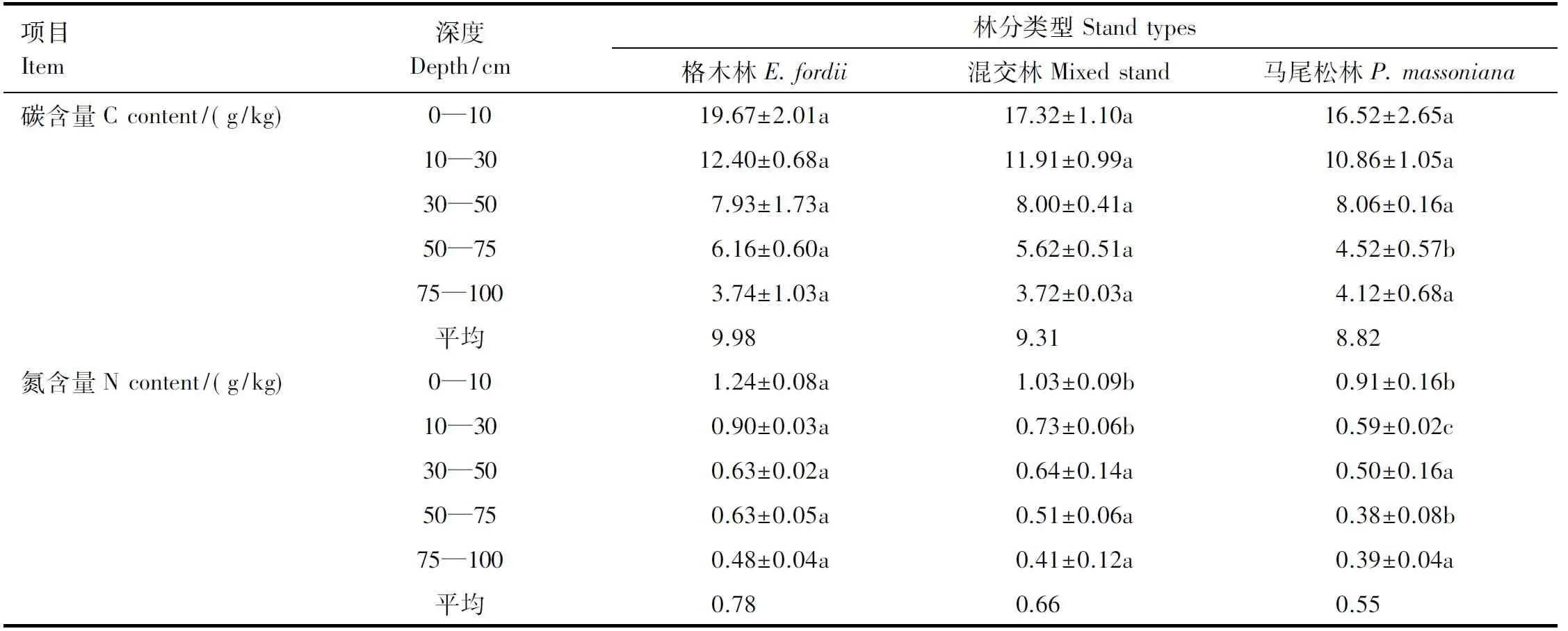
表4 不同人工林土壤碳氮含量
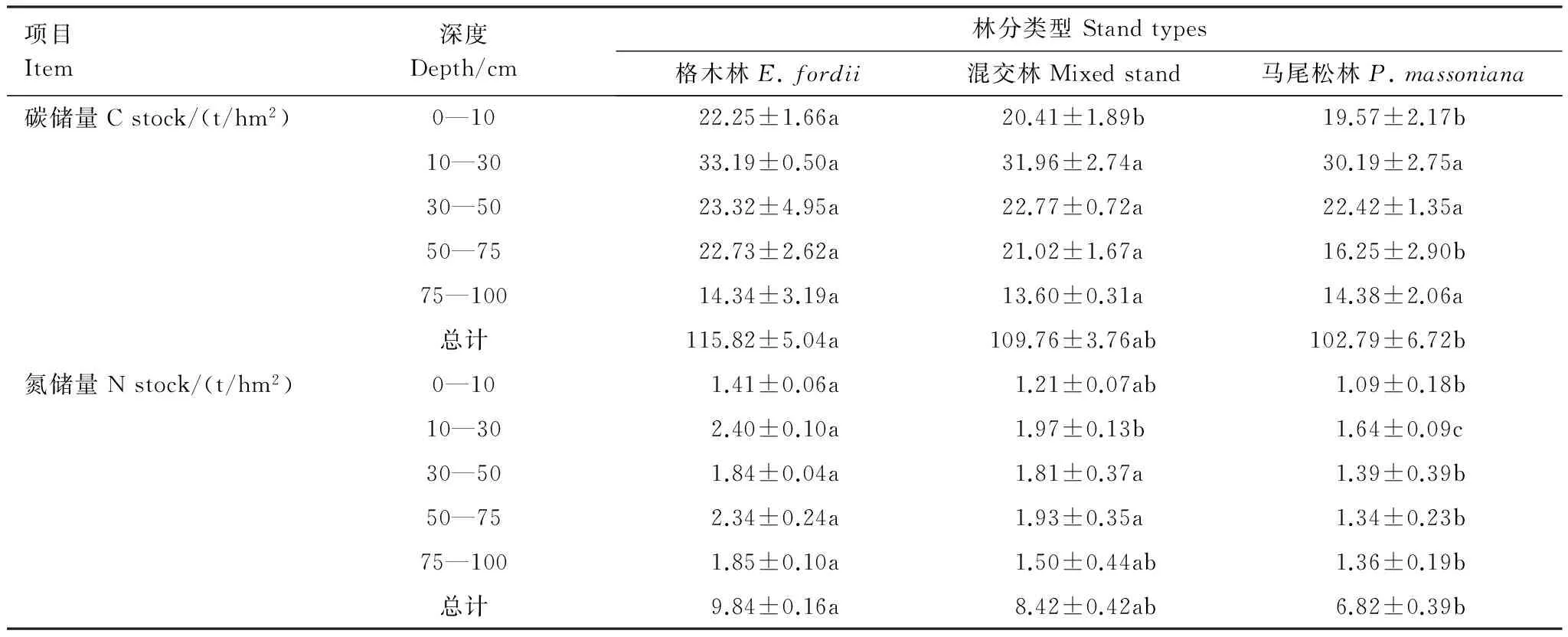
表5 不同人工林土壤碳氮储量
2.3 人工林生态系统碳氮储量及空间分布格局
根据3种人工林植被层和土壤层碳氮储量计算得出人工林生态系统总碳氮储量。结果表明,马尾松-格木混交林生态系统总碳储量最高,达到137.75 t/hm2,比格木纯林(134.07 t/hm2)增加了2.67%,与马尾松纯林(131.10 t/hm2)相比则提高了4.83%。生态系统全氮储量则为固氮树种格木纯林高于混交林和马尾松纯林,具体表现为格木纯林(10.19 t/hm2)>马尾松-格木混交林(8.68 t/hm2)>马尾松纯林(7.01 t/hm2)。
3种人工林生态系统总有机碳与全氮储量的空间分布格局基本相似,绝大部分集中于0—100 cm土壤层,格木纯林、混交林和马尾松纯林平均土壤碳氮储量分别占生态系统总储量的81.49%和96.91%,其次为乔木层(分别为17.52%和2.69%),林下植被和枯落物层所占比例最小(表6)。
3 讨论
森林植被碳氮储量受众多因素影响,如生物量、碳氮含量和树种生物学特性等[24]。本研究中,马尾松纯林和格木-马尾松混交林乔木层碳储量显著高于格木纯林(表3),主要因不同林分的乔木层生物量差异而引起。与非速生树种格木相比,速生树种马尾松生长快,同等时间内积累的生物量更多,碳储量也越高。在绝大多数森林生态系统中,土壤氮素通常作为一种限制营养元素而存在[25],其有效性直接影响森林生态系统的生产力[26-27]。固氮树种格木可改善土壤氮素有效性,促进自身与其他植物生长(混交林和纯林中马尾松的平均胸径分别为7.5 cm和7.3 cm)(表1),间接提高了乔木层生物量和碳储量。格木人工林乔木层氮储量显著高于马尾松纯林和混交林(表3),主要与树种生物学特性有关。固氮树种格木可有效提高各器官氮素含量,因而具有更高的乔木层氮储量。
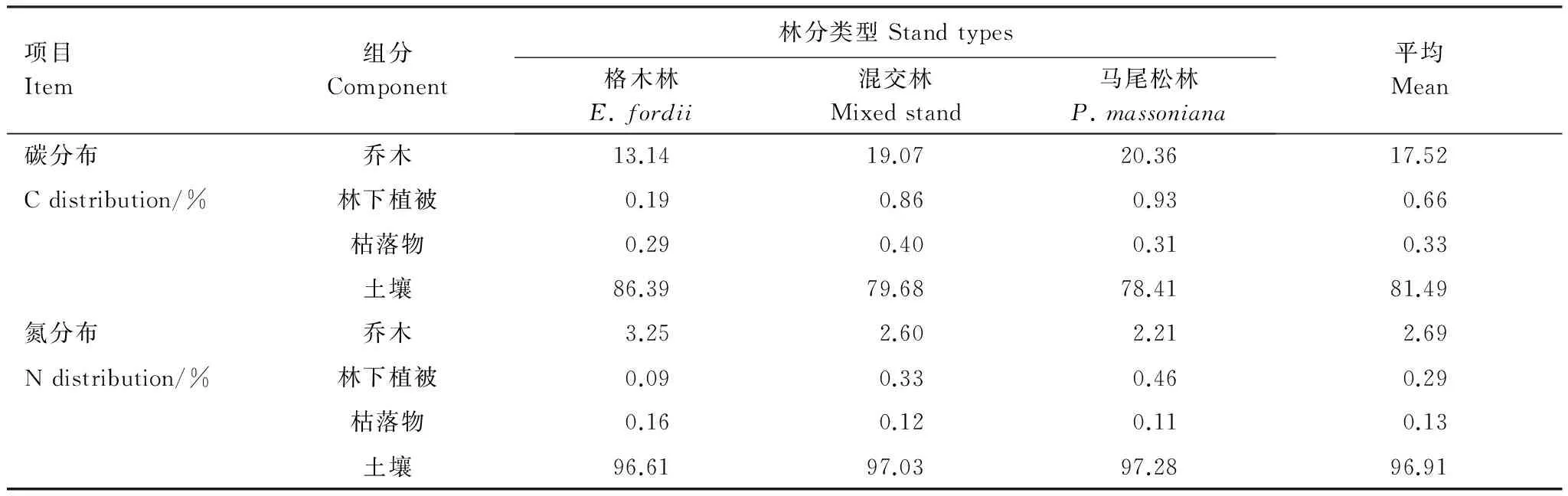
表6 3种人工林生态系统碳氮分布格局
3种人工林林下植被碳氮储量高低不同,这种差异可归结于不同树种的生物学特性以及各自林下的微环境特征。阔叶格木林郁闭度高(表1),极少有光照到达林下,灌木和草本稀疏(盖度25%),生物量低。针叶马尾松纯林和混交林则林冠开阔(表1),阳光可直达林下层,林下灌木和草本植被丰富(盖度大于80%),生物量高。因而格木人工林林下植被碳氮储量显著低于马尾松纯林和混交林。3种人工林地表枯落物层碳储量无显著差异,而氮储量则是格木人工林明显高于马尾松混交林和纯林(表3),主要原因在于阔叶固氮树种格木林下枯落物生物量大(表1)、氮含量高,因而氮储量也越高。
林地土壤碳主要集中在0—30 cm土层,并随深度增加而降低,氮储量的分布则无明显规律,表明土壤深度对土壤碳氮储量有较大影响[24]。森林土壤有机碳和氮储量主要受动植物残体、凋落物与根系周转、土壤养分、树种与微生物组成等多种因素影响,但归根结底取决于碳、氮素的输入与输出量的相对大小[28]。前人研究表明,有机碳的输入量主要取决于有机残体归还量的多少及腐殖化系数,而氮素的输入量则主要依赖于植物残体的归还量及生物固氮作用[29]。本研究中,不同人工林树种生物学特性和土壤养分状况的差异是造成格木人工林土壤有机碳和氮储量(0—100 cm)显著高于马尾松林的主要原因。阔叶格木输送到林地的枯落物量多(表1),加上固氮作用可促进器官氮素的积累,高氮条件下(低C/N比),基质质量较优的枯落物分解较快[13],其输入到土壤中的有机质和氮高于马尾松。格木人工林土壤具有较高的氮素有效性,土壤肥力较高,相对肥沃的土壤形成的有机矿质复合体能借助物理机制保护来源于分解过程进入土壤中的有机质,从而储存更多的有机碳和氮[30-31]。尽管格木人工林林下凋落物碳储量低于格木-马尾松混交林(表3),但格木凋落叶和细根分解速率快于马尾松(格木凋落叶和细根分解系数分别为0.98 a-1和0.65 a-1,马尾松凋落叶和细根分解系数分别为0.62 a-1和0.47 a-1[32],而格木-马尾松混交林中土壤有机质的来源主要为马尾松凋落叶和细根分解(格木与马尾松混交比为1∶3),较慢有机质输入使得格木-马尾松混交林土壤碳储量低于格木人工林。
本研究中,3种人工林乔木层平均碳储量低于江汉平原同龄杨树(Populussp.)人工林乔木层碳储量(28.32 t/hm2)[33],碳氮储量均明显高于川西地区同龄岷江柏(Cupressuschengiana)人工林乔木层碳储量(0.70 t/hm2)和氮储量(0.01 t/hm2)。3种人工林0—100 cm土壤层平均碳储量均高于黄土丘陵区9生年和17年生刺槐(Robiniapseudoacacia)人工林相同深度土壤层碳储量(分别为55.2 t/hm2和65.7 t/hm2)[34],高于中国科学院会同森林生态试验站22年生杉木、火力楠(Micheliamacclurei)人工纯林及其混交林相同深度土壤层碳储量(分别为90.21、100.59 t/hm2和104.85 t/hm2)[35],低于广西热林中心白云实验林场32年生格木、红椎、马尾松3种人工纯林相同深度土壤层碳储量(分别为236.22、267.84 t/hm2和200.57 t/hm2)[16];林地0—100 cm土壤层平均氮储量则低于中国科学院会同森林生态试验站16年生杉木-桤木(Alnuscremastogyne)混交林和杉木-刺楸(Kalopanaxseptemlobus)混交林相同深度土壤层平均氮储量(分别为10.06 t/hm2和9.07 t/hm2)[36]。研究同时表明,3种人工林生态系统平均碳氮储量分别高于黄土丘陵区9年生和17年生刺槐人工林生态系统平均碳储量(分别为69.7 t/hm2和78.9 t/hm2)和氮储量(分别为3.97 t/hm2和4.32 t/hm2)[33],分别低于广西白云实验林场3种人工林生态系统平均碳储量(234.88 t/hm2)和氮储量(13.63 t/hm2)[16]。这表明森林生态系统各组分的碳氮储量受诸多因素的综合影响,如土壤类型、树种生物学特性、林龄以及气候条件等[37-38]。与王卫霞等的研究结果对比进一步表明,随着林龄的增长,植被积累的有机碳和氮增加,长期的枯落物周转使得输入到土壤中的有机碳和氮增多,因而生态系统碳氮储量增加。
3种人工林生态系统碳储量研究结果表明,马尾松-格木混交林生态系统碳储量高于其它两种人工纯林,混交林表现出更高的碳储存能力。因此,若将森林生态系统碳库考虑在内,与固氮树种混交在该区域是一种更好的人工林经营方式。3种幼龄人工林生态系统碳氮储量空间分布基本一致,地上与地下部分碳氮储量分配比分别为:格木纯林1∶6.3和1∶28.5、马尾松-格木混交林1∶3.9和1∶32.6、马尾松纯林1∶3.6和1∶35.7,远低于其他成熟林的同类研究结果[16, 39],表明随着林龄的增长,3种人工林生态系统仍具有较大的碳氮固持潜力,特别是乔木层。
[1] Janzen H H. Carbon cycling in earth systems—a soil science perspective. Agriculture, Ecosystems & Environment, 2004, 104(3): 399-417.
[2] Lal R. Forest soils and carbon sequestration. Forest Ecology and Management, 2005, 220(1): 242-258.
[3] Bonan G B. Forests and climate change: forcings, feedbacks, and the climate benefits of forests. Science, 2008, 320(5882): 1444-1449.
[4] Yang Y S, Guo J, Chen G, Xie J, Gao R, Li Z, Jin Z. Carbon and nitrogen pools inChinesefirand evergreen broadleaved forests and changes associated with felling and burning in mid-subtropical China. Forest Ecology and Management, 2005, 216(1/3): 216-226.
[5] Paquette A, Messier C. The role of plantations in managing the world′s forests in the Anthropocene. Frontiers in Ecology and the Environment, 2010, 8(1): 27-34.
[6] Wang H, Liu S R, Wang J X, Shi Z M, Lu L H, Zeng J, Ming A G, Yu H L. Effects of tree species mixture on soil organic carbon stocks and greenhouse gas fluxes in subtropical plantations in China. Forest Ecology and Management, 2013, 300(15):4-13.
[7] 梁瑞龙. 广西乡土阔叶树种资源现状及其发展对策. 广西林业科学, 2007, 36(1): 5-9.
[8] Forrester D I, Bauhus J, Cowie A L. On the success and failure of mixed-species tree plantations: lessons learned from a model system ofEucalyptusglobulusandAcaciamearnsii. Forest Ecology and Management, 2005, 209(1/2): 147-155.
[9] Wang F, Li Z, Xia H, Xia H, Zou B, Li N, Liu J, Zhu W. Effects of nitrogen-fixing and non-nitrogen-fixing tree species on soil properties and nitrogen transformation during forest restoration in southern China. Soil Science and Plant Nutrition, 2010, 56(2): 297-306.
[10] Montagnini F. Accumulation in above-ground biomass and soil storage of mineral nutrients in pure and mixed plantations in a humid tropical lowland. Forest Ecology and Management, 2000, 134(1/3): 257-270.
[11] Binkley D, Senock R, Bird S, Cole T G. Twenty years of stand development in pure and mixed stands ofEucalyptussalignaand nitrogen-fixingFacaltariamoluccana. Forest Ecology and Management, 2003, 182(1/3): 93-102.
[12] Forrester D I, Bauhus J, Khanna P K. Growth dynamics in a mixed-species plantation ofEucalyptusglobulusandAcaciamearnsii. Forest Ecology and Management, 2004, 193(1/2): 81-95.
[13] Forrester D I, Bauhus J, Cowie A L. Carbon allocation in a mixed-species plantation ofEucalyptusglobulusandAcaciamearnsii. Forest Ecology and Management, 2006, 233(2/3): 275-284.
[14] Resh S C, Binkley D, Parrotta J A. Greater soil carbon sequestration under nitrogen-fixing trees compared withEucalyptusspecies. Ecosystems, 2002, 5(3): 217-231.
[15] Johnson D W. Effects of forest management on soil carbon storage. Water, Air, and Soil Pollution, 1992, 64(1/2): 83-120.
[16] 王卫霞, 史作民, 罗达, 刘世荣, 卢立华, 明安刚, 于浩龙. 我国南亚热带几种人工林生态系统碳氮储量. 生态学报, 2013, 33(3): 925-933.
[17] 马炜, 孙玉军, 郭孝玉, 巨文珍, 穆景森. 不同林龄长白落叶松人工林碳储量. 生态学报, 2010, 30(17): 4659-4667.
[18] 刘恩, 王晖, 刘世荣. 南亚热带不同林龄红锥人工林碳贮量与碳固定特征. 应用生态学报, 2012, 23(2): 335-340.
[19] 吴亚丛, 李正才, 程彩芳, 刘荣杰, 王斌, 格日乐图. 林下植被抚育对樟树人工林生态系统碳储量的影响. 植物生态学报, 2013, 37(2): 142-149.
[20] 康冰, 刘世荣, 张广军, 常建国, 温远光, 马姜明, 郝文芳. 广西大青山南亚热带马尾松、杉木混交林生态系统碳素积累和分配特征. 生态学报, 2006, 26(5): 1320-1327.
[21] 张仕光, 刘建, 黄开勇, 梁瑞龙, 蓝肖. 桂西北马尾松人工林生物量生长规律及其分配模式. 广西林业科学, 2010, 39(4): 189-192.
[22] 刘光崧. 中国生态系统研究网络观测与分析标准方法——土壤理化分析与剖面描述. 北京: 中国标准出版社, 1996.
[23] Neumann-Cosel L, Zimmermann B, Hall J S, van Breugel M, Elsenbeer H. Soil carbon dynamics under young tropical secondary forests on former pastures—a case study from Panama. Forest Ecology and Management, 2011, 261(10): 1625-1633.
[24] He Y, Qin L, Li Z, Liang X, Shao M, Tan L. Carbon storage capacity of monoculture and mixed-species plantations in subtropical China. Forest Ecology and Management, 2013, 295: 193-198.
[25] LeBauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 2008, 89(2): 371-379.
[26] Davidson E A, Reis de Carvalho C J, Vieira I C, Figueiredo R D O, Moutinho P, Yoko Ishida F, Tuma Sabá R. Nitrogen and phosphorus limitation of biomass growth in a tropical secondary forest. Ecological Applications, 2004, 14(4): 150-163.
[27] Siddique I, Engel V L, Parrotta J A, Lamb D, Nardoto G B, Ometto J P, Schmidt S. Dominance of legume trees alters nutrient relations in mixed species forest restoration plantings within seven years. Biogeochemistry, 2008, 88(1): 89-101.
[28] Trumbore S E, Chadwick O A, Amundson R. Rapid exchange between soil carbon and atmospheric carbon dioxide driven by temperature change. Science, 1996, 272(5260): 393-396.
[29] 李忠佩, 王效举. 小区域水平土壤有机质动态变化的评价与分析. 地理科学, 2000, 20(2): 182-188.
[30] Jandl R, Lindner M, Vesterdal L, Bauwens B, Baritz R, Hagedorn F, Johnson D W, Minkkinenh K, Byrne K A. How strongly can forest management influence soil carbon sequestration?. Geoderma, 2007, 137(3/4): 253-268.
[31] Van Veen J A, Kuikman P J. Soil structural aspects of decomposition of organic matter by micro-organisms. Biogeochemistry, 1990, 11(3): 213-233.
[32] 罗达, 冯秋红, 史作民, 李东胜, 杨昌旭, 刘千里, 何建社. 岷江干旱河谷区岷江柏人工林碳氮储量随林龄的动态. 应用生态学报, 2015, 26(4): 1099-1105.
[33] 崔鸿侠, 唐万鹏, 胡兴宜, 潘磊. 杨树人工林生长过程中碳储量动态. 东北林业大学学报, 2012, 40(2): 47-49, 60-60.
[34] 艾泽民, 陈云明, 曹扬. 黄土丘陵区不同林龄刺槐人工林碳、氮储量及分配格局. 应用生态学报, 2014, 25(2): 333-341.
[35] 黄宇, 冯宗炜, 汪思龙, 冯兆忠, 张红星, 徐永荣. 杉木、火力楠纯林及其混交林生态系统C、N贮量. 生态学报, 2005, 25(12): 3146-3154.
[36] 王华, 黄宇, 汪思龙, 邹冬生. 中亚热带几种典型森林生态系统碳、氮储存功能研究. 中国生态农业学报, 2010, 18(3): 576-580.
[37] Finér L, Mannerkoski H, Piirainen S, Michael S. Carbon and nitrogen pools in an old-growth, Norway spruce mixed forest in eastern Finland and changes associated with clear-cutting. Forest Ecology and Management, 2003, 174(1/3): 51-63.
[38] 骆土寿, 陈步峰, 陈永富, 杨彦臣, 杨秀森, 李大江. 海南岛霸王岭热带山地雨林采伐经营初期土壤碳氮储量. 林业科学研究, 2000, 13(2): 123-128.
[39] 周玉荣, 于振良, 赵士洞. 我国主要森林生态系统碳贮量和碳平衡. 植物生态学报, 2000, 24(5): 518-522.
Carbon and nitrogen storage in monoculture and mixed young plantation stands ofErythrophleumfordiiandPinusmassonianain subtropical China
LUO Da1, SHI Zuomin1,*, WANG Weixia1, LIU Shirong1, LU Lihua2,3, MING Angang2,3, YU Haolong2,3
1KeyLaboratoryonForestEcologyandEnvironmentalSciencesofStateForestryAdministration,InstituteofForestEcology,EnvironmentandProtection,ChineseAcademyofForestry,Beijing100091,China2ExperimentalCenterofTropicalForestry,ChineseAcademyofForestry,Pingxiang532600,China3GuangxiYouyiguanForestEcosystemResearchStation,Pingxiang532699,China
Carbon sequestration in forest ecosystems is recognized as a key mechanism for mitigating the accumulation of atmospheric carbon dioxide. However, both forest carbon pools and sequestration vary according to tree species, age of the stand, soil types, climate, environmental disturbances, and management practices. Tree species composition and management practices are important tools for increasing carbon storage in forest ecosystems. Plantation is becoming a key component of the world′s forest resources and is playing an important role in sustainable forest management. Well-designed, multi-purpose plantations can reduce the pressure on natural forests and complement some ecological resources provided by natural forests in addition to mitigating climate change through direct carbon sequestration. Afforestation and reforestation are important measures for managing commercial forests in subtropical China. However, the large-scale development of monoculture plantations of coniferous species (e.g.,PinusmassonianaandCunninghamialanceolata) and exotic species (Eucalyptusspp.) has caused a number of problems, such as the loss of biodiversity, degradation of soil fertility, reduction of ecosystem stability, and loss of ecological resources. Thus, some broad-leaved tree species with different functions (e.g., indigenous valuable broad-leaved species and nitrogen-fixing species) have been developed for restructuring the plantations. In this study, three young plantation stands (monoculture ofErythrophleumfordii, monoculture ofP.massonianaand a mixed stand of the two species) were selected to study carbon and nitrogen storage in these ecosystems and their spatial distribution. The results showed that the total carbon storage of the mixed plantation stand was 137.75 t/hm2, higher than that of monoculture stands ofE.fordii(134.07 t/hm2) andP.massoniana(131.10 t/hm2). Nitrogen storage was highest inE.fordii(10.19 t/hm2), followed by the mixed plantation (8.68 t/hm2), and thenP.massonianastands (7.01 t/hm2). The spatial distribution of carbon and nitrogen was identical in the three plantation stands, with the majority found in the 0—100 cm soil (occupying an average 81.49% and 96.91% of the total storage, respectively), followed by the above-ground biomass represented by the trees (17.52% and 2.69%, respectively), and the understory vegetation and litterfall. Soil organic carbon was mainly distributed in the top-soil, while soil nitrogen was irregularly distributed. Average organic carbon storage in 0—30 cm soil was 52.52 t/hm2(47.99% of the total 0—100 cm soil storage). The mixed plantation stands showed a greater capacity for carbon storage in comparison to the other two monoculture stands. The above-/underground ratio of carbon and nitrogen suggested that these three young plantation stands had a high potential for carbon and nitrogen sequestration. The results are significant in that they provide scientific references for tree species selection and plantation management to enhance productivity and carbon sequestration in subtropical China.
carbon and nitrogen storage; young forest; nitrogen-fixing tree species; plantation management; subtropical China
中国科学院碳专项(XDA05060100); 林业公益性行业科研专项(201104006)
2014-01-03;
日期:2014-11-19
10.5846/stxb201401030018
*通讯作者Corresponding author.E-mail: shizm@caf.ac.cn
罗达, 史作民, 王卫霞, 刘世荣, 卢立华, 明安刚, 于浩龙.南亚热带格木、马尾松幼龄人工纯林及其混交林生态系统碳氮储量.生态学报,2015,35(18):6051-6059.
Luo D, Shi Z M, Wang W X, Liu S R, Lu L H, Ming A G, Yu H L.Carbon and nitrogen storage in monoculture and mixed young plantation stands ofErythrophleumfordiiandPinusmassonianain subtropical China.Acta Ecologica Sinica,2015,35(18):6051-6059.

