蒲氏钩蝠蛾幼虫血淋巴物质与其耐寒性
易杰群, 张古忍, 郭晨林, 闵 强, 邹志文,*
1 南昌大学生命科学学院, 南昌 330031 2 中山大学有害生物控制与资源利用国家重点实验室,昆虫研究所, 广州 510275
蒲氏钩蝠蛾幼虫血淋巴物质与其耐寒性
易杰群1, 张古忍2, 郭晨林1, 闵 强1, 邹志文1,*
1 南昌大学生命科学学院, 南昌 330031 2 中山大学有害生物控制与资源利用国家重点实验室,昆虫研究所, 广州 510275
作为冬虫夏草寄主,蒲氏钩蝠蛾具重要的经济研究价值,主要分布于青藏高原色季拉山,具有较强的耐寒性,其耐寒性机理尚不明了。通过调查蒲氏钩蝠蛾生境土壤温度与血淋巴物质组成周年变化,以期探讨其耐寒性机理。实验结果表明:土壤温度呈规律性升降趋势,1、2月最低,8月逐步上升至最高,而后逐渐下降;血淋巴中主要物质按含量从高到低排列依次为:蛋白质(8.37—74.2 mg/mL)、总糖(12.65—36.12 mg/mL)、脂肪(7.7—12.32 mg/mL)以及甘油(1.66—3.91 mg/mL);在温度较高的夏季,蛋白质、总糖以及脂肪等物质含量处于较低水平,相反,在寒冷的冬季,此三者的含量均居较高水平;此3类能源物质含量与野外土壤温度均呈极显著的负相关关系,因而血淋巴总热量值在夏季较低而冬季较高,与野外土壤温度亦呈极显著负相关关系;与之相反的是,血淋巴中甘油含量的周年变化规律与野外土壤温度无明显的相关关系。因此,血淋巴中蛋白质、总糖以及脂肪等物质对于蒲氏钩蝠蛾耐寒性有着非常重要的作用,幼虫通过积累3类物质,增加血淋巴能量值,抵御青藏高原的高寒气候;可能由于生境的不同,甘油在蒲氏钩蝠蛾中的作用与其它昆虫有差异,在耐寒性提高中的功能尚需进一步研究。实验结果为了解蒲氏钩蝠蛾的强耐寒性以及适应高寒环境的生理生化机制提供理论依据。
蒲氏钩蝠蛾; 耐寒性; 血淋巴物质
生物依靠调节代谢机制和积累抗寒物质来抵御寒冷。耐寒性的昆虫在虫体内发生着复杂的生理生化反应。一方面通过降低体内游离水分含量,提高体液溶质浓度,降低冰点,以防止低温下冰冻伤害;一方面通过积累耐寒性物质,降低体液过冷却点,增强其耐寒性,昆虫体内某些生化物质的增加或减少,影响着过冷却点的高低[1]。
越冬期间许多昆虫体内积累甘油、多元醇、糖等低分子量的糖或醇,以增加昆虫体内结合水含量,减少自由水含量,或直接与酶及其他的蛋白质相互作用起到保护生物系统的作用。不同昆虫所积累的物质种类和含量不同,但在大多数昆虫中都由以上几种物质构成一个抗寒物质系统,如欧桦小蠹虫Scolytusratzeburgi幼虫中的甘油、山梨醇、葡萄糖以及海藻糖会对低温产生响应;桑尺蠖Phthonadriaatrilineata越冬幼虫和黄地老虎Agrotissegetum幼虫则是以小分子糖-氨基酸-糖蛋白系统抵御寒冷[2-4]。
蝠蛾幼虫的强耐寒性已有文献报道,大多数种类幼虫能在-10—-12 ℃温度下过冬,有些甚至能耐受-20 ℃左右的低温[5-6],是一种研究耐寒性理想的材料。由于其分布范围窄,生境特殊,因而在其抗寒性研究方面,已有的报道仅见于白马钩蝠蛾Thitarodesbaimaensis(Liang)以及云南虫草蝠蛾Hepialussp.,其幼虫能在越冬初期增加体内蛋白、糖和脂肪含量,但未对幼虫血淋巴物质进行详细研究[7-8]。昆虫血淋巴是昆虫体内输送和贮藏营养物质的介质和场所,是昆虫生理生化研究的重要材料,对于昆虫耐寒性机理及机制的研究具有非常重要的作用。
蒲氏钩蝠蛾T.pui生长在青藏高原的色季拉山,色季拉山雨量丰沛,年降水量650 mm以上。每年自9月底至10月初开始降雪,直至第2年5月份,土壤湿润且冻土期长[9]。其幼虫具有较强的耐寒性,本文从蒲氏钩蝠蛾血淋巴能源物质的周年变化入手,探讨蒲氏钩蝠蛾幼虫适应高寒环境的生理生化机制,为阐明蝠蛾幼虫强耐寒性提供理论基础。
1 材料和方法
1.1 蒲氏钩蝠蛾的发生环境简介
色季拉山位于西藏林芝县以东,属念青唐古拉山脉,是尼洋河流域与帕龙藏布江的分水岭。该地区年降水量充沛,年平均气温低,冰雪覆盖长达半年之久,气压为平原地区的60%—70%,氧气含量仅为内陆地区的40%—50%。2006 年,中山大学在色季拉山海拔4156 m (29°37′897′′N,94°37′522′′E) 处建立了“中山大学青藏高原特色资源科学工作站”,从事冬虫夏草资源可持续利用的基础理论和应用技术研究。蒲氏钩蝠蛾是前期工作中发现的新种[9],主要分布于色季拉山海拔4100—4650 m的高寒灌木及高寒草甸土壤中,主要植被为低矮灌木及草本植物,土壤表层植物根系密集,坚实而有弹性,富含有机质;夏季雨水多,土壤湿润,冬季寒冷,有冻土形成;全年昼夜温差大。
1.2 野外土壤周年温度变化数据的采集
温度/湿度数据采集器购自美国Eco Tech公司,型号为适用于野外土壤和空气温湿度的记录的H08-032-08,温度范围-20 ℃—50 ℃;因蒲氏钩蝠蛾大龄幼虫多分布于地表以下20 cm左右,因此在3处将3个采集器分别埋入地面20 cm深的土壤,设置每30 min自动记录1次温度和湿度数据。每隔30 d左右,利用配套的BoxCar Pro软件读取数据。
1.3 蒲氏钩蝠蛾血淋巴的采集
自2008年4月至2009年3月,每月中旬在采集器周围土壤中随机采挖蒲氏钩蝠蛾8龄幼虫数头,带回工作站。取5头体型相近幼虫置于预冷的冰盒上进行麻醉,酒精棉球消毒虫体后,毛细管自腹足取血淋巴,所取血淋巴直接放入置于冰上的预先加有苯基硫脲的Eppendorf管中,混匀后,4 ℃下10000 r/min离心5 min,-80 ℃备用。5次重复。
1.4 总糖含量的测定
参照冯慧的方法,在一定量的血淋巴上清液中加入磺基水杨酸溶液至终浓度为10%,15000 r/min离心10 min以除去蛋白质沉淀[10]。取5 μL上清液,加入0.2%蒽酮浓硫酸试剂,在沸水浴中加热10 min,冷却后测OD620值。以0.01%的葡萄糖制作标准曲线。
1.5 可溶性蛋白浓度的测定
可溶性蛋白的测定依据Bradford的方法进行测定[11]。取幼虫血淋巴5 μL,加入考马斯亮蓝-G 250染色3—5 min,而后于紫外/可见分光光度计中测定样品OD590。并以1 mg/mL牛血清蛋白为标准蛋白制定标准曲线。
1.6 脂肪含量的测定
血淋巴中的脂肪含量采用含磷香草醛酸法测定[12]。取出幼虫血淋巴5 μL,蒸馏水补足至100 μL后,加入0.5 mL氯仿于室温静止10 min;然后加入0.5 mL的浓H2SO4,沸水中加热10 min,冷却至室温。最后加入1 mL含磷香草醛溶液(在14 mol/L的磷酸中加入13 mmol/L香草醛),混匀后,在室温下置30 min,测OD547值。以胆固醇(含2.5 mg/mL甲醇)制作标准曲线。
1.7 热量值总卡路里的计算
参照Graney和Giesy的方法,假定脂类的热量值为39.748 J/mg,糖的热量值为17.991J/mg,蛋白的热量值为17.154J/mg,根据血淋巴中糖、脂肪和蛋白质含量计算总热量值(×4.184J/mL)[13]。
1.8 甘油含量测定
(1)试剂
过碘酸钠、无水醋酸氨、冰醋酸、乙酰丙酮、异丙醇、甘油(丙三醇,比重为1.261),均为国产分析纯(AR)。
氧化剂 称取过碘酸纳130 mg,溶于约50 mL蒸馏水中,加入8 g无水醋酸氨,待全部溶解后再加入6 mL冰醋酸,最后加水定容至100 mL,混匀,置棕色瓶中各用。
显色剂 取乙酰丙酮0.4 mL,加异丙醇至100 mL,混匀,置棕色瓶中备用。
甘油标准液 取甘油1 mL,加水定容至200 mL摇匀,吸取10 mL定容至1000 mL,即得甘油含量为1/20000(或63.05 μg/mL)的甘油标准液。
(2)标准曲线制作
取16支试管,分2组作为2个重复。分别加入0、100、200、300、400、500、600、700 μL甘油标准液,以蒸馏水补体积到1 mL,使测试标准液的甘油含量分别为0、6.305、12.610、18.915、25.220、31.525、37.830、44.135 μg/mL。每管中加入氧化剂2 mL,摇匀,加入显色剂2 mL充分混和后,置60 ℃水浴中加热显色15 min,流水冷却。在722型光栅分光光度计上420 nm波长下进行比色分析,用空白管溶液调零点,记录透光度值。以甘油含量为纵坐标,透光度值为横坐标绘制出标准曲线。
(3)测量方法
取血淋巴10 μL,补水至1 mL,如上方法进行测定。
1.9 数据分析
能源物质、甘油周年变化数值经对数转换,进行单因素方差分析,并进行多重比较,以阐明差异的显著性;各种物质及能量值与温度相关性及线性关系方程均采用Statistica 8.0软件处理。
2 结果与分析
2.1 不同季节野外土壤温度变化
2008年4月至2009年3月色季拉山野外蒲氏钩蝠蛾生境土壤月平均温度如表1所示。其中最高平均土壤温度出现在8月,为(11.31±0.26)℃,最低平均土壤温度出现在1、2月,分别为(-0.01±0.18)℃和(-0.05±0.10)℃。从表1中可以明显看出,3—8月,平均土壤温度逐渐上升,8月份后土壤温度逐渐下降,至1月和2月的土壤月平均温度低于0 ℃。
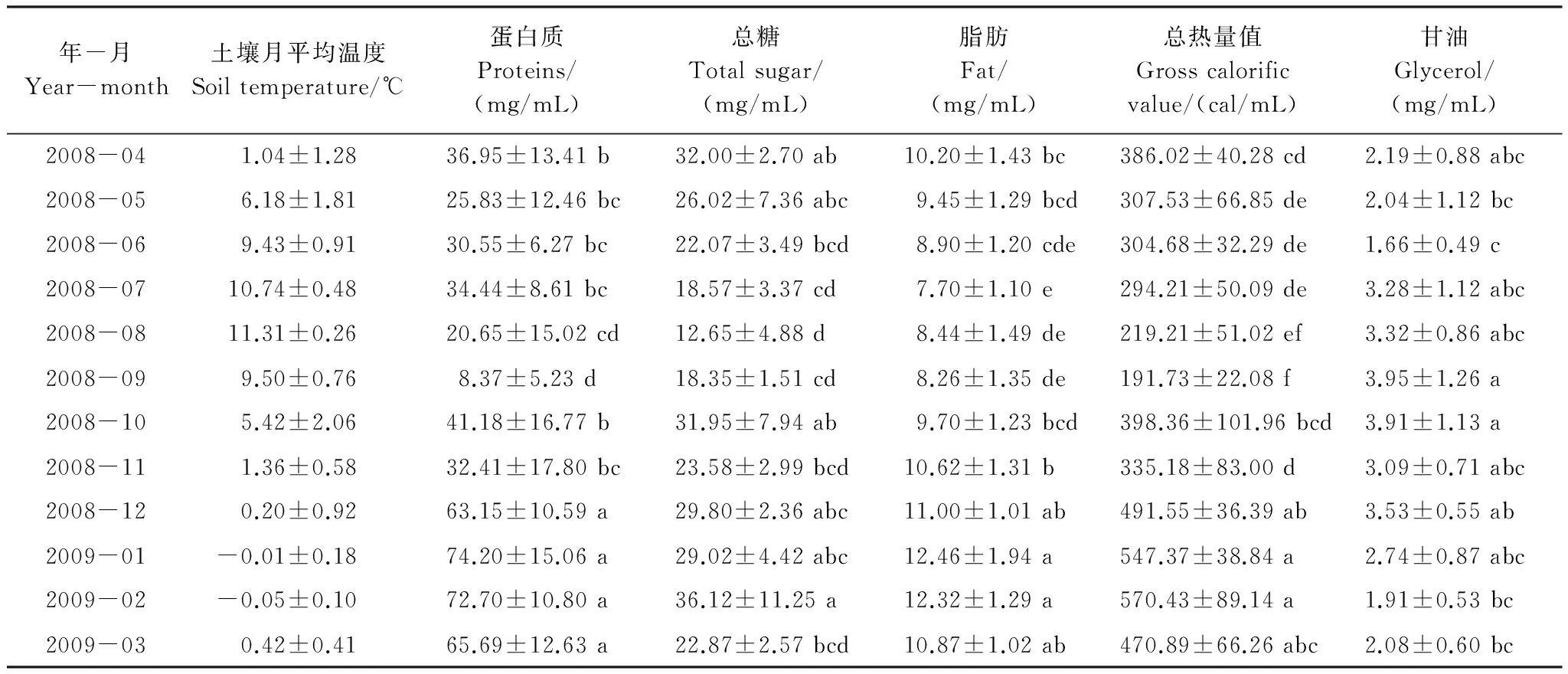
表1 色季拉山野外土壤周年月平均温度及蒲氏钩蝠蛾幼虫血淋巴蛋白质、总糖、脂肪、能量和甘油周年变化动态(平均数±标准差)(n=5)
2.2 幼虫血淋巴蛋白质的季节动态
蒲氏钩蝠蛾幼虫血淋巴中的蛋白质与野外土壤温度呈极显著的负相关关系(图1),两者间的方程式为y=59.238-3.686x(r=-0.789,P=0.002),在全年温度最低的1、2月血淋巴蛋白质含量最高,在70 mg/mL以上,随着气温的升高而不断降低,在9月达到最低,为(8.37±5.23)mg/mL。
2.3 幼虫血淋巴总糖的季节动态
蒲氏钩蝠蛾幼虫血淋巴中的总糖与野外土壤温度呈极显著的负相关关系(图2),两者间的方程式为y=30.437-1.121x(r=-0.760,P=0.004),在温度最低的2月血淋巴总糖含量最高,为(36.12±11.25)mg/mL,之后随着气温的的升高而降低,在8月达到最低,为(12.65±4.88)mg/mL。
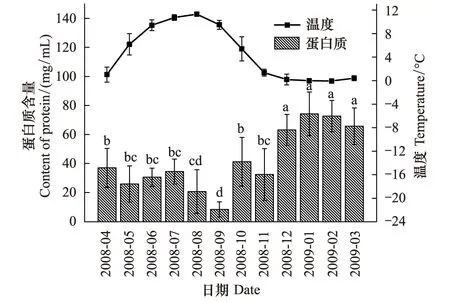
图1 蒲氏钩蝠蛾血淋巴中蛋白质与土壤温度季节动态(n=5)Fig.1 Seasonal dynamic of proteins in larvae hemolymph and soil temperature of T.pui (n=5)
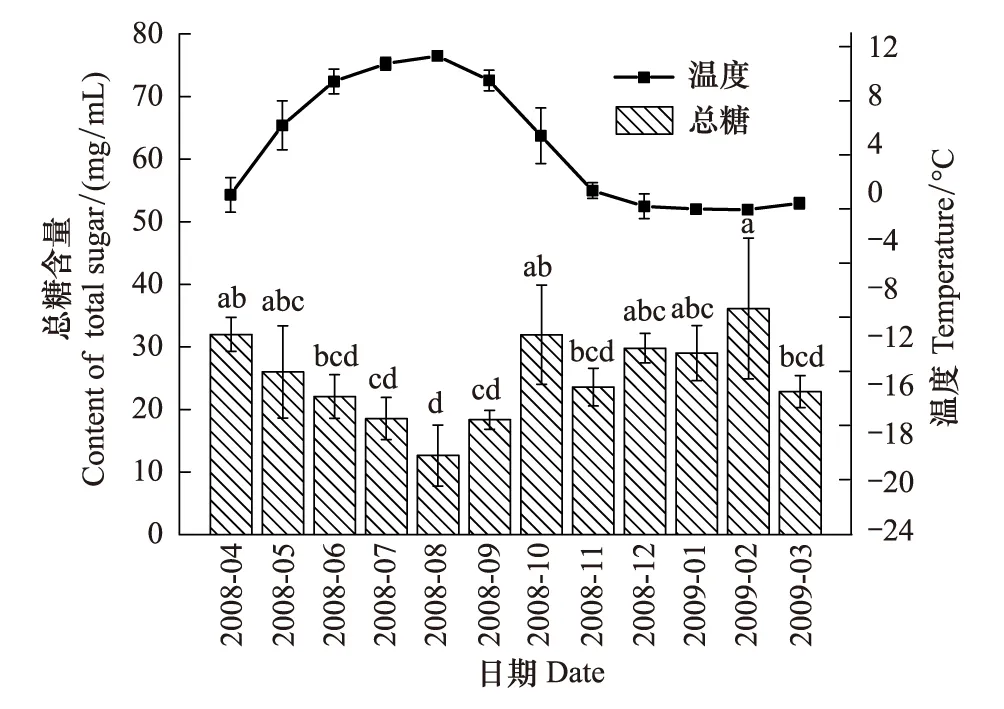
图2 蒲氏钩蝠蛾血淋巴中总糖与土壤温度季节动态(n=5)Fig.2 Seasonal dynamic of total sugar in larvae hemolymph and soil temperature of T.pui (n=5)
2.4 幼虫血淋巴脂肪的季节动态
蒲氏钩蝠蛾幼虫血淋巴中的脂肪与野外土壤温度呈极显著的负相关关系(图3),两者间的方程式为y=11.413-0.307x(r=-0.924,P=0.000),在全年温度最低的1、2月血淋巴总糖含量最高,在12 mg/mL以上,高温环境下会含量逐渐降低,在7月达到最低,为(7.70±1.10)mg/mL。
2.5 幼虫血淋巴总热量值的季节动态
蒲氏钩蝠蛾幼虫血淋巴中的总热量值与野外土壤温度呈极显著的负相关关系(图4),两者间的方程式为y=482.180-22.850x(r=-0.860,P=0.000),在全年温度最低的1、2月血淋巴总热量值最高,在2.092 kJ/mL以上,在9月达到最低,为(191.73±22.08)×4.184kJ/mL。
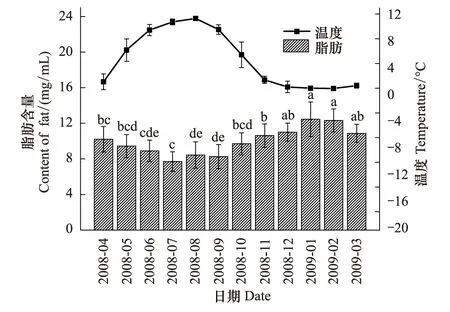
图3 蒲氏钩蝠蛾血淋巴中脂肪与土壤温度季节动态(n=5)Fig.3 Seasonal dynamic of fat in larvae hemolymph and soil temperature of T.pui (n=5)
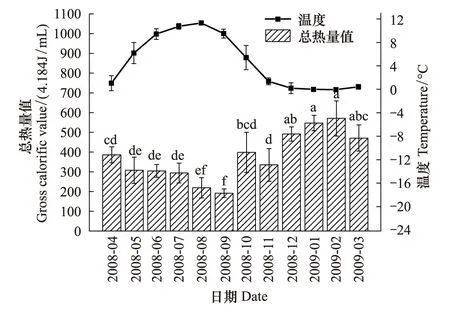
图4 蒲氏钩蝠蛾血淋巴中总热量与土壤温度季节动态(n=5)Fig.4 Seasonal dynamic of gross calorific value in larvae hemolymph and soil temperature of T.pui (n=5)
2.6 幼虫血淋巴甘油的季节动态
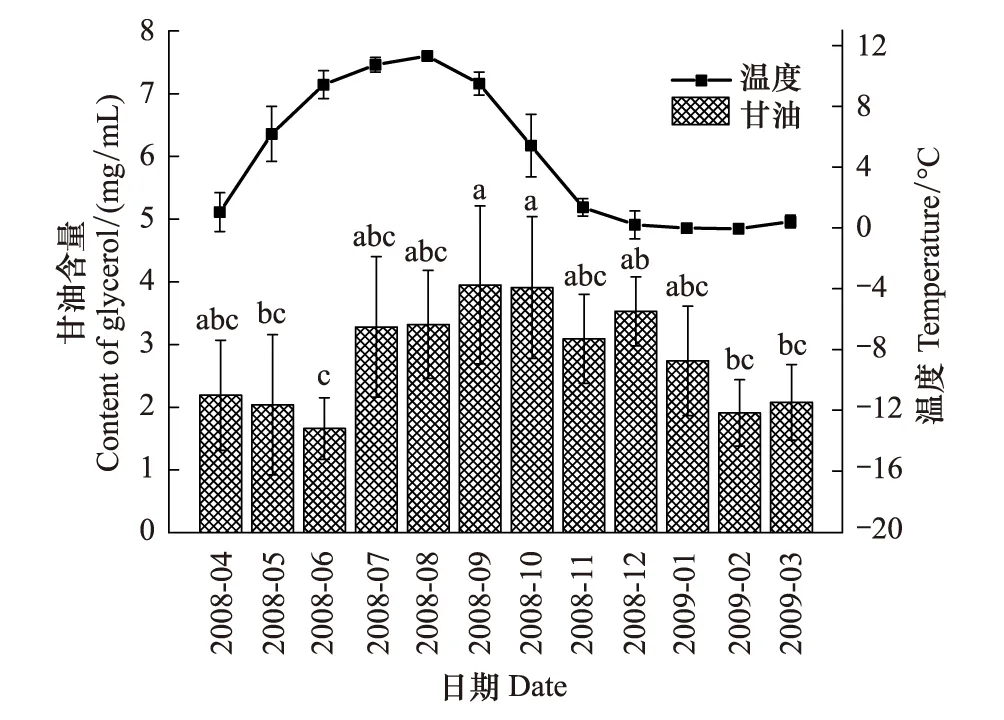
图5 蒲氏钩蝠蛾血淋巴中甘油与土壤温度季节动态(n=5) Fig.5 Seasonal dynamic of glycerol in larvae hemolymph and soil temperature of T.pui (n=5)
蒲氏钩蝠蛾幼虫血淋巴中的甘油含量与野外土壤温度不存在明显的相关关系(图5),两者间的方程式为y=2.580 + 0.495x(r=0.283,P=0.370)。
蒲氏钩蝠蛾幼虫蛋白质、脂肪、甘油含量及总热量值从2008年4月至2009年3月的周年变化动态如表1所示。结果表明,总糖、蛋白质、脂肪及总热量值的周年变化规律基本一致,与土壤温度的变化呈负相关关系,即随着土壤温度的降低而升高,至土壤温度最低的1月和2月,能量物质达到最高峰值,而在温度最低的7月和8月,能量物质达到最低谷值,且峰值和谷值之间差异极显著。但血淋巴中甘油含量的周年变化规律正好相反,二者间存在极显著差异。
3 讨论
温度是影响生物生存的重要因素之一。就昆虫而言,调节代谢及合成抗寒物质是两种有效适应低温的方式。作为重要的运输及代谢场所,血淋巴内组成成份的变化对昆虫适应低温环境起到至关重要的作用。
昆虫对季节性温度差异的反应表现为体内相关的耐寒性生化物质种类及含量的变化,这些变化影响着过冷却点的高低,从而决定了其耐寒性的强弱[1]。昆虫在低温下,伴随着体内甘油的出现,相应也会产生山梨醇、甘露醇、核糖醇、赤藓糖醇等多元醇。多元醇适合作抗冻保护剂,是因为其具有水溶液中溶解度高、无毒且相溶性好、对酶或代谢过程影响很少、能自由跨膜等特点[14]。它们在生物体内起到双重的作用,一方面增强膜的抗冻保护作用,另一方面可增加细胞燃料,利用体内的糖贮存来产生能量,这些物质的积累增加了体液溶质的浓度,能有效的降低生物过冷却点[15]。蝠蛾是一类具有强耐寒性的昆虫[5-6],实验过程中,虽并未测定其过冷却点,但发现在-20 ℃其能存活约半个小时,当其包裹于土壤中时,存活时间将延长(数据未发表)。
蛋白质是组成虫体的最基本的物质之一,许多越冬昆虫的幼虫以蛋白质作为其主要抗寒物质,增强自身的抗寒能力,以适应外界低温的变化。本文章蒲氏钩蝠蛾幼虫血淋巴中蛋白质含量与温度呈极显著负相关则证实了此点,这与桑尺蠖、卡尼鄂拉蜂、意蜂、赤松毛虫幼虫及黄地老虎幼虫体内蛋白质在低温季节的表现相似[1,3-4,16-17]。目前在昆虫耐寒性研究中涉及最多的是抗冻蛋白和热激蛋白等,并已取得了显著地成果。抗冻蛋白主要在脂肪体中合成,随后释放到血淋巴中,可以通过热滞效应有效地抑制冰晶在生物体内的生成和增长[18]。而热激蛋白在增加耐寒性上的主要作用是作为分子伴侣帮助蛋白质分子转移至作用部位,具有帮助修复受损蛋白,维持其正常功能[19]。研究表明,蒲氏钩蝠蛾热激蛋白与耐寒性具有紧密的联系,其热激蛋白90基因表达与环境温度呈现显著的负相关关系[20]。
在蒲氏钩蝠蛾血淋巴中,总糖含量同样与温度存在极显著的负相关性。糖类的作用是降低溶液过冷却点和提供越冬期间需要的能量。在低温季节保持较高水平,这与降低停止活动幼虫体液的过冷却点并提供能量密切相关。在黄地老虎、西藏飞蝗5龄蝻、赤松毛虫和松阿扁叶蜂幼虫研究中有类似报道[1,4,21-22]。在生物体多种应对非生物协迫的方式中,海藻糖的积累是一种较为普遍的方式[23],昆虫也不例外。作为血淋巴中最主要的糖类物质,海藻糖不仅可以作为能源物质以应对低温,同样还可以降低溶液过冷却点,保证机体正常生命活动[24]。还有报道指出,海藻糖可以在低温时保护蛋白质以及细胞膜维持正常结构[25-26]。但是有关海藻糖提升昆虫耐寒性的具体机制,目前尚未弄清,仍需进一步研究。
脂肪增加昆虫耐寒性的方式有3种:(1)脂肪是昆虫体内重要的储能物质,为昆虫抵御寒冷以及维持正常生命活动提供能量基础[27];(2)脂肪的积累可以增加昆虫体内结合水的含量,从而降低自由水的含量,降低昆虫过冷却点[16,28];(3)脂肪是昆虫体内重要的代谢物,可为昆虫合成抗冻剂,如甘油,提供物质基础。因此,脂肪对于昆虫耐寒性的提高有着非常重要的作用。有关脂肪与昆虫耐寒性的的研究已经在许多昆虫中有过报道[29-32]。在蒲氏钩蝠蛾中也发现寒冷季节全虫总脂保持较高水平[33]。因而,在本研究中,冬季蒲氏钩蝠蛾幼虫血淋巴中的脂肪含量显著升高。
寒冷刺激会增加生物能量的贮备,如冷刺激下的黑腹果蝇,能量的贮备与寒冷耐受性的提高有着直接的联系,寒冷季节蒲氏钩蝠蛾幼虫血淋巴中能量值升高,对其寒冷耐受性的提高有极大地帮助,保证了低温下能量的供应[34-35]。
与其它昆虫不同的是,在蒲氏钩蝠蛾体内甘油的含量与温度并未显示出密切的相关性(r=0.283,P=0.370)。甘油是一种重要的小分子耐寒性生化物质,也是越冬昆虫中最普遍的抗冻保护剂[36]。越冬期的松毛虫[1]、松阿扁叶蜂幼虫[22]、二化螟幼虫[37]和桑螟[38]体内甘油含量都上升了,Ishigur等[39]和Izumi等[40]均报道了日本境内水稻二化螟越冬幼虫通过提高虫体甘油含量来降低其冰点和SCP 来增强耐寒性。然而,气温降低,蒲氏钩蝠蛾血淋巴中甘油不升反降。推测在蒲氏钩蝠蛾体内,甘油的作用并不是主要作为抗冻保护剂,而是参与体内脂肪代谢。因此甘油在蒲氏钩蝠蛾中的作有待进一步的证实,有待全虫体甘油含量的测定。类似的现象也存在于低温处理下的黄地老虎,在其体内未发现甘油的积累,表明不同生物体内甘油在耐寒性中的作用并不相同,生理调节也不尽相同[4]。
此外,昆虫体内含水量对其耐寒性具有极重要的影响[41]。昆虫会通过降低总含水量、增加结合水及减少自由水含量等方式增加体液溶质浓度,降低体液过冷却点和冰点,从而提高对低温的耐受性。大量报道指出在越冬期昆虫体内含水量显著下降,如异色瓢虫雌雄成虫体内含水量在9月份达到最大值,随后逐步降低,越冬后期达到最低值[42];而在光滑鳖甲中,结合水含量在最冷的3月份占总含水量的91.5%,7月份逐渐下降至72.1%,而自由水在3月份含量最低,为8.5%[43]。在昆虫体内,水分调节主要依赖于蛋白质、糖类和脂肪等3类物质,它们通过体内新陈代谢过程直接或间接地参与水分代谢过程。本文研究材料为血淋巴,因而未能对个体含水量进行分析,在今后的实验过程中进一步补充,将有助于其耐寒性机理的探讨。
综上所述,血淋巴中蛋白质、总糖以及脂肪等物质对于蒲氏钩蝠蛾耐寒性有着非常重要的作用,幼虫通过积累3类物质,增加血淋巴能量值,以抵御青藏高原的高寒气候;可能由于生境的不同,甘油在蒲氏钩蝠蛾中的作用与其它昆虫存在明显的有差异,其在耐寒性提高中的功能尚需进一步研究。这为了解蒲氏钩蝠蛾的强耐寒性以及适应高寒环境的生理生化机制提供理论依据,丰富了逆境生物学理论。
[1] 韩瑞东, 孙绪艮, 许永玉, 张光卫. 赤松毛虫越冬幼虫生化物质变化与抗寒性的关系. 生态学报, 2005, 25(6): 1352-1356.
[2] Holden C P, Storey K B. Purification and characterization of aldolase from the cold hardy insectEpiblemascudderiana: enzyme role in ghycerol biosynthesis. Insect Biochemistry and Molecular Biology, 1994, 24(3): 265-270.
[3] 孙绪艮, 郭慧玲, 李恕廷, 王兴华. 桑尺蠖越冬幼虫的耐寒性研究. 蚕业科学, 2000, 26(1): 129-133.
[4] 黄国洋, 王荫长, 尤子平. 黄地老虎耐寒机理初探. 浙江林学院学报, 1990, 7(2): 140-146.
[5] 尹定华, 傅善全, 李泉森. 贡嘎蝠蛾幼虫生物学特性的观察. 昆虫知识, 1995, 32(5): 289-291.
[6] 杨大荣, 李朝达, 舒畅, 杨跃雄. 中国蝠蛾属昆虫的种类和地理分布研究. 昆虫学报, 1996, 39(4): 413-422.
[7] 杨大荣, 沈发荣, 杨跃雄, 龙勇诚, 鲁自, 春生, 斯那都吉, 喻润清. 虫草蝠蛾生态学的研究Ⅲ. 幼虫越冬与生理调节. 动物学研究, 1988, 9(增刊): 43-49.
[8] 杨大荣, 杨跃雄, 沈发荣, 鲁自. 白马蝠蛾幼虫的抗寒性研究. 昆虫学报, 1991, 34(1): 32-37.
[9] 张古忍, 古德祥, 刘昕. 中国蝠蛾属一新种(鳞翅目, 蝙蝠蛾科). 动物分类学报, 2007, 32(2): 473-476.
[10] 冯慧. 昆虫生物化学分析法. 北京: 农业出版社, 1989: 8-15.
[11] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principal of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[12] Nakamatsu Y, Tanaka T. Venom of ectoparasitoid,Euplectrussp. nearplathypenae(Hymenoptera: Eulophidae) regulates the physiological state ofPseudaletiaseparata(Lepidoptera: Noctuidae) host as a food resource. Journal of Insect Physiology, 2003, 49(2): 149-159.
[13] Graney R L, Giesy J P Jr. Effects of long-term exposure to pentachlorophenol on the free amino acids pool and energy reserves of the freshwater amphipodGammaruspseudolimnaeusBousfied (Crustacea, Amphipoda). Ecotoxicology and Environmental Safety, 1986, 12(3): 233-251.
[14] Storey K B, Storey J M. Freeze tolerance in animals. Physiological Reviews, 1998, 68: 27-84.
[15] Storey K B, Storey J M. Biochemistry of cryoprotectants. Insects at low temperature. US: Springer, 1991: 64-93.
[16] 常志光, 高洪学, 葛英, 于殿华, 常帅. 越冬意蜂体内水分、蛋白质、脂肪的变化与抗寒性的关系. 中国蜂业, 2007, 58(2): 17-17.
[17] 常志光, 李志勇, 高寿增, 王海生. 卡尼鄂拉蜂越冬期体内水分、蛋白质、脂肪的变化与抗寒性的关系研究. 蜜蜂杂志, 2008, (1): 6-7.
[18] Meister K, Ebbinghaus S, Xu Y, Duman J G, DeVries A, Gruebele M, Leitner D M, Havenith M. Long-range protein-water dynamics in hyperactive insect antifreeze proteins. Proceedings of the National Academy of Sciences, 2013, 110(5): 1617-1622.
[19] 钟文英, 普雄明. 热休克蛋白的分子生物学研究进展. 医学综述, 2005, 11(2): 148-150.
[20] Zou Z W, Sun Z X, Li J F, Zhang G R. Molecular cloning and characterization of two heat shock proteins inThitarodespui(Lepidoptera: Hepialidae). CryoLetters, 2011, 32(3): 225-239.
[21] 李庆, 王思忠, 封传红, 张敏, 蒋凡, 杨刚, 罗林明. 西藏飞蝗Locustamigratoriatibetensis(Chen)耐寒性理化指标. 生态学报, 2008, 28(3): 1314-1320.
[22] 梁中贵, 张卫光, 刘学辉, 孟庆英, 孙绪艮. 松阿扁叶蜂越冬幼虫体内抗寒物质分析. 昆虫知识, 2005, 42(6): 695-699.
[23] Iordachescu M, Imai R. Trehalose biosynthesis in response to abiotic stresses. Journal of Integrative Plant Biology, 2008, 50(10): 1223-1229.
[24] Nomura M, Ishikawa Y. Dynamic changes in cold hardiness, high-temperature tolerance and trehalose content in the onion maggot,Deliaantiqua(Diptera: Anthomyiidae), associated with the summer and winter diapause. Applied Entomology and Zoology, 2001, 36(4): 443-449.
[25] Rojas R R, Charlet L D, Leopold R A. Biochemistry and physiology of overwintering in the mature larva of the red sunflower seed weevil,SmicronyxfulvusLeConte (Coleoptera: Curculionidae). Journal of Insect Physiology, 1991, 37(7): 489-496.
[26] Rojas R R, Charlet L D, Leopold R A. Biochemistry and physiology of overwintering in the mature larva of the sunflower stem weevil,Cylindrocopturusadspersus(Coleoptera: Curculionidae) in the Northern Great Plains. Journal of Insect Physiology, 1994, 40(3): 201-205.
[27] Canavoso L E, Jouni Z E, Karnas K J, Pennington J E, Wells M A. Fat metabolism in insects. Annual Review of Nutrition, 2001, 21(1): 23-46.
[28] 张瑞, 马纪. 昆虫过冷却点的影响因素概述. 天津农业科学, 2013, 19(11): 76-84.
[29] Bemani M, Izadi H, Mahdian K, Khani A, Amin S M. Study on the physiology of diapause, cold hardiness and supercooling point of overwintering pupae of the pistachio fruit hull borer,Arimaniacomaroffi. Journal of insect physiology, 2012, 58(7): 897-902.
[30] Behroozi E, Izadi H, Samih M A, Moharamipour S. Physiological strategy in overwintering larvae of pistachio white leaf borer,OcneriaterebinthinaStrg. (Lepidoptera: Lymantriidae) in Rafsanjan, Iran. Italian Journal of Zoology, 2012, 79(1): 44-49.
[31] Lehmann P, Lyytinen A, Sinisalo T, Lindström L. Population dependent effects of photoperiod on diapause related physiological traits in an invasive beetle (Leptinotarsadecemlineata). Journal of Insect Physiology, 2012, 58(8): 1146-1158.
[32] Rousseau J, Bauce É, Lavallée R, Guertin C. Winter mortality and supercooling point of the spruce beetle (Coleoptera: Curculionidae) not affected by host tree vigor in Nova Scotia, Canada. Journal of the Acadian Entomological Society, 2012, 8: 1-10.
[33] 邹志文. 西藏色季拉山钩蝠蛾属Thitarodes昆虫研究 [D]. 广州: 中山大学, 2009: 67-80.
[34] Misener S R, Chen C P, Walker V K. Cold tolerance and proline metabolic gene expression inDrosophilamelanogaster. Journal of Insect Physiology, 2001, 47(4/5): 393-400.
[35] Chen C P, Walker V K. Cold-shock and chilling tolerance inDrosophila. Journal of Insect Physiology, 1994, 40(8): 661-669.
[36] Li N G. Relationships between cold hardiness, and ice nucleating activity, glycerol and protein contents in the hemolymph of caterpillars,AporiacrataegiL.. CryoLetters, 2012, 33(2): 135-143.
[37] 陈永杰, 孙绪艮, 张卫光, 牟志刚, 郭光志. 桑螟越冬幼虫体内水分、脂肪、甘油的变化与抗寒性的关系. 蚕业科学. 2005, 31(1): 22-25.
[38] 强承魁, 杜予州, 于玲雅, 崔亚东, 陆明星, 郑福山. 水稻二化螟越冬幼虫耐寒性物质的动态变化. 应用生态学报, 2008, 19(3): 599-605.
[39] Ishiguro S, Li Y P, Nakano K, Tsumuki H, Goto M. Seasonal changes in glycerol content and cold hardiness in two ecotypes of the rice stem borer,Chilosuppressalis, exposed to the environment in the Shonai district, Japan. Journal of Insect Physiology, 2007, 53(4):392-397.
[40] Izumi Y, Katagiri C, Sonoda S, Tsumuki H. Seasonal changes of phospholipids in last instar larvae of rice stem borerChilosuppressalisWalker (Lepidoptera: Pyralidae). Entomological Science, 2009, 12(4): 376-381.
[41] 冯宇倩, 王锦林, 宗世祥. 昆虫越冬虫态及耐寒策略概述. 中国农学通报, 2014, 30(9): 22-25.
[42] 赵静, 于令媛, 李敏, 郑方强, 张帆, 许永玉. 异色瓢虫成虫耐寒能力的季节性变化. 昆虫学报, 2008, 51(12): 1271-1278.
[43] 马延龙, 候凤, 马纪. 荒漠昆虫光滑鳖甲的耐寒性季节变化及其生理机制. 昆虫学报, 2009, 52(4): 372-379.
Relationship between hemolymph composition and cold tolerance inThitarodespuilarvae
YI Jiequn1, ZHANG Guren2, GUO Chenlin1, MIN Qiang1, ZOU Zhiwen1,*
1SchoolofLifeSciences,NanchangUniversity,Nanchang330031,China2StateKeyLaboratoryforBiocontrol&InstituteofEntomology,SunYat-SenUniversity,Guangzhou510275,China
Temperature, particularly extreme cold, is a key stressor that limits the distribution and abundance of insects. In response, various cold adaptations have evolved among insects, such as the accumulations of proteins and lipids, as well as low-molecular-weight cryoprotectants.Thitarodespuiis important as the host ofOphiocordycepssinensis(Berk.) (G.H. Sung, J.M. Sung, Hywel-Jones and Spatafora) and has a limited distribution on Segrila Mountain in Nyingchi of the Tibetan Plateau. Low temperature is the main environmental stressor forT.pui, and although it is able to survive extreme cold, the mechanism is unclear. To determine the mechanism of cold adaptation, the composition of larvae hemolymph and soil temperature was investigated over 1 year (from April 2008 to March 2009) inT.puihabitats. Soil temperature exhibited a single curve, which peaked in August 2008 (11.31℃) and reached the lowest temperature in February 2009 (-0.05℃). The temperature of soil gradually increased from February to August and then decreased until the following February. To determine the factors involved in adaptation to low temperatures, the major components of hemolymph inT.puilarvae were isolated and classified as protein, total sugar, fat or glycerol. The correlation analysis between the components in hemolymph and soil temperature demonstrated that protein, total sugar and fat content fluctuated in response to the change in temperature during the study period. Among these components, proteins were most abundant in hemolymph and were present at the lowest level in September (8.37 mg/mL) and the highest in January (74.2 mg/mL). In spite of the slight decrease in November (32.41 mg/mL) and slight increase in June (34.44 mg/mL), protein levels gradually increased from September to January and decreased between February and August. There was a highly significant negative correlation with soil temperature, described by the functiony=59.238-3.686x(r=-0.789,P=0.002). The second major component was total sugars (12.65—36.12 mg/mL), which remained at low levels during the summer and increased during the winter. There was a significant decrease between April and August, during which the soil temperature increased. The soil temperature remained low from December to February and the total sugar remained high. The relationship between total sugars and soil temperature wasy=30.437-1.12x(r=-0.760,P=0.004), showing the same correlation as that between soil temperature and proteins. The fat content ranged from 7.7 to 12.46 mg/mL and correlated with soil temperature in the same manner as did the other components in larvae hemolymph, withy=11.413-0.307x(r=-0.924,P=0.000). Thus, the gross caloric value of hemolymph was lower in summer and higher in winter. The significant negative correlation between the gross caloric value and soil temperature is illustrated by the function,y=482.180-22.850x(r=-0.860,P=0.000). It is thought that glycerol is an important cryoprotectant in many insects that can respond quickly to fluctuations in the ambient temperature. Therefore, the present finding that glycerol levels were lower in larvae hemolymph ofT.puiand that there was no significant correlation with soil temperature was surprising. This is in contrast with studies of other insects exposed to low temperature. These results show that it is important to enhance the cold hardiness ofT.puilarvae to permit the accumulation of proteins, total sugar, and fat in hemolymph. However, the role of glycerol in cold resistance requires further study.
Thitarodespui; cold hardiness; hemolymph composition
国家自然科学基金项目(31160081); 国家科技支撑计划课题(2011BAI13B06); 江西省教育厅项目(GJJ13104); 南昌市农业支撑计划第37 (2010); 南昌市对外科技合作与成果转化推广计划(2013HZCG010)
2014-01-09;
日期:2014-11-19
10.5846/stxb201401090067
*通讯作者Corresponding author.E-mail: zouzhiwen@ncu.edu.cn
易杰群, 张古忍, 郭晨林, 闵强, 邹志文.蒲氏钩蝠蛾幼虫血淋巴物质与其耐寒性.生态学报,2015,35(18):6208-6215.
YI J Q, Zhang G R, Guo C L, Min Q, Zou Z W.Relationship between hemolymph composition and cold tolerance inThitarodespuilarvae.Acta Ecologica Sinica,2015,35(18):6208-6215.

