岷江上游干旱河谷优势灌丛群落土壤生态酶化学计量特征
王冰冰, 曲来叶, 马克明, 张心昱, 宋成军
1 中国科学院生态环境研究中心城市与区域国家重点实验室, 北京 100085 2 中国科学院大学, 北京 100049 3 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验, 北京 100101 4 农业部规划设计研究院, 北京 100125
岷江上游干旱河谷优势灌丛群落土壤生态酶化学计量特征
王冰冰1,2, 曲来叶1,*, 马克明1, 张心昱3, 宋成军4
1 中国科学院生态环境研究中心城市与区域国家重点实验室, 北京 100085 2 中国科学院大学, 北京 100049 3 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验, 北京 100101 4 农业部规划设计研究院, 北京 100125
与碳(C)、氮(N)和磷(P)分解矿化相关的土壤生态酶的相对活性可以揭示微生物生长和代谢过程的能量限制。尽管干旱生态系统愈来愈受到生态学家的关注,但在土壤水分有效性限制和斑块状分布的植被背景下,探讨土壤酶活性化学计量特征,及其与土壤物理、化学因子和土壤微生物群落结构的关系的相关研究仍十分缺乏。通过调查岷江干旱河谷不同水分梯度4个研究样地(两河口、飞虹、撮箕和牟托)灌丛及其丛间空地的土壤物理化学性质、微生物群落组成和土壤生态酶活性,探讨不同水分梯度样地间及灌丛和空地间土壤酶活性计量的分布特征。结果显示,岷江干旱河谷土壤C∶N∶P酶活性化学计量表现出了与全球尺度上酶活性化学计量的相对特异性(C∶N∶P = 3∶2∶2 vs. 1∶1∶1)。整体上,岷江干旱河谷区域土壤微生物生长代谢存在一定程度的N限制。虽然酶活性化学计量特征在所有空地和灌丛土壤之间总体未表现出显著差异,但对各研究地的进一步分析表明,两个相对干旱的两河口和飞虹样地表现出更为明显的N限制,而两个相对湿润的撮箕和牟托样地则存在一定的P限制。这种样地间的差异性主要受土壤水分有效性的驱动。逐步回归分析表明,土壤含水量是不同样地间土壤C∶N酶活性比(ln(BG)∶ln(NAG+LAP))和N∶P酶活性比(ln(NAG+LAP)∶ln(AP))的决定性影响因子。而土壤含水量与C∶N酶活性比具有显著正相关关系,与N∶P酶活性比表现为显著负相关关系。此外,土壤真菌、菌根真菌和真菌∶细菌比对土壤酶活性化学计量的影响,说明了真菌和菌根真菌类群对干旱河谷养分循环的重要作用。
岷江; 干旱河谷; 生态酶化学计量; 养分有效性; 土壤含水量
土壤微生物对土壤有机质的分解,以及对C、N、P等养分元素的吸收利用受到环境中的土壤胞外酶的调节[1]。多数胞外酶通过微生物响应环境条件的变化而被表达、释放到土壤中,另一些则是通过细胞溶解进入土壤[1]。目前研究最多的土壤胞外酶包括:降解纤维素的β-1,4-葡萄糖苷酶 (β-1,4-glucosidase, BG);降解几丁质和肽聚糖的β-1,4-N-乙酰葡糖氨糖苷酶 (β-1,4-N-acetylglucosaminidase, NAG);水解蛋白质和多肽的亮氨酸氨基肽酶 (leucine aminopeptidase, LAP);矿化有机磷的酸性(或碱性)磷酸酶 (acid or alkaline phosphatase, AP)。在生态学研究中,这些胞外酶的活性与微生物代谢、养分的生物化学循环密切相关。不同酶活性的比值,如BG∶(NAG+LAP)、BG∶AP和(NAG+LAP)∶AP常与养分浓度或者C∶N、C∶P和N∶P的比值相联系,并用来评价微生物C、N、P养分资源需求状况[2-4]。Sinsabaugh 等因此提出了生态酶活性化学计量(Ecoenzymatic stoichiometry)概念[5]。
理论和实践工作表明,土壤生态酶的相对活性与资源的有效性相耦合。生态经济学的“最优配置”模型建立在酶的生产对养分资源有效性敏感的假设基础上,这使得微生物可以将更多的目标放在那些最需求的资源上[6-7]。研究发现,土壤磷酸酶活性与土壤P的有效性成反比[8]。当土壤中微生物的生长受到P的限制时,微生物将增加对磷酸酶的投资,从而降低C∶P和N∶P酶活性比。类似的, 在很多生态系统中,N有效性的降低可以促进N分解酶(如NAG和LAP)的活性的升高,而N有效性的升高则将抑制N分解酶的活性,提高对其他养分元素分解酶的投入[9]。在氮缺乏的夏威夷森林中,施氮造成了磷酸酶活性的提高,降低了N∶P酶活性比[9]。
除了资源有效性,土壤酶活性和化学计量也会受到土壤pH、温湿度等因素的调控[1]。Zeglin等对McMurdo干旱河谷的研究表明,LAP∶AP与pH值表现出极显著的正相关关系[10]。此外,Sinsabaugh的meta分析发现ln(BG)∶ln(AP)与年均温和年均降雨量之间存在显著的负相关关系,ln(BG)∶ln(NAG+LAP)和ln(NAG+LAP)∶ln(AP)与年均降雨量之间分别表现出显著的正相关和负相关关系[11]。
干旱和半干旱生态系统是陆地生态系统的重要组成部分,占据陆地表面的41%,承载着近38%的人口[12]。干旱区植被分布表现出明显的斑块状,这种斑块状分布的形成通常是认为受水分、养分资源从灌丛间空地迁移至灌丛下造成的[13]。由于灌丛的存在,其下土壤往往具有更高的有机质输入和更为温和的土壤环境条件[14-15],灌丛下与灌丛间空地土壤间养分资源有效性和土壤环境条件的差异,将对土壤生态酶活性化学计量特征造成影响。另一方面,对于年降雨量低于600 mm的生态系统,初级生产力被认为主要受到土壤水分有效性的控制[16]。在干旱的森林和沙漠生态系统中均发现,干旱可以降低土壤酶活性。这种降低或许是因为在干旱条件下土壤微生物生物量的减少或者C、N、P养分资源的有效性和扩散受到限制。然而,目前在干旱的斑块状分布的灌丛生态系统中,土壤生态酶活性的化学计量特征还少有研究,控制生态酶化学计量特征的土壤理化或者微生物因子更是不得而知。
本研究中,选取了岷江干旱河谷沿岸4个存在水分梯度的样地,采集灌丛和空地土样,测定了土壤基本物理化学性质、微生物群落组成和酶活性,以期验证以下3个假设:(1) 灌丛与空地间存在不同生态酶活性化学计量特征;(2) 样地间生态酶活性化学计量特征将反映N、P资源的有效性,而同时 (3) 生态酶化学计量与N、P资源有效性之间的关系将会受到土壤水分有效性的控制。
1 研究方法
1.1 研究区域概况
岷江干旱河谷地区,行政区划上隶属于四川省阿坝藏族羌族自治州的汶川、理县、茂县、黑水和松潘,主要分布于松潘镇江关以下,经茂县凤仪镇至汶川县的岷江正河,位于102°33′—104°15′E,30°45′—33°09′N之间。该区域年平均气温10—11 ℃左右,降水量494.8 mm 左右,年蒸发量1332.4 mm,气候干燥。土壤类型以山地褐土和山地棕壤土为主,土体十分干燥[17-18]。
1.2 土样采集
本研究选取了岷江上游干旱河谷4个存在水分差异的样地,样地基本情况如表1所示。土壤样品采集于2012年7月。每个样地下设3个10 m×10 m的样方,每个样方内五点法采集灌丛间空地0—15 cm土样;选取样方中处于优势地位的2种灌木(表1),再分别选取3株个体大小类似、长势健康的灌丛,采集下方0—15 cm的土壤。采集的土样,立即放入便携式冰盒中。土样过2 mm筛后,分成3个部分:一部分约50 g土样,放入4 ℃冰箱中保存,用于酶活性检测;一部分约50 g土样,经冷冻干燥和球磨仪研磨后,储藏在-80 ℃超低温冰箱中(Themo Scientific) 用于磷脂脂肪酸(PLFA)分析;另外约100 g土样,风干后用于土壤理化性质检测。
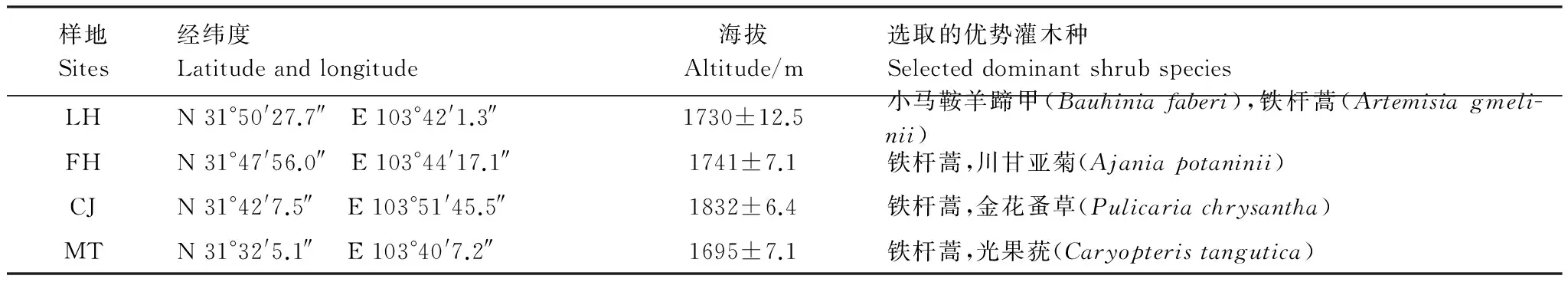
表1 样地基本概况
1.3 实验方法
1.3.1 土壤理化性质测定
土壤含水量(SWC)采用105 ℃连续烘干24 h后计算得出;pH值采用酸度计进行测定(土∶水=1∶2.5);总氮 (TN) 采用元素分析仪(vario MAX CN, Elementar)测定;有效氮(aN)采用碱解扩散法;土壤有机碳(SOC)采用低温外热重铬酸钾氧化比色法测定;总磷 (TP)采用HClO4-H2SO4消煮-钼锑抗比色法,连续流动分析仪(AutoAnalyzer 3, Bran+Luebbe)测定;有效磷 (aP) 采用NaHCO3浸提,钼锑抗比色法。研究区域土壤基本理化性质如表2所示。
1.3.2 土壤微生物群落PLFAs测定
PLFA的提取和纯化参考Bligh and Dyer法[19-21],上机前用1 mL含内标物19∶0的正己烷溶解吹干的脂肪酸甲酯,然后进行GC-FID (Agilent 6850N) 检测,脂肪酸种类通过脂肪酸 Sherlock 微生物鉴定系统 (MIDI Inc., Newark, DE, USA) 来鉴定。PLFAs含量基于19∶0内标计算,分析中仅包括碳链数低于 20、摩尔百分比 (mol%) 含量大于1% 且在多数样品中都有出现的脂肪酸。细菌 (B) 以14∶0、i14∶0、i15∶0、a15∶0、15∶1ω6c、i16∶0、16∶1ω7c、16∶1ω9c、i17∶0、a17∶0、17∶1ω8c、16∶1 2OH、cy17∶0、18∶1ω5c、cy17∶0和cy19∶0 C11-12等15种脂肪酸表示[20, 22],真菌 (F) 用18∶2ω6c脂肪酸来估计[22],菌根真菌 (AMF) 以16∶1ω5c表示[23],真菌∶细菌比 (F∶B) 用真菌(F)与AMF的总量/细菌(B)。研究区域土壤PLFA主要类群含量如表2所示。
1.3.3 土壤生态酶活性测定
4种酶活性(BG、NAG、AP和LAP)的测定均采用96微孔酶标板板荧光分析法[24-25],具体如下:称取1 g鲜土至800 mL的广口烧杯中,加入125 mL,50 mmol的 Tris缓冲液(pH值调至每个10 m×10 m样方的平均值,约为7.5),涡旋震荡1 min,使用八通道移液器 (Eppendorf) 向96孔酶标板中加入200 μL土壤悬浮液(8个重复)。每个样品孔中加入50 μL,200 μmol/L的基底液(BG采用4-甲基伞形酮酰-β-D-吡喃葡糖酸苷 (4-MUB-β-D-glucoside) 为底物,NAG采用4-甲基伞形酮酰-β-D-吡喃葡糖酸苷 (4-MUB-N-acetyl-b-D-glucosaminide) 为底物,LAP采用L-亮氨酸-7-氨基-4-甲基香豆素盐酸盐 (L-Leucine-7-amino-4-methylcoumarin) 为底物,AP采用4-甲基伞形酮磷酸酯 (4-MUB-phosphate) 为底物);空白孔中加入250 μL Tris缓冲液;样品控制孔中加入50 μL缓冲液和200 μL土壤悬浮液;基底控制孔中加入50 μL基底液和200 μL缓冲液。标准曲线设置:设置0, 0.5, 1, 2.5, 5, 10, 20, 30 μmol/L 8个浓度梯度的标准曲线(其中,LAP的标准曲线浓度梯度设置为0, 2, 4, 8, 16, 24, 32, 40 μmol/L),参考标准孔加入50 μL标准液和200 μL缓冲液(8个重复),猝灭标准孔中加入50 μL标准液和200 μL悬浮液 (2个重复)。
所有酶标板放置在黑暗的20 ℃培养箱中培养2.5 h。使用多功能酶标仪 (SynergyH4, BioTek) 进行荧光测定。仪器自动在每个孔加入10 μL 1 mol/L的NaOH溶液,1 min后进行荧光检测。MUB和AMC在365 nm波长处激发,在450 nm处检测荧光。酶活性计算如公式1所示:
Activity (nmol h-1g-1) = (净荧光值×Buffer vol)/(ε×Homogenate vol×Time×Soil mass)
(1)
式中,net fluorescence (净荧光值)= [(Assay -Homogenate Control)/Quench coefficient]-Substrate control,Quench coefficient (猝灭系数)= (Quench control -Homogenate control) /Standard Fluorescence,ε为猝灭标准曲线的斜率,Time为培养时间,Soil mass (g) 为土壤干重。4个样地灌丛与空地中土壤酶活性值见表2。
1.4 数据分析
C∶N酶活性比,通过BG∶(NAG+LAP)计算;C∶P酶活性比,通过BG∶AP计算;N∶P酶活性比采用(NAG+LAP)∶AP计算[5]。样地内灌丛与空地间土壤生态酶活性比的差异采用T-检验。灌丛和空地土壤生态酶活性比在不同样地间的差异使用单因素方差分析(One-way ANOVA),结合SNK多重比较方法进行探讨。以上分析均通过了残差正态和方差齐质性检验。
使用标准主轴回归(Standardized major axis, SMA)探讨BG、NAG、LAP和AP 4种酶活性之间的关系,以及这种关系在不同样地之间以及灌丛与空地之间的变异。标准主轴回归相比与最小二乘法(Ordinary least squares, OLS)回归,更加适用于X和Y(解释变量与响应变量)均是随机的情况[26]。SMA回归采用R 3.0.1软件的“smatr”程序包中的“sma”函数,该函数允许检验不同斜率之间的差异性[27]。
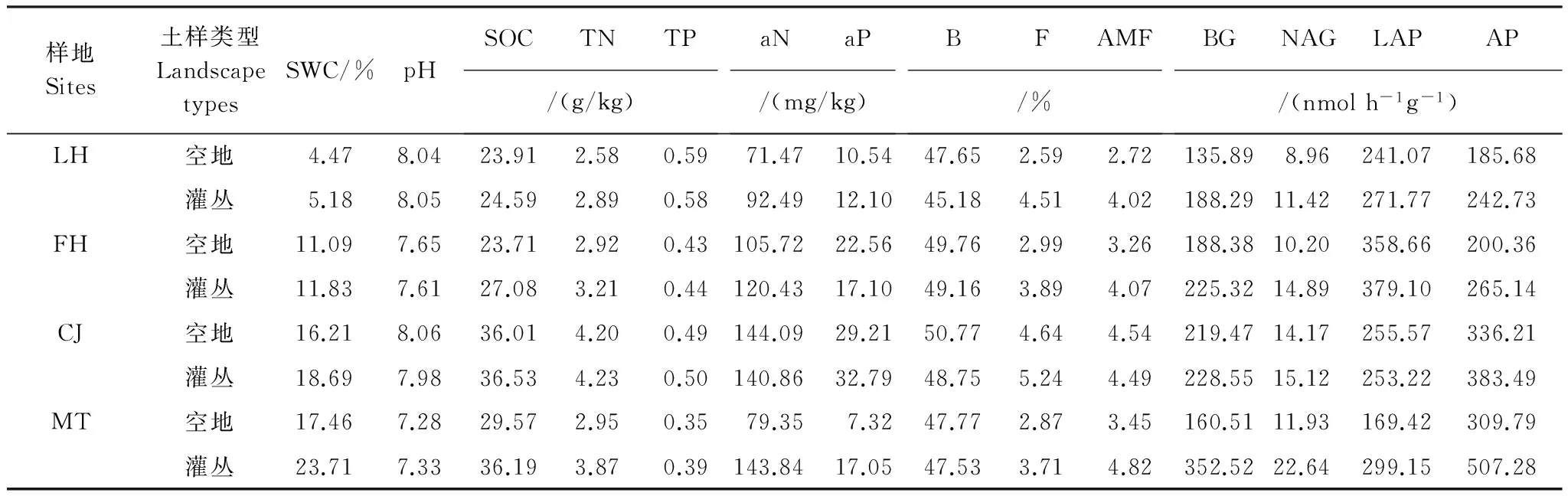
表2 4个样地,空地与灌丛土壤基本理化性质、微生物生物量和生态酶活性(平均值,样本量n=15—18)
为进一步探讨影响酶活性分配(由酶活性比指示)的土壤和微生物因子,使用了Pearson 相关分析检验了酶活比与土壤基本理化性质和微生物群落组成因子之间的关系。由于之前的研究表明,该研究区域中,土壤含水量(SWC)对土壤微生物群落组成和生态酶活性具有重要影响,使用了逐步回归分析,以期验证SWC是否也是驱动酶活性比的重要因子。
2 结果与分析
2.1 不同样地间、样地内灌丛与空地间土壤生态酶活性比变异
灌丛和空地土壤在不同样地间都具有显著差异(图1)。总体上来说,CJ和MT具有相对较高的BG∶(NAG+LAP)值和较低的BG∶AP和(NAG+LAP)∶AP值;LH和FH具有相对较低的BG∶(NAG+LAP)值和较高的BG∶AP和(NAG+LAP)∶AP值。
样地内,灌丛与空地之间酶活性比的变异要小的多(图1),BG∶(NAG+LAP)与BG∶AP仅在MT表现出显著差异,(NAG+LAP)∶AP也仅在FH表现出显著差异。
2.2 不同样地间、样地内土壤生态酶活性回归分析
SMA回归分析表明,整体上ln(BG)与ln(NAG+LAP)和ln(AP)之间有较好的线性关系(Slope=1.516 (r2=0.291) & 1.049 (r2=0.579)),而ln(NAG+LAP)与ln(AP)无显著线性关系(图2)。进一步的斜率检验表明,灌丛下和空地中土壤酶活性之间的线性模型斜率之间无显著差异,且与总体的斜率也没有显著差异(图2,表4)。
对各样地分别进行的SMA回归分析表明,样地之间酶活性比斜率的差异主要存在于LH、FH和CJ、MT之间。对于ln(BG) vs. ln(NAG+LAP), FH样地的SMA回归斜率显著高于CJ样地和总体的斜率(Slope = 2.516 vs. 1.326 & 1.516);对于ln(BG) vs. ln(AP),CJ和MT样地的斜率要显著的高于LH样地和总体的斜率(Slope=1.659 & 1.756 vs. 0.942 & 1.049);对于ln(NAG+LAP) vs. ln(AP),LH和FH样地的斜率显著低于CJ和MT样地(Slope=0.494 & 0.548 vs. 1.251 & 1.217)。
2.3 影响酶活性比变异的主要因子
2.2节的分析表明,灌丛和空地土壤生态酶活性比的分布规律无明显的差异,因此本节的相关分析和回归分析将灌丛和空地作为一个整体进行分析。Pearson相关分析表明,ln(BG)∶ln(NAG+LAP)与SWC、SOC、C∶P、AMF、F∶B、TN、N∶P等因子都表现出极显著的正相关关系(表4)。与此相反的是,ln(NAG+LAP)∶ln(AP)与SWC、SOC、C∶P、N∶P、AMF、F∶B、TN等因子呈现极显著的负相关关系。而ln(BG)∶ln(AP)则未与本研究中任何因子表现出显著的相关关系。
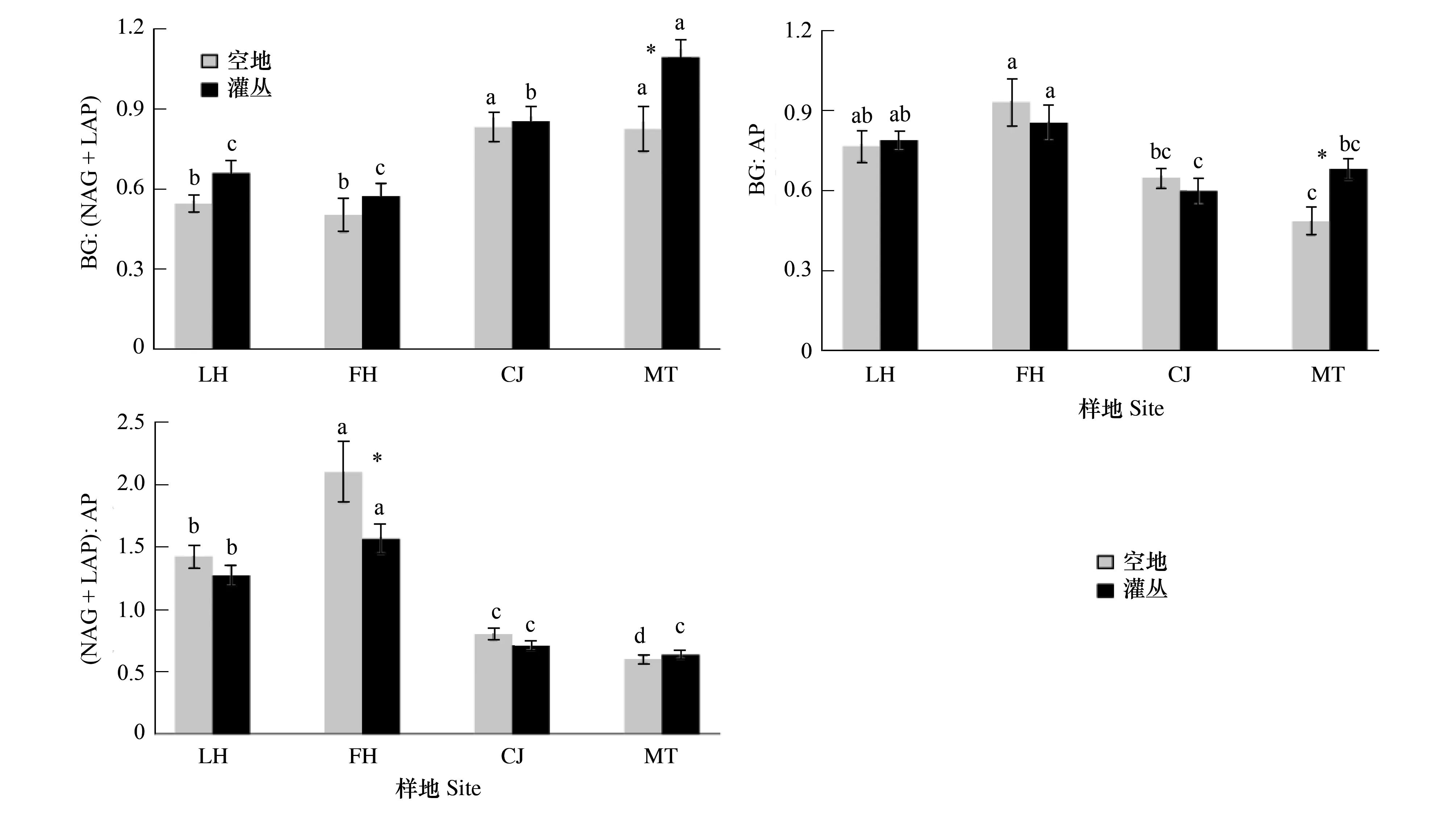
图1 不同样地间、样地内灌丛与空地土壤生态酶活性比变异 (平均值±标准差,样本量n=15-18)Fig.1 The variation of soil enzymatic ratios in the soils under shrub canopies and in the shrub-interspaces (Gap) across the four sites (mean ± sd, n=15—18)BG:(NAG+LAP)表示碳氮酶活性比;BG:AP表示碳磷酶活性比;(NAG+LAP):AP 表示氮磷酶活性比;LH: 两河口(Lianghekou), FH: 飞虹(Feihong), CJ: 撮箕(Cuoji), MT:牟托(Moutuo);图中小写字母表示不同样地间空地或灌丛土壤胞外酶活性比存在显著性(P<0.05),*表示灌丛与空地间土壤胞外酶活性比存在显著差异(P<0.05)
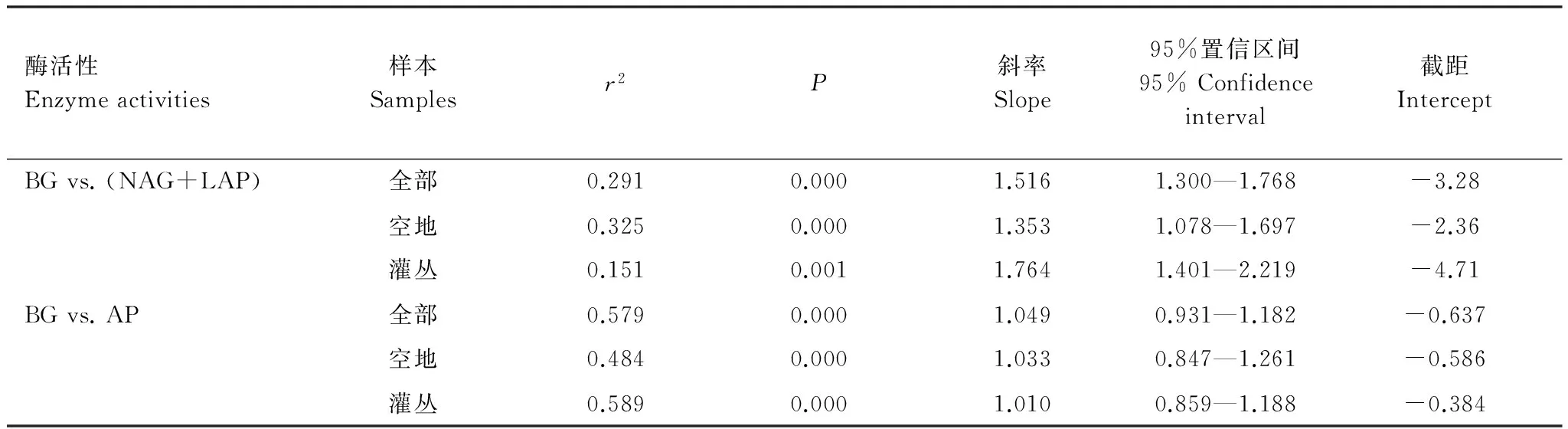
表3 不同样地间灌丛下和空地中几种土壤生态酶活性关系的标准主轴分析
进一步的逐步回归分析表明,SWC、SOC、AMF、TP和C∶P共同解释了ln(BG)∶ln(NAG+LAP) 50.27%的变异,其中SWC、AMF和C∶P依次解释了其中28.05%、24.38%和21.82%的变异,而在相关分析中有良好表现的SOC则只解释了其中14.6%的变异。对于ln(NAG+LAP)∶ln(AP),SWC、N∶P、C∶N和F∶B共同解释了51.56%的变异,其中SWC单独即解释了其中41.26%的变异,其次是N∶P比和C∶N比,分别解释了27.33%和22.47%的变异。而对于ln(BG)∶ln(AP),C∶P则是唯一具有显著影响的因子,解释了9.38%的变异,尽管在相关分析中并为发现它们之间显著的线性关系。
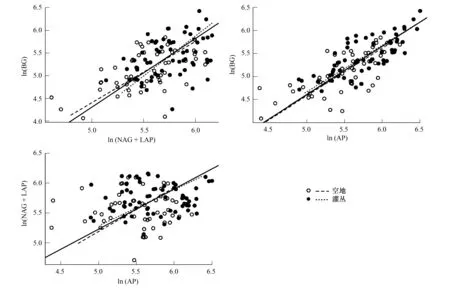
图2 不同样地间土壤C、N、P酶活性之间的标准主轴回归分析Fig.2 Standardized major axis regressions of the C-, N-, and P-related soil extracellular enzyme activities across the four sites图中虚线、点线和实现分别表示的是对灌丛(样本量n=65)、空地(样本量n=57)和全部数据(样本量n=122)的回归拟合分析,数据经自然对数转换(ln);BG: β-1,4-葡萄糖苷酶 β-1,4-glucosidase; NAG: β-1,4-N-乙酰葡糖氨糖苷酶 β-1,4-N-acetylglucosaminidase; LAP: 亮氨酸氨基肽酶 leucine aminopeptidase; AP:碱性磷酸酶 acid or alkaline phosphatase
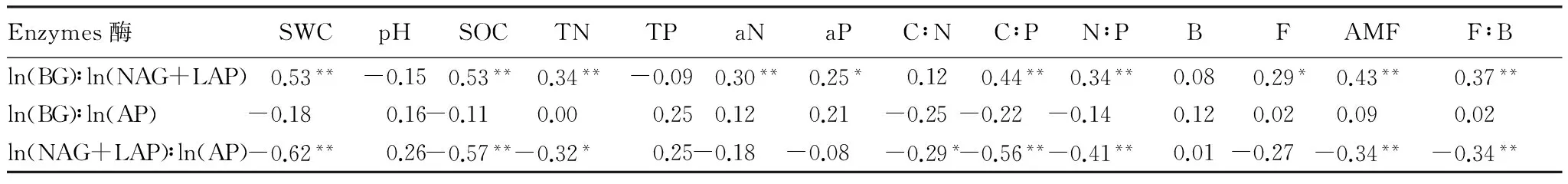
表4 土壤生态酶活性比与土壤理化性质和微生物群落组成因子间的Pearson相关分析
3 讨论
3.1 养分限制
土壤酶是分解土壤有机质的主力,其活性可以为探讨土壤养分限制提供一些有价值的信息[11, 28]。全球尺度上,土壤BG∶(NAG+LAP)比为1.41,BG∶AP比为0.62,(NAG+LAP)∶AP比为0.44[5]。本研究区域中,BG∶(NAG+LAP)的平均值为0.73,明显小于1.41的全球平均值; (NAG+LAP)∶AP的平均值为1.15,也显著的高于全球均值(1.15 vs. 0.44[5])。这意味着该区域土壤整体具有相对较高的N分解胞外酶活性(基于全球尺度),从而或许也从侧面反映了土壤N元素的相对缺乏,使得微生物需要生产更多的N分解酶,以满足自身代谢的需要。以往的研究中发现,该地区水分和P是限制植物生长的第一和第二限制因子,而N则无显著的限制作用[29-30]。但由于该区域大多数的研究针对的是植物,缺乏对微生物生长代谢限制性因子的研究。本研究从生态酶化学计量学的角度,为研究岷江干旱河谷灌丛群落土壤微生物生长代谢的限制性因子,提供了一个参考。
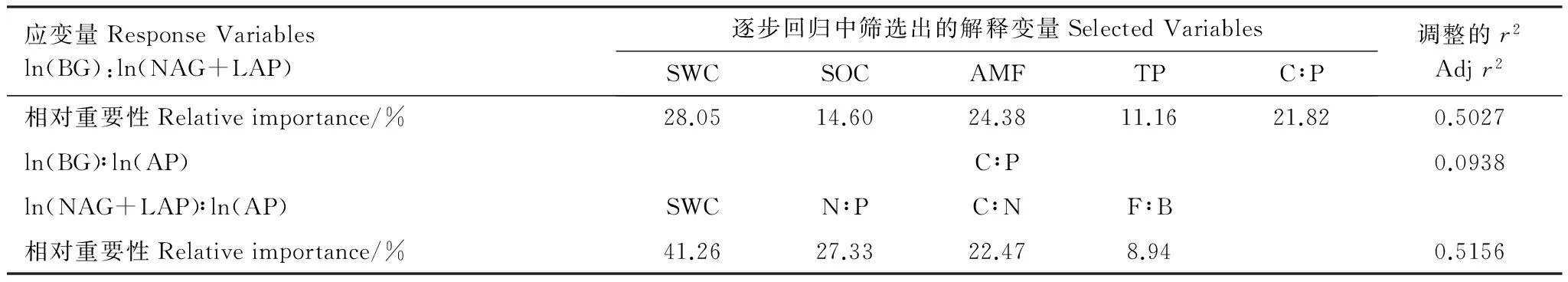
表5 影响土壤生态酶活性比变异的土壤物理化学和微生物因子的逐步回归分析
从各样地情况来看,LH和FH 2个样地微生物生长的N限制作用可能更为突出(BG∶(NAG+LAP)=0.60 & 0.54 vs. 1.41; (NAG+LAP)∶AP=1.34 & 1.79 vs. 0.44),而这2个样地也正是本研究中2个相对更为干旱的样地。从表2中也可看出,LH和FH 2个样地TN和aN也相对较低。较低的N有效性加上较低的水分有效性的进一步限制,造成了这2个样地相对明显的N限制作用。而对于本研究中相对湿润的CJ和MT样地,则较LH和FH具有相对较低的BG∶AP活性比和显著低的(NAG+LAP)∶AP活性比,这说明CJ和MT样地微生物生长可能存在一定的P限制。
由于灌丛的存在,灌丛下土壤较空地土壤可以获取更多的有机质输入(凋落物、根系分泌物等),提高土壤养分有效性,从而进一步作用于土壤酶活性以及酶活性化学计量。本研究中尽管总体上灌丛与空地土壤酶活性比之间无显著差异,但在MT和FH 2个样地也观测到灌丛的显著作用(图1)。MT样地灌丛下更高的C∶N和C∶P酶活性比,或反映了空地中土壤微生物相对更高的N、P功能发挥;FH样地空地中显著高的N∶P酶活性比,也指示着空地土壤微生物更高的N资源功能发挥(相对于P)。FH样地空地中土壤TN和aN含量都明显低于灌丛土壤 (TN: 2.92 vs. 3.21 g/kg,aN:105.72 vs. 120.43 mg/kg),而TP则几乎与灌丛土壤相等 (0.43 vs. 0.44 g/kg),aP含量甚至高于灌丛土壤(22.56 vs. 17.10 mg/kg);对于MT样地,空地中土壤TN、aN和aP 都极显著地低于灌丛土壤(TN: 2.95 vs. 3.87 g/kg,aN:79.35 vs. 143.84 mg/kg,aP: 7.32 vs. 17.05 mg/kg)。这些养分资源含量数据都进一步的佐证了本文的判断。尽管空地中SOC也较灌丛下低(FH & MT),但相比与N、P来说,SOC对于土壤微生物来说可能是相对充裕的。
3.2 酶活性关系特征
全球尺度上,C∶N∶P酶活性比大体呈现1∶1∶1的尺度关系,反映了C、N、P循环之间的一种耦合关系[5]。本研究中,不同样地间C∶N酶活性SMA回归斜率显著高于全球尺度上的C∶N酶活性SMA回归斜率(Slope=1.5 vs. 1.02),而C∶P酶活性回归斜率则与全球尺度的相当(Slope=1.03 vs. 1.04),C∶N∶P酶活性比大致为3∶2∶3,这反映了岷江干旱河谷地区相对不同的C、N、P循环特征。
样地间,灌丛与空地土壤生态酶活性化学计量特征的相似性(图2),指示着灌丛与空地土壤微生物C、N、P需求和C∶N∶P化学计量的相似性,这可以从各样地中灌丛与空地之间SOC、TN和TP含量的较小差异得到反映(表2)。因此,这说明本研究的假设(1)没有得到支持。而已有研究表明,灌丛与空地,这2个看似生物地球化学循环独立的存在[31],可能通过地下复杂的真菌网络有机地联系起来[32-33],从而可能造成灌丛与空地间相似的酶活性化学计量特征。
3.3 影响酶活性化学计量特征的土壤理化和微生物因子
土壤酶活性化学计量受土壤C、N、P资源的有效性的调控。本研究中,土壤C∶N与BG∶(NAG+LAP)之间未表现出显著相关性,土壤C∶P比与BG∶AP仅呈弱的正相关关系,唯有土壤N∶P比与N∶P酶活性比表现出极显著的负相关关系。一方面,这或许说明土壤酶活性比不能很好地反映土壤有机质的元素组成。土壤酶来自于土壤微生物,其相对活性或许更多的反映土壤微生物生物量的元素组成。而另一方面,其他土壤生物或非生物因子或许对酶活性比的变异有着更为强烈的影响,从而掩盖了酶活性比与土壤元素组成的相关性。事实上,相关分析表明,SWC、SOC、TN、C∶P、AMF以及F∶B均与土壤C∶N和C∶P酶活性比呈极显著相关,这些因子共同驱动着酶活性比的分布。然而,本研究中涉及到的土壤因子均不能很好地解释C∶P酶活性比的变异。造成这种结果的原因,可能是某些未测量的环境因子,如土壤温度、团聚体、土壤有机酸、空间自相关等更为强烈的影响C∶P酶活性比的变异[34-36]。
本研究充分证明了第二个假设:土壤酶活性化学计量特征与土壤C、N、P养分有效性之间的关系受到土壤水分有效性的调控。逐步回归反映了SWC是影响BG∶(NAG+LAP)和(NAG+LAP)∶AP变异的最主要因子。事实上,当以SWC作为协变量进行偏回归分析,SOC、C∶P、N∶P、AMF等与酶活性比显著相关的因子的显著性都未能通过显著性检验(数据未展示)。这反映了土壤水分有效性在岷江干旱河谷地区土壤养分循环中的决定性作用。SWC与BG∶(NAG+LAP)呈正相关关系,而与(NAG+LAP)∶AP呈负相关关系,即SWC的降低,C∶N酶活性比降低,N∶P酶活性比升高,从而说明,SWC的降低,将造成N分解酶活性的“相对升高”。这或许是因为干旱加剧了N的有效性,而另一方面,酶活性更多的是反映微生物为获取养分资源而进行的一种功能发挥,N分解酶活性的“相对升高”,或许反映了微生物需要将更多的功能发挥转向N的摄取上,以维持自身C∶N∶P生物量的平衡。从表2中可见,LH和FH 2个相对干旱的样地,其N的有效性也相对降低。气候变化研究认为,未来气候变化将对干旱生态系统施加严重的压力,表现为温度升高、降雨减少、降雨强度和频度变化[37]。已有研究认为,在快速气候变化背景下,由于生物和地球化学过程对不同元素所施加的控制程度不同,C、N、P循环可能会发生解耦合现象[31, 38-42]。因此,未来气候变化,特别是降雨量的减少将有可能进一步限制岷江干旱河谷区域土壤N的有效性,强烈改变本区域的C、N、P循环的耦合关系。
土壤生态酶活性化学计量不仅可以反映土壤养分资源的有效性,也可以指示微生物群落结构和养分需要的变化[5]。相关分析和逐步回归分析显示,AMF、F∶B比与酶活性比呈显著相关,其中AMF更是除SWC外,影响BG∶(NAG+LAP)变异的最重要因子(表4,表5)。本研究中AMF和F∶B与BG∶(NAG+LAP)呈现正相关,与(NAG+LAP)∶AP呈现负相关,而Bragazza 等对泥炭地的研究中也发现,C∶N和C∶P酶活性比随F∶B比的升高而升高,而N∶P酶活性比则随着F∶B的升高而降低[43]。这说明微生物群落结构的变化和土壤真菌类群,特别是AMF的相对富集有利于BG酶和AP酶活性的相对提高。研究亦表明,真菌相比于细菌具有更高的C资源需求[44];当土壤N∶P比较高时,真菌的生长易受到P的限制[45],从而促使真菌生产更多的磷酸酶以获取更多的P,维持自身N、P的平衡。因此,本研究结果反映了土壤真菌群落在岷江干旱河谷地区C、P循环中的重要地位,反之,则说明了土壤细菌类群在岷江干旱河谷地区N循环中的重要作用,这与黄元元、王冰冰的研究结果是一致的[46-47]。
3.4 本研究的不足
本研究中,没有观测到不同样地尺度上,N、P酶活性之间显著的线性关系,这在一定程度上降低了关于C∶N∶P酶活性化学计量特征讨论的效力。其原因,大概有两点:其一,ln(NAG+LAP)可能不是表征N分解酶活性的良好指标。从表2中可见,NAG酶活性相对其他3种酶活性值非常的低,从而ln(NAG+LAP)值受LAP的影响很大,其与BG或AP酶活性的尺度关系,基本上与LAP和BG或AP的关系一致;而对这4种酶活性的相关分析表明,NAG、BG和AP 3种酶活性之间有着极显著的正相关关系,LAP则与这3种酶活性之间无显著相关关系。Sinsabaugh 等的对全球24个生态系统土壤酶活性的主成分分析,发现LAP呈现出与NAG、BG和AP截然不同的分布特征[11]。另一方面,造成这种现象的原因可能与检测方法有关。NAG、BG和AP 3种酶活性检测的基质和标准物质都是基于MUB的,而LAP则是基于AMC的,从而这种方法学上的差异,可能造成了LAP与其他酶活性之间的解耦合。
4 结论
本研究反映了岷江干旱河谷区域土壤酶活性化学计量特征的相对特异性。灌丛与空地土壤酶活性化学计量特征表现出一定的相似性。岷江干旱河谷区域整体上存在一定的N限制,而对于个样地来说,相对干旱的样地N限制更为明显,而相对湿润的样地则又表现出一定的P限制。这种样地之间的差异性,主要受到土壤含水量的调控。土壤含水量的降低,促使土壤N分解酶活性的相对升高,从而意味着未来可能的降水降低,或将加剧本区域的N限制。
[1] Burns R G, Dick R P. Enzymes in the Environment: Activity, Ecology and Applications. New York: Marcel Dekker Inc., 2002.
[2] Hill B H, Elonen C M, Jicha T M, Bolgrien D W, Moffett M F. Sediment microbial enzyme activity as an indicator of nutrient limitation in the great rivers of the Upper Mississippi River basin. Biogeochemistry, 2010, 97(2/3): 195-209.
[3] Moorhead D L, Sinsabaugh R L. A theoretical model of litter decay and microbial interaction. Ecological Monographs, 2006, 76(2): 151-174.
[4] Schimel J P, Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: a theoretical model. Soil Biology and Biochemistry, 2003, 35(4): 549-563.
[5] Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment. Nature, 2009, 462(7274): 795-798.
[6] Sinsabaugh R L, Moorhead D L. Resource allocation to extracellular enzyme production: a model for nitrogen and phosphorus control of litter decomposition. Soil Biology and Biochemistry, 1994, 26(10): 1305-1311.
[7] Allison S D, Weintraub M N, Gartner T B, Waldrop M P. Evolutionary-economic principles as regulators of soil enzyme production and ecosystem function. Soil Enzymology, 2011, 22: 229-243.
[8] Allison V J, Condron L M, Peltzer D A, Richardson S J, Turner B L. Changes in enzyme activities and soil microbial community composition along carbon and nutrient gradients at the Franz Josef chronosequence, New Zealand. Soil Biology and Biochemistry, 2007, 39(7): 1770-1781.
[9] Olander L P, Vitousek P M. Regulation of soil phosphatase and chitinase activity by N and P availability. Biogeochemistry, 2000, 49(2): 175-191.
[10] Zeglin L H, Sinsabaugh R L, Barrett J E, Gooseff M N, Takacs-Vesbach C D. Landscape distribution of microbial activity in the McMurdo dry valleys: linked biotic processes, hydrology, and geochemistry in a cold desert ecosystem. Ecosystems, 2009, 12(4): 562-573.
[11] Sinsabaugh R L, Lauber C L, Weintraub M N, Ahmed B, Allison S D, Crenshaw C, Contosta A R, Cusack D, Frey S, Gallo M E, Gartner T B, Hobbie S E, Holland K, Keeler B L, Powers J S, Stursova M, Takacs-Vesbach C, Waldrop M P, Wallenstein M D, Zak D R, Zeglin L H. Stoichiometry of soil enzyme activity at global scale. Ecology Letters, 2008, 11(11): 1252-1264.
[12] Maestre F T, Quero J L, Gotelli N J, Escudero A, Ochoa V, Delgado-Baquerizo M, García-Gómez M, Bowker M A, Soliveres S, Escolar C, García-Palacios P, Berdugo M, Valencia E, Gozalo B, Gallardo A, Aguilera L, Arredondo T, Blones J, Boeken B, Bran D, Conceição A A, Cabrera O, Chaieb M, Derak M, Eldridge D J, Espinosa C I, Florentino A, Gaitán J, Gatica M G, Ghiloufi W, Gómez-González S, Gutiérrez J R, Hernández R M, Huang X W, Huber-Sannwald E, Jankju M, Miriti M, Monerris J, Mau R L, Morici E, Naseri K, Ospina A, Polo V, Prina A, Pucheta E, Ramírez-Collantes D A, Romão R, Tighe M, Torres-Díaz C, Val J, Veiga J P, Wang D L, Zaady E. Plant species richness and ecosystem multifunctionality in global drylands. Science, 2012, 335(6065): 214-218.
[13] Schlesinger W H, Raikes J A, Hartley A E, Cross A F. On the spatial pattern of soil nutrients in desert ecosystems. Ecology, 1996, 77(2): 364-374.
[14] Ben-David E A, Zaady E, Sher Y, Nejidat A. Assessment of the spatial distribution of soil microbial communities in patchy arid and semi-arid landscapes of the Negev Desert using combined PLFA and DGGE analyses. FEMS Microbiology Ecology, 2011, 76(3): 492-503.
[15] Thompson T L, Zaady E, Pang H C, Wilson T B, Martens D A. Soil C and N pools in patchy shrublands of the Negev and Chihuahuan Deserts. Soil Biology and Biochemistry, 2006, 38(7): 1943-1955.
[16] Austin A T, Yahdjian L, Stark J M, Belnap J, Porporato A, Norton U, Ravetta D A, Schaeffer S M. Water pulses and biogeochemical cycles in arid and semiarid ecosystems. Oecologia, 2004, 141(2): 221-235.
[17] 冶民生, 关文彬, 谭辉, 马克明, 刘国华, 汪西林. 岷江干旱河谷灌丛α多样性分析. 生态学报, 2004, 24(6): 1123-1130.
[18] 王春明, 包维楷, 陈建中, 孙辉, 谢嘉穗. 岷江上游干旱河谷区褐土不同亚类剖面及养分特征. 应用与环境生物学报, 2003, 9(3): 230-234.
[19] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917.
[20] Waldrop M P, Balser T C, Firestone M K. Linking microbial community composition to function in a tropical soil. Soil Biology and Biochemistry, 2000, 32(13): 1837-1846.
[21] Wu Y P, Ding N, Wang G, Xu J M, Wu J J, Brookes P C. Effects of different soil weights, storage times and extraction methods on soil phospholipid fatty acid analyses. Geoderma, 2009, 150(1/2): 171-178.
[22] Frostegård A, Tunlid A, Bååth E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals. Applied and Environmental Microbiology, 1993, 59(11): 3605-3617.
[23] Kourtev P S, Ehrenfeld J G, Häggblom M. Exotic plant species alter the microbial community structure and function in the soil. Ecology, 2002, 83(11): 3152-3166.
[24] German D P, Weintraub M N, Grandy A S, Lauber C L, Rinkes Z L, Allison S D. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies. Soil Biology and Biochemistry, 2011, 43(7): 1387-1397.
[25] Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315.
[26] Legendre P, Legendre L. Numerical Ecology. 2nd ed. New York: Elsevier, 1998.
[27] Warton D I, Duursma R A, Falster D S, Taskinen S. Smatr 3-an R package for estimation and inference about allometric lines. Methods in Ecology and Evolution, 2012, 3(2): 257-259.
[28] Sinsabaugh R L, Follstad Shah J J. Ecoenzymatic stoichiometry and ecological theory. Annual Review of Ecology, Evolution, and Systematics, 2012, 43: 313-343.
[29] Song C J, Ma K M, Qu L Y, Liu Y, Xu X L, Fu B J, Zhong J F. Interactive effects of water, nitrogen and phosphorus on the growth, biomass partitioning and water-use efficiency ofBauhiniafaberiseedlings. Journal of Arid Environment, 2010, 74(9): 1003-1012.
[30] 宋成军, 马克明, 傅伯杰, 曲来叶, 刘杨, 钟剑飞. 岷江干旱河谷土壤水、氮和磷对小马鞍羊蹄甲幼苗生长的影响. 应用生态学报, 2009, 20(8): 1797-1804.
[31] Schlesinger W H, Reynolds J F, Cunningham G L, Huenneke L F, Jarrell W M, Virginia R A, Whitford W G. Biological feedbacks in global desertification. Science, 1990, 247(4946): 1043-1048.
[32] Jackson R B, Caldwell M M. The scale of nutrient heterogeneity around individual plants and its quantification with geostatistics. Ecology, 1993, 74(2): 612-614.
[33] Collins S L, Sinsabaugh R L, Crenshaw C, Green L, Porras-Alfaro A, Stursova M, Zeglin L H. Pulse dynamics and microbial processes in aridland ecosystems. Journal of Ecology, 2008, 96(3): 413-420.
[34] Steinweg J M, Dukes J S, Paul E A, Wallenstein M D. Microbial responses to multi-factor climate change: effects on soil enzymes. Frontiers in Microbiology, 2013, 4: 146-146.
[35] Ushio M, Balser T C, Kitayama K. Effects of condensed tannins in conifer leaves on the composition and activity of the soil microbial community in a tropical montane forest. Plant and Soil, 2013, 365(1/2): 157-170.
[36] Baldrian P, Merhautová V, Cajthaml T, Petránková M,najdr J. Small-scale distribution of extracellular enzymes, fungal, and bacterial biomass in Quercus petraea forest topsoil. Biology and Fertility of Soils, 2010, 46(7): 717-726.
[37] Intergovernmental Panel on Climate Change. Climate Change 2007: Synthesis Report. Geneva: IPCC, 2007.
[38] Finzi A C, Austin A T, Cleland E E, Frey S D, Houlton B Z, Wallenstein M D. Responses and feedbacks of coupled biogeochemical cycles to climate change: examples from terrestrial ecosystems. Frontiers in Ecology and the Environment, 2011, 9(1): 61-67.
[39] McGill W B, Cole C V. Comparative aspects of cycling of organic C, N, S and P through soil organic matter. Geoderma, 1981, 26(4): 267-286.
[41] Vicente-Serrano S M, Zouber A, Lasanta T, Pueyo Y. Dryness is accelerating degradation of vulnerable shrublands in semiarid Mediterranean environments. Ecological Monographs, 2012, 82(4): 407-428.
[42] Delgado-Baquerizo M, Maestre F T, Gallardo A, Bowker M A, Wallenstein M D, Quero J L, Ochoa V, Gozalo B, García-Gómez M, Soliveres S, García-Palacios P, Berdugo M, Valencia E, Escolar C, Arredondo T, Barraza-Zepeda C, Bran D, Carreira J A, Chaieb M, Conceição A A, Derak M, David J. Eldridge D J, Escudero A, Espinosa C I, Gaitán J, Gatica M G, Gómez-González S, Guzman E, Gutiérrez J R, Florentino A, Hepper E, Hernández R M, Huber-Sannwald E, Jankju M, Liu J S, Mau R L, Miriti M, Monerris J, Naseri K, Noumi Z, Polo V, Prina A, Pucheta E, Ramírez E, Ramírez-Collantes D A, Romão R, Tighe M, Torres D, Torres-Díaz C, Ungar E D, Val J, Wamiti W, Wang D L, Zaady E. Decoupling of soil nutrient cycles as a function of aridity in global drylands. Nature, 2013, 502(7473): 672-676.
[43] Bragazza L, Parisod J, Buttler A, Bardgett R D. Biogeochemical plant-soil microbe feedback in response to climate warming in peatlands. Nature Climate Change, 2013, 3(3): 273-277.
[44] Keiblinger K M, Hall E K, Wanek W, Szukics U, Hämmerle I, Ellersdorfer G, Böck S, Strauss J, Sterflinger K, Richter A, Zechmeister-Boltenstern S. The effect of resource quantity and resource stoichiometry on microbial carbon-use-efficiency. FEMS Microbiology Ecology, 2010, 73(3): 430-440.
[45] Güsewell S, Gessner M O. N: P ratios influence litter decomposition and colonization by fungi and bacteria in microcosms. Functional Ecology, 2009, 23(1): 211-219.
[46] 黄元元. 岷江干旱河谷灌木恢复对土壤肥力质量的影响 [D]. 北京: 中国科学院研究生院, 2011.
[47] 王冰冰, 曲来叶, 宋成军, 宫渊波. 岷江干旱河谷优势灌丛对土壤微生物群落组成的影响. 生态学报, 2015, 35(8):2481-2493.
Patterns of ecoenzymatic stoichiometry in the dominant shrubs in the semi-arid Upper Minjiang River Valley
WANG Bingbing1, 2, QU Laiye1,*, MA Keming1, ZHANG Xinyu3, SONG Chengjun4
1StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China2UniversityofChineseAcademyofSciences,Beijing100049,China3KeyLaboratoryofEcosystemNetworkObservationandModeling,InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China4ChineseAcademyofAgriculturalengineering,Beijing100125,China
The activities of soil ecoenzymes in relation to the mineralization of soil organic carbon, nitrogen, and phosphorus can reveal stoichiometric and energy limitations on the growth and metabolism of soil microbes. Despite the fact that arid and semi-arid ecosystems have received considerable attention in recent years, studies on the patterns of soil ecoenzymatic stoichiometry and the relationships among soil physiochemical and microbial community factors are still rare. In this study, we investigated the variations of soil physiochemical properties, microbial community composition, and EEAs by comparing soils in dominant shrubs and in the shrub-interspaces at four sites (Lianghekou, Feihong, Cuoji, and Moutuo). These study sites were expected to differ with respect to the level of water stress along the semi-arid valley in the upper Minjiang River, Sichuan province. The patterns of ecoenzymatic stoichiometry of C∶N∶P were different in the semi-arid Minjiang River valley as compared to those in the global pattern (C∶N∶P=3∶2∶2 vs. 1∶1∶1). Overall, there may be some degree of nitrogen limitation of microbial metabolism in this semi-arid region, which was supported by the relative activities of β-glucosidase compared to β-N-acetylglucosaminidase + leucine aminopeptidase and β-N-acetylglucosaminidase + leucine aminopeptidase to phosphatase. The different patterns of enzymatic stoichiometry between the soils in shrubs and in the shrub interspaces were not obvious. However, the limitation of C, N, and P resources in each individual site was somewhat site specific and may be due to the soil water availability. The two relatively drier sites (Lianghekou and Feihong) were more constrained by nitrogen availability, while the two relatively wetter sites (Cuoji and Moutuo) were more constrained by phosphorus availability. The variations of soil enzymatic stoichiometric patterns were affected by nutrient availabilities and soil water content as shown by the Pearson product-moment correlation analysis. The results of stepwise regression further revealed that the variations of enzyme ratios, such as C∶N and N∶P, were driven primarily by soil water content. Soil water content was positively correlated with the C∶N enzyme ratio and negatively correlated with the N∶P enzyme ratio. We also observed that arbuscular mycorrhizal fungi (AMF) and the fungi-to-bacteria ratio positively correlated with the C∶N enzyme ratio, but negatively with the N∶P enzyme ratio, which may imply that the enrichment of fungi and AMF communities will benefit C and P cycling by influencing enzyme activities. Our results suggest that any predicted decrease in soil water with climate change will probably further constrain the availability of N and P in this N-limited ecosystem in the semi-arid region. Moreover, this study also highlights the important role of fungi and AMF communities in meditating C and P cycling in this semi-arid region.
Minjiang River; semi-arid river valley; ecoenzymatic stoichiometry; nutrient availability; soil water content
国家自然科学基金(31170581, 41101270)
2014-01-27;
日期:2014-11-19
10.5846/stxb201401270202
*通讯作者Corresponding author.E-mail: lyqu@rcees.ac.cn
王冰冰, 曲来叶, 马克明, 张心昱, 宋成军.岷江上游干旱河谷优势灌丛群落土壤生态酶化学计量特征.生态学报,2015,35(18):6078-6088.
Wang B B, Qu L Y, Ma K M, Zhang X Y, Song C J.Patterns of ecoenzymatic stoichiometry in the dominant shrubs in the semi-arid Upper Minjiang River Valley.Acta Ecologica Sinica,2015,35(18):6078-6088.

