氮素添加和刈割对内蒙古弃耕草地土壤氮矿化的影响
刘碧荣, 王常慧, 张丽华, 董宽虎
1 中国科学院植物研究所, 植被与环境变化国家重点实验室, 北京 100093 2 山西农业大学动物科技学院, 太谷 030801
氮素添加和刈割对内蒙古弃耕草地土壤氮矿化的影响
刘碧荣1, 2, 王常慧1,*, 张丽华1, 董宽虎2
1 中国科学院植物研究所, 植被与环境变化国家重点实验室, 北京 100093 2 山西农业大学动物科技学院, 太谷 030801
以内蒙古多伦县恢复生态学试验示范研究站弃耕10余年的草地为研究对象,于2006年起分别设置对照、氮素添加、刈割和氮素添加+刈割4种处理,每种处理6次重复,研究弃耕草地氮素添加和刈割对土壤氮矿化的影响,结合土壤理化性质和植被地上生产力的动态变化,分析弃耕草地土壤氮矿化对植被恢复的响应,为当地草地恢复与重建提供理论依据和数据支持。实验结果表明:① 氮素添加显著增加了植物地上净初级生产力(ANPP)和土壤无机氮库,与对照相比分别提高115% 和196%,同时显著提高了土壤总硝化速率;但是氮素添加对总氨化速率、土壤微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量碳氮比(MBC/MBN)、微生物呼吸(MR)以及呼吸熵(qCO2)均无显著影响;② 总氨化速率和硝化速率对刈割处理的响应均不显著,但是刈割处理显著降低了土壤MR(P< 0.05);③ 氮素添加+刈割处理5—7a后,土壤总氨化和硝化速率均无显著变化;但是氮素添加+刈割处理显著增加了ANPP、土壤无机氮库和qCO2,同时显著降低了MBC和MBC/MBN。这说明在弃耕草地适应性管理中,氮素添加可以显著提高草地生产力,但是长期的氮添加对土壤微生物氮的转化是否有利还值得我们进一步研究。
氮素添加; 刈割; 草地; 微生物; 氮转化; 交互作用; 恢复
土壤氮矿化是在土壤微生物的作用下,土壤中的有机态氮转化为无机态氮的生物化学过程,决定着土壤氮素的可利用性[1]。微生物是土壤氮转化的主体,由微生物驱动的氮转化过程包括生物固氮作用、硝化作用、反硝化作用和氨化作用等[2-3]。其中,氨化与硝化反应是土壤氮转化的两个重要过程[4],不仅决定着地上植被对土壤有效氮的利用程度,同时与温室气体(如NO、N2O)排放和硝酸盐淋溶引起的水体污染等一系列生态环境问题直接相关。微生物生物量及其呼吸速率是衡量土壤微生物活性的重要指标[5-6]。
内蒙古草地是欧亚大陆植被类型的典型代表区域之一[7]。20世纪80年代以来,由于长期的超载过牧和过渡开垦,导致该地区草地植被严重退化,土壤的保水保墒能力下降,氮素的可利用性降低[8-9]。草地施氮肥在增加土壤无机氮库的同时可以显著提高地上生产力[7,10-12]。氮素添加对草地土壤氮矿化的影响随土壤养分含量、气候类型、施氮时间长短及其剂量的不同在各研究中结果不同。于占源等[13]认为沙质草地的土壤净氮矿化速率与硝化速率在添加氮素后显著增加,白洁冰等[14]发现氮素添加显著增加了高寒草原和高寒湿地的土壤氮矿化速率,从而促进土壤氮素转化,但张璐等[10]对内蒙古羊草草原研究发现低氮处理(5 g NH4NO3/m2)显著增加了土壤净氮矿化,而高氮处理(80 g NH4NO3/m2)则呈现相反趋势。Aber等[15]发现长期氮素添加降低了土壤的氮矿化速率。
添加氮肥增加了草地生产力,生产力增加后如何合理利用和管理草地?刈割是高产人工和天然草地主要的利用方式之一,可以为家畜储存冬季牧草。施氮和割草是否对草地养分循环有补偿效应?Robson等[16]指出刈割显著促进法国阿尔卑斯山地草地植物的氮素吸收,降低微生物生物量碳氮比,从而提高土壤氮素的转化速率。而Wang等[17]发现刈割在增加土壤温度的同时降低了土壤水分含量,导致微生物活性降低,土壤氮转化速率下降,但刈割+氮素添加则显著增加了微生物活性,土壤微生物氮转化速率提高。目前,刈割对天然草地和人工草地土壤氮转化影响的研究报道较多[16-17],但关于刈割对我国弃耕草地土壤氮矿化的研究还未见报道。另外,刈割从草地生态系统中带走部分氮素,而氮素添加和刈割交互作用对土壤氮矿化的影响还不清楚[17]。因此,选择内蒙古多伦县弃耕后以C4植物为优势种的草地开展了氮素添加和刈割处理的实验,旨在探讨土壤氮矿化对氮素添加和刈割的响应,以期更好地掌握施氮和刈割对草地氮矿化可能的影响机制,并为我国退化草地的恢复提供科学依据。
1 材料与方法
1.1 自然概况
野外实验在中国科学院植物研究所多伦恢复生态学试验示范研究站(42°02′N,116°17′E)进行。该地区海拔高度约为1324 m,属于半干旱草原气候,冬季寒冷干燥,夏季温和湿润。年均气温2.1 ℃,月平均温度从1月的-17.5 ℃到7月的18.9 ℃;年降水量385.5 mm左右,主要降水发生于5—9月,占全年降水量的86%左右[18]。植物的平均生长季为150 d,该区域优势种白草(Pennisetumcentrasiaticum)和克氏针茅(Stipakrylovii),土壤类型为栗钙土[18]。
1.2 实验设计
样地布置采用完全随机区组设计,共设置24个4 m × 4 m小区,各区间有2 m缓冲带,4种处理依次为对照(Control)、氮素添加(N addition)、刈割(Mowing)和氮素添加+刈割(N addition + Mowing),每种处理6次重复。样地于20世纪60年代开始耕作,1995年退耕撂荒自然恢复草地植被,并未进行任何方式的管理利用,2005年围栏;2006—2012年间,每年在7月中旬(该区域刚进入雨季)添加氮素NH4NO3(10 g N/m2)。氮素添加是将NH4NO3与少量洗涤干净的细砂混匀后撒施于对应的实验样地;刈割在每年8月底进行,移除植物地上部分,留茬高度为3 cm。
1.3 样品采集
2011—2013年8月中旬,采用5 cm的土钻对0—10 cm土壤进行取样,每个小区设置5个取样点,每个样地的样品混合均匀后装入封口袋中带回实验室。土壤样品在室内过筛处理(2 mm土壤筛)后,手工挑出可见的粗根和杂质;约100 g经过预处理的土壤样品风干处理,其余土壤样品在4 ℃保存。在每个小区的对角线上,随机布置0.2 m × 1 m的样方,齐地面剪取植物地上部分,烘干称重后获得草地地上净初级生产力(ANPP)。
1.4 指标测定
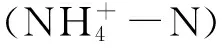
土壤微生物生物量采用Joergensen 和Mueller[20]及Brookes等[21]的CHCI3熏蒸-K2SO4浸提法,浸提液中的微生物生物量碳(MBC)用重铬酸钾外加热氧化法,微生物生物量氮(MBN)用半微量凯氏定氮法。
土壤微生物呼吸(MR)采用静态碱液吸收法测定[22]:称取20 g过筛土装入500 mL玻璃烧瓶,摇晃瓶口使土样平铺于瓶底,同时用移液枪向与玻璃烧瓶连接的试管中注入5 mL 0.5 mol/L NaOH溶液,瓶口用橡皮塞密闭,置于25 ℃恒温培养箱培养7 d;然后抽取2 mL NaOH溶液,注入2 mL 1 mol/L BaCI2,形成白色沉淀,再注入2—3滴酚酞指示剂,溶液呈现红色;最后用0.05 mol/L HCI滴定,直到红色恰好消失,记录盐酸的消耗量。
微生物呼吸熵(qCO2)的测定参照Wardle和Ghani[23]的方法:公式为qCO2(mg CO2-C g-1Cmicrobialh-1)=MR × 培养天数/MBC/(培养天数 × 24 h) × 1000,式中MR为每天每千克土壤呼吸放出CO2的毫克数。

1.5 数据处理与统计分析
采用Microsoft Excel初步整理和计算数据,用SAS9.0单因素方差分析(One-way ANOVA)实验样地的基本信息,用Duncan′s多重比较差异显著性。3因素方差分析(Three-way ANOVA)年份、氮素添加和刈割间的交互作用,并线性回归(Linear regression)分析SM、土壤MBC、MBN、MR、qCO2、总氨化和硝化速率等指标间的相关性。
2 结果
2.1 基本信息
2012年施氮和刈割处理后,施氮显著增加土壤有机碳、全氮以及植物全氮含量(P< 0.05),但土壤pH值呈减低趋势,比对照减少0.68。刈割对样地的各种指标均没有显著影响,但与氮素添加相比,刈割显著降低了土壤有机碳和全氮含量,同时增加土壤pH值(P< 0.05)。氮素添加+刈割处理显著提高植物全氮含量,但降低了土壤pH值和真菌/细菌(P< 0.05);土壤全氮含量在氮素添加后显著高于氮素添加+刈割处理;植物全氮含量在刈割后显著低于氮素添加+刈割处理,但土壤pH值显著增加(P< 0.05)(表1)。
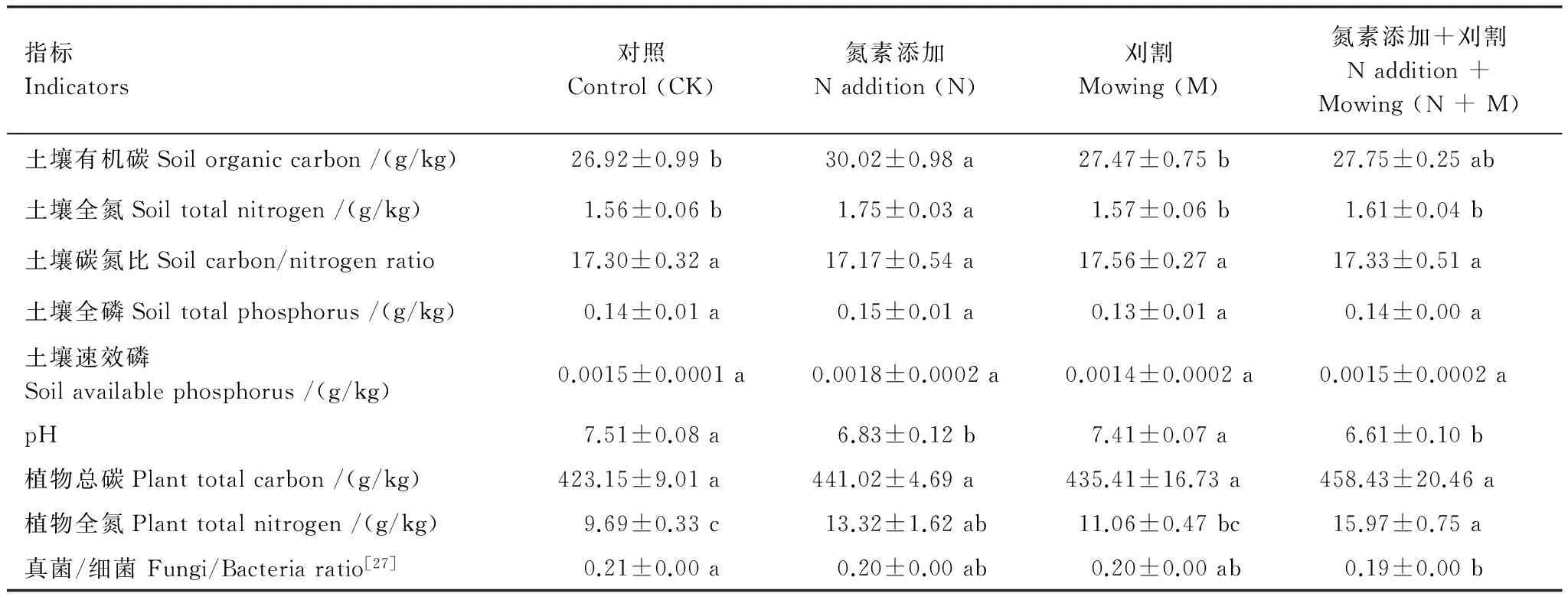
表1 2013年不同实验处理中植物-土壤-微生物的基本信息
2.2 氮素添加和刈割对土壤含水量的影响
土壤含水量在不同年际间的差异极显著(F= 341.58,P< 0.01),2012年土壤含水量极显著高于2011和2013年,2013年极显著高于2011年的土壤含水量(P< 0.01)(图1)。氮素添加对土壤含水量没有显著影响,刈割与对照相比仅在2013年极显著降低了土壤含水量(P< 0.01)。氮素添加、刈割以及氮素添加+刈割不同处理间的土壤含水量均没有显著差异(P> 0.05)。
2.3 氮素添加和刈割对地上净初级生产力的影响
地上净初级生产力(ANPP)受年降雨量的影响,不同年际间差异达到极显著水平(P< 0.01)(图2)。氮素添加极显著提高ANPP(P< 0.01),比对照增加了115%;刈割对ANPP没有显著影响(P> 0.05),但与氮素添加相比,ANPP在刈割后减少了41%;刈割和氮素添加的交互作用使ANPP显著提高72%(F= 20.29,P< 0.01),但刈割降低了氮素添加对ANPP的正效应(P< 0.01)。
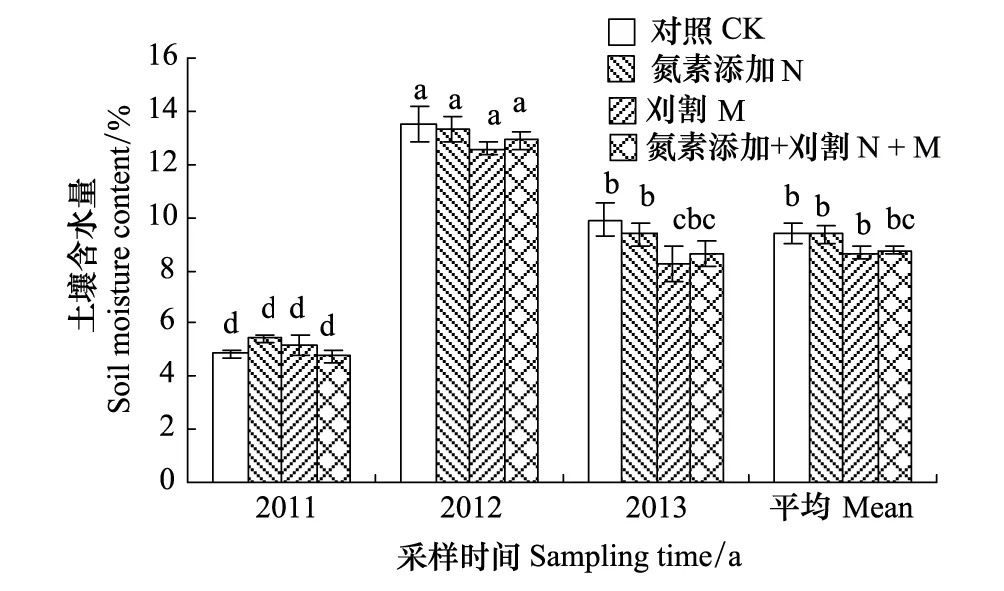
图1 氮素添加和刈割对土壤含水量的影响(平均值±标准误)Fig.1 Effects of N addition and mowing on soil moisture content (mean ± SE)CK:对照Control;N: 氮素添加addition;M: 刈割 Mowing;N + M:氮素添加+刈割N addition + Mowing; 不同小写字母代表不同处理间差异显著(P < 0.01)
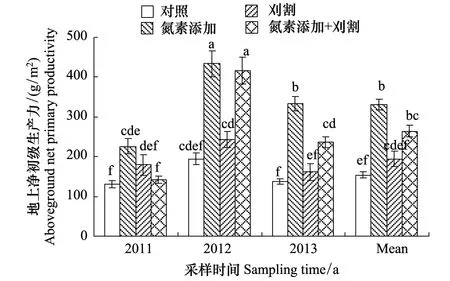
图2 氮素添加和刈割对地上净初级生产力的影响(平均值±标准误)Fig.2 Effects of N addition and mowing on aboveground net primary productivity (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.01)
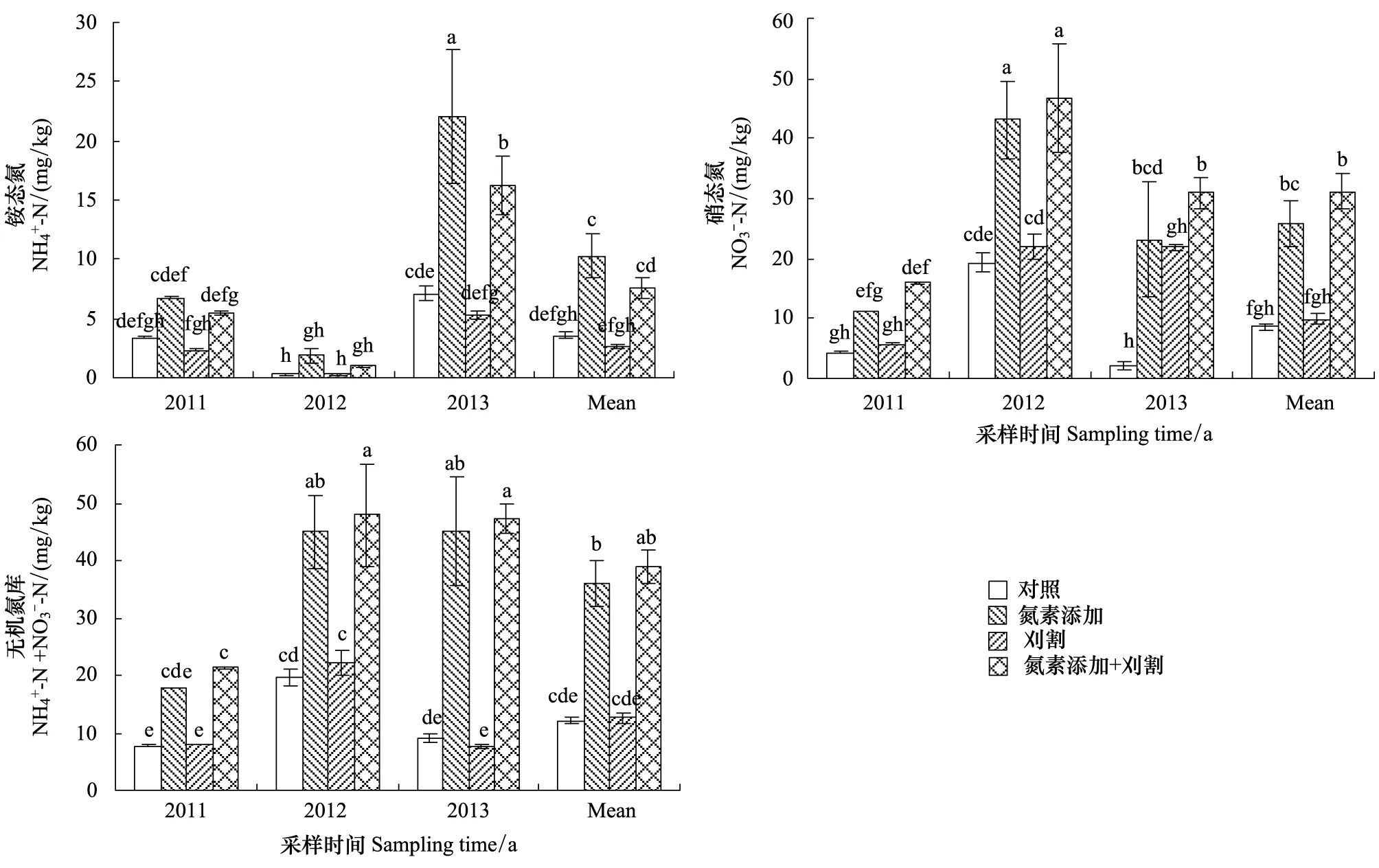
图3 氮素添加和刈割对土壤无机氮库的影响(平均值±标准误)Fig.3 Effects of N addition and mowing on soil inorganic nitrogen pool (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.05)
2.4 氮素添加和刈割对土壤无机氮库、总氨化和硝化速率的影响
氮素添加和刈割对土壤总氨化速率均没有显著影响(P> 0.05)(图4)。施氮显著地提高土壤总硝化速率,比对照高出223%(P< 0.05);刈割对土壤总硝化速率没有显著影响(P> 0.05),但刈割与氮素添加相比,土壤总硝化速率显著降低了62%(图5)。氮素添加和刈割的交互作用对土壤总硝化速率没有显著影响(P> 0.05)。
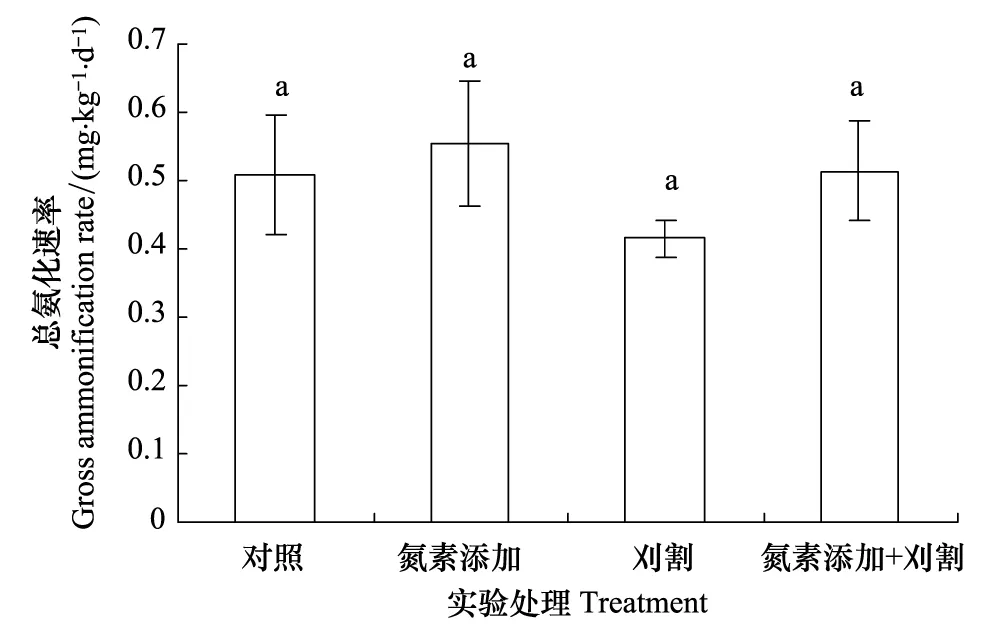
图4 2012年氮素添加和刈割对土壤总氨化速率的影响(平均值±标准误)Fig.4 Effects of N addition and mowing on soil gross ammonification rate in 2012 (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.05)
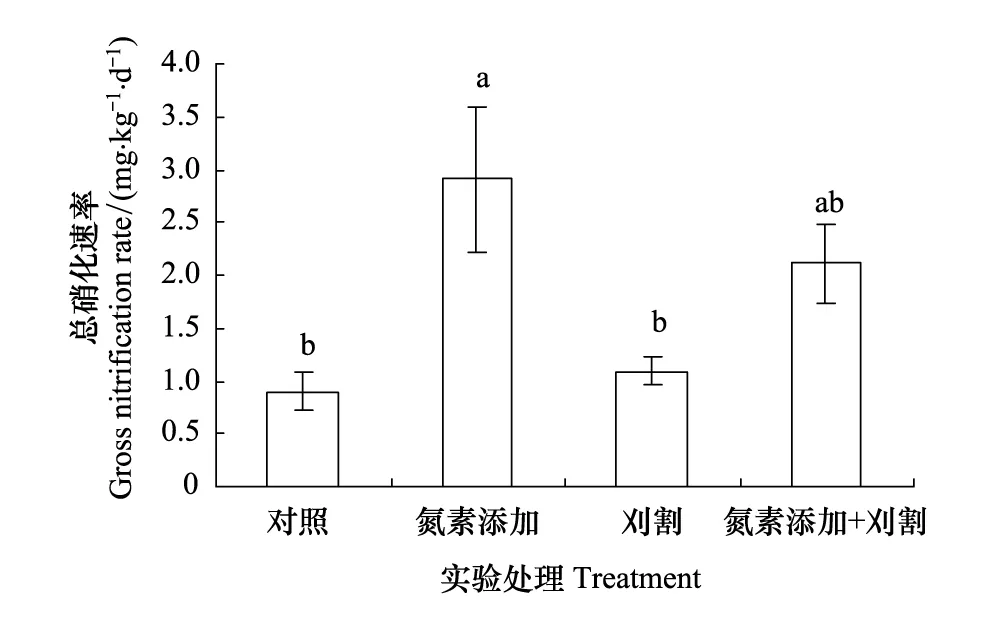
图5 2012年氮素添加和刈割对土壤总硝化速率的影响(平均值±标准误)Fig.5 Effects of N addition and mowing on soil gross nitrification rate in 2012 (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.05)
2.5 氮素添加和刈割对土壤微生物的影响
土壤MBC、MBN、MBC/MBN、MR和qCO2在不同年际间均存在极显著差异(P< 0.01)(图6,图7)。施氮对土壤微生物无显著影响,且氮素添加和刈割处理间没有显著差异(P> 0.05);刈割处理在2012年显著降低土壤MR,与对照相比减少19%(P< 0.05)。2011—2013年,氮素添加和刈割的交互作用显著降低土壤MBC(P< 0.01)和MBC/MBN(P< 0.01),分别比对照减少30%和42%,2011年和2012年土壤qCO2在氮素添加+刈割处理后显著上升(P< 0.05),均比对照提高29%、78%。
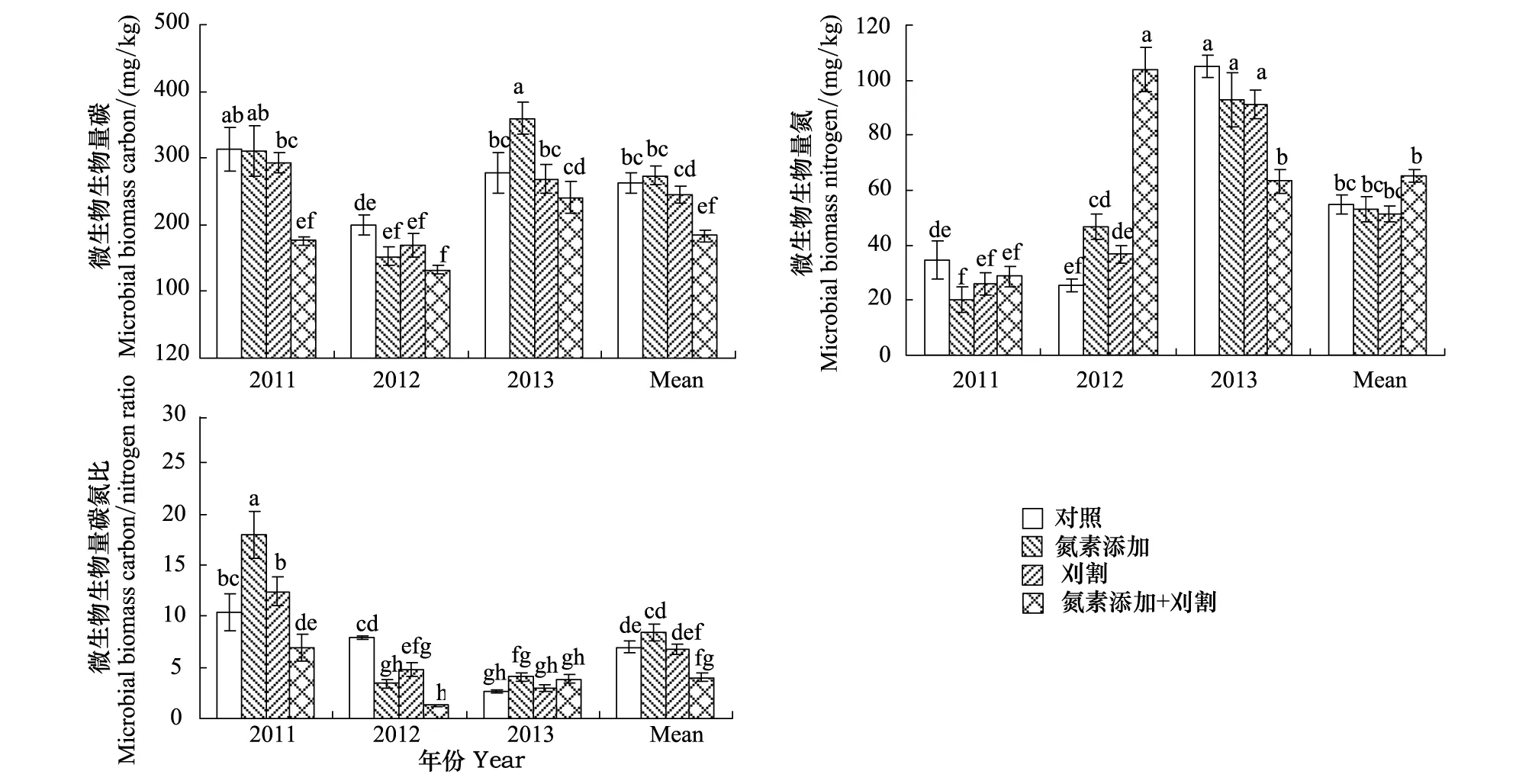
图6 氮素添加和刈割对土壤微生物生物量的影响(平均值±标准误)Fig.6 Effects of N addition and mowing on soil microbial biomass (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.05)
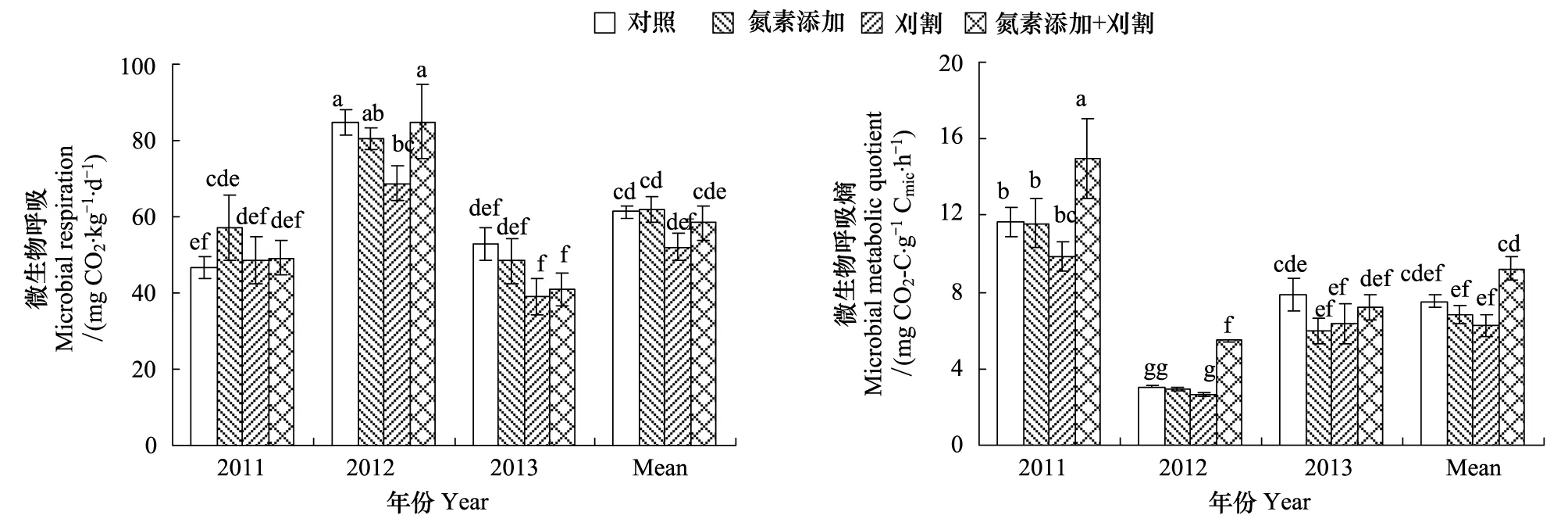
图7 氮素添加和刈割对土壤微生物呼吸及其熵的影响(平均值±标准误)Fig.7 Effects of N addition and mowing on soil microbial respiration and metabolic quotient (mean ± SE)不同小写字母代表不同处理间差异显著(P < 0.05)
3 讨论
3.1 氮素添加与土壤氮转化
草地施氮是提高草地生产力的有效手段,添加氮素增加土壤无机氮库的同时激发了土壤有机质的分解[7,10-12],本实验结果表明多年施氮增加了草地土壤的无机氮库,显著提高了地上生产力,说明氮素是该地区草地初级生产力的主要限制因子之一[28]。但是,多年施氮的结果并没有显著提高土壤总的氨化速率,却显著提高了土壤总的硝化速率,进一步证实添加氮素可以促进土壤硝化反应的发生,增强土壤微生物的氮素转化[13-14],这与多数人的研究结果相一致,其原因是参与硝化反应的微生物活性的增强[29]。
短期施氮能够迅速增强土壤微生物的活性及生物量,随着施氮年限的延长,土壤中难分解有机物与有毒物质(如铝离子)逐渐累积,抑制了微生物活性,从而降低土壤氮转化[15,28,30]。本研究氮素添加5—7a后,土壤微生物生物量和微生物呼吸与对照相比差异不显著。其原因可能有:(1)土壤真菌和细菌对施氮剂量的敏感性存在差异,如真菌/细菌在较低施氮水平下无显著变化,而在较高施氮水平下显著降低[31-32]。而本研究土壤真菌/细菌在氮素添加(10 g N/m2)后稍有降低(P> 0.05),说明土壤真菌和细菌类群之间没有选择压力,微生物群落已适应这种长期氮素添加的干扰;(2)氮素添加可能通过促进地上生产力引起植物群落氮吸收量的增加(表1),土壤微生物的活性受植物调控的程度大于氮素添加的直接调控作用[33]。
3.2 刈割与土壤氮转化
3.3 氮素添加+刈割与土壤氮转化
4 结论
氮素添加和刈割对内蒙古弃耕草地土壤氮矿化及微生物活性具有重要影响,主要结论如下:(1)氮素添加可增加土壤中的无机氮库,同时显著提高植物ANPP,弃耕草地土壤微生物经多年氮素添加后已处于一种相对稳定的状态。氮素添加显著增强土壤总硝化速率,促进土壤微生物氮转化。
(2)刈割显著降低土壤MR,而土壤总氮矿化无显著影响。氮素添加+刈割处理后显著增加植物ANPP、土壤无机氮库和qCO2,同时减少MBC和MBC/MBN,土壤微生物氮转化呈降低趋势。
(3)内蒙古弃耕草地是受氮素限制的生态系统,氮素添加是提高生产力和恢复退化草地的有效手段。氮素添加和刈割的交互作用显著降低土壤微生物生物量,增加土壤微生物呼吸熵,从而降低了土壤氮素的利用率,究其原因是刈割从草地生态系统中带走部分氮素,降低生态系统的氮素利用率,进而降低土壤氮素转化。因此在内蒙古弃耕草地恢复过程中,增施氮肥有利于增加草地植被生产力,同时增强土壤微生物的氮素转化,有利于该地区草地的可持续利用。
[1] 王常慧, 邢雪荣, 韩兴国. 温度和湿度对我国内蒙古羊草草原土壤净氮矿化的影响. 生态学报, 2004, 24(11): 2472-2476.
[2] Holst J, Liu C Y, Brüggemann N, Butterbach-Bahl K, Zheng X H, Wang Y S, Han S H, Yao Z S, Jin Y, Han X G. Microbial N turnover and N-oxide (N2O/NO/NO2) fluxes in semi-arid grassland of Inner Mongolia. Ecosystems, 2007, 10(4): 623-634.
[3] Müller C, Rütting T, Kattge J, Laughlin R J, Stevens R J. Estimation of parameters in complex15N tracing models by Monte Carlo sampling. Soil Biology & Biochemistry, 2007, 39(3): 715-726.
[4] Lovell R D, Jarvis S C, Bardgett R D. Soil microbial biomass and activity in long-term grassland: effects of management changes. Soil Biology & Biochemistry, 1995, 27(7): 969-975.
[5] 何亚婷, 董云社, 齐玉春, 肖胜生, 刘欣超. 草地生态系统土壤微生物量及其影响因子研究进展. 地理科学进展, 2010, 29(11): 1350-1359.
[6] 贾丙瑞, 周广胜, 王凤玉, 王玉辉. 土壤微生物与根系呼吸作用影响因子分析. 应用生态学报, 2005, 16(8): 1547-1552.
[7] Zhang N L, Wan S Q, Li L H, Bi J, Zhao M M, Ma K P. Impacts of urea N addition on soil microbial community in a semi-arid temperate steppe in northern China. Plant and Soil, 2008, 311(1/2): 19-28.
[8] Yuan Z Y, Li L H, Han X G, Huang J H, Jiang G M, Wan S Q, Zhang W H, Chen Q S. Nitrogen resorption from senescing leaves in 28 plant species in a semi-arid region of northern China. Journal of Arid Environments, 2005, 63(1): 191-202.
[9] Yuan Z Y, Li L H, Han X G, Chen S P, Wang Z W, Chen Q S, Bai W M. Nitrogen response efficiency increased monotonically with decreasing soil resource availability: a case study from a semiarid grassland in northern China. Oecologia, 2006, 148(4): 564-572.
[10] 张璐, 黄建辉, 白永飞, 韩兴国. 氮素添加对内蒙古羊草草原净氮矿化的影响. 植物生态学报, 2009, 33(3): 563-569.
[11] 王西娜, 王朝辉, 李生秀. 施氮量对夏季玉米产量及土壤水氮动态的影响. 生态学报, 2007, 27(1): 197-204.
[12] Köchy M, Wilson S D. Nitrogen deposition and forest expansion in the northern Great Plains. Journal of Ecology, 2001, 89(5): 807-817.
[13] 于占源, 曾德慧, 艾桂艳, 姜凤岐. 添加氮素对沙质草地土壤氮素有效性的影响. 生态学杂志, 2007, 26(11): 1894-1897.
[14] 白洁冰, 徐兴良, 付刚, 宋明华, 何永涛, 蔣婧. 温度和氮素输入对青藏高原3种高寒草地土壤氮矿化的影响. 安徽农业科学, 2011, 39(24): 14698-14700, 14756-14756.
[15] Aber J D, Magill A H. Chronic nitrogen additions at the Harvard Forest (USA): the first 15 years of a nitrogen saturation experiment. Forest Ecology and Management, 2004, 196(1): 1-5.
[16] Robson T M, Baptist F, Clément J C, Lavorel S. Land use in subalpine grasslands affects nitrogen cycling via changes in plant community and soil microbial uptake dynamics. Journal of Ecology, 2010, 98(1): 62-73.
[17] Wang C H, Butterbach-Bahl K, Han Y, Wang Q B, Zhang L H, Han X G, Xing X R. The effects of biomass removal and N additions on microbial N transformation and biomass at different vegetation types in an old-field ecosystem in northern China. Plant and Soil, 2011, 340(1/2): 397-411.
[18] Liu W X, Zhang Z, Wan S Q. Predominant role of water in regulating soil and microbial respiration and their responses to climate change in a semiarid grassland. Global Change Biology, 2009, 15(1): 184-195.
[19] 鲍士旦. 土壤农化分析 (第三版). 北京: 中国农业出版社, 2000.
[20] Joergensen R G, Mueller T. The fumigation-extraction method to estimate soil microbial biomass: calibration of the KENvalue. Soil Biology & Biochemistry, 1996, 28(1): 33-37.
[21] Brookes P C, Landman A, Pruden G, Jenkinson D S. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology & Biochemistry, 1985, 17(6): 837-842.
[22] Hu S, van Bruggen A H C. Microbial dynamics associated with multiphasic decomposition of14C-labeled cellulose in soil. Microbial Ecology, 1997, 33(2): 134-143.
[23] Wardle D A, Ghani A. A critique of the microbial metabolic quotient (qCO2) as a bioindicator of disturbance and ecosystem development. Soil Biology & Biochemistry, 1995, 27(12): 1601-1610.
[24] Müller C, Stevens R J, Laughlin R J. A15N tracing model to analyze N transformations in old grassland soil. Soil Biology & Biochemistry, 2004, 36(4): 619-632.
[25] Dannenmann M, Gasche R, Ledebuhr A, Papen H. Effects of forest management on soil N cycling in beech forests stocking on calcareous soils. Plant and Soil, 2006, 287(1/2): 279-300.
[26] Kirkham D, Bartholomew W V. Equations for following nutrient transformations in soil, utilizing tracer data. Soil Science Society of America Journal, 1954, 18(1): 33-34.
[27] Balasooriya W K, Denef K, Huygens D, Boeckx P. Translocation and turnover of rhizodeposit carbon within soil microbial communities of an extensive grassland ecosystem. Plant and Soil, 2014, 376(1/2): 61-73.
[28] LeBauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 2008, 89(2): 371-379.
[29] Barnard R, Le Roux X, Hungate B A, Cleland E E, Blankinship J C, Barthes L, Leadley P W. Several components of global change alter nitrifying and denitrifying activities in an annual grassland. Functional Ecology, 2006, 20(4): 557-564.
[30] Wallenstein M D, McNulty S, Fernandez I J, Boggs J, Schlesinger W H. Nitrogen fertilization decreases forest soil fungal and bacterial biomass in three long-term experiments. Forest Ecology and Management, 2006, 222(1/3): 459-468.
[31] Rousk J, Brookes P C, Baath E. Fungal and bacterial growth responses to N fertilization and pH in the 150-year ‘Park Grass’ UK grassland experiment. FEMS Microbiology Ecology, 2011, 76(1): 89-99.
[32] de Vries F T, Hoffland E, van Eekeren N, Brussaard L, Bloem J. Fungal/bacterial ratios in grasslands with contrasting nitrogen management. Soil Biology & Biochemistry, 2006, 38(8): 2092-2103.
[33] Liu W X, Xu W H, Han Y, Wang C H, Wan S Q. Responses of microbial biomass and respiration of soil to topography, burning, and nitrogen fertilization in a temperate steppe. Biology and Fertilization of Soils, 2007, 44(2): 259-268.
[35] Kuzyakov Y, Biryukova O V, Kuznetzova T V, Mölter K, Kandeler E, Stahr K. Carbon partitioning in plant and soil, carbon dioxide fluxes and enzyme activities as affected by cutting ryegrass. Biology and Fertilization Soils, 2002, 35(5): 348-358.
[36] Pietri J C A, Brookes P C. Relationships between soil pH and microbial properties in a UK arable soil. Soil Biology & Biochemistry, 2008, 40(7): 1856-1861.
[37] 贾建伟, 王磊, 唐玉姝, 李艳丽, 张文佺, 王红丽, 付小花, 乐毅全. 九段沙不同演替阶段湿地土壤微生物呼吸的差异性及其影响因素. 生态学报, 2010, 30(17): 4529-4538.
[38] 周焱, 徐宪根, 王丰, 阮宏华, 汪家社, 方燕鸿, 吴焰玉, 徐自坤. 武夷山不同海拔梯度土壤微生物生物量、微生物呼吸及其商值(qMB,qCO2). 生态学杂志, 2009, 28(2): 265-269.
[39] Grayston S J, Griffith G S, Mawdsley J L, Campbell C D, Bardgett R D. Accounting for variability in soil microbial communities in temperate grassland ecosystems. Soil Biology & Biochemistry, 2001, 33(4/5): 533-551.
Effect of nitrogen addition and mowing on soil nitrogen mineralization in abandoned grasslands in Inner Mongolia
LIU Birong1, 2, WANG Changhui1,*, ZHANG Lihua1, DONG Kuanhu2
1StateKeyLaboratoryofVegetationandEnvironmentalChange,InstituteofBotany,theChineseAcademyofSciences,Beijing100093,China2CollegeofAnimalScience,ShanxiAgricultureUniversity,Taigu030801,China

nitrogen addition; mowing; grassland; microbe; nitrogen transformation; interaction effect; restoration
国家自然科学基金项目(31170455,41371111); 中国科学院方向性项目
2014-03-04; < class="emphasis_bold">网络出版日期:
日期:2014-12-04
10.5846/stxb201403040364
*通讯作者Corresponding author.E-mail: wangch@ibcas.ac.cn
刘碧荣, 王常慧, 张丽华, 董宽虎.氮素添加和刈割对内蒙古弃耕草地土壤氮矿化的影响.生态学报,2015,35(19):6335-6343.
Liu B R, Wang C H, Zhang L H, Dong K H.Effect of nitrogen addition and mowing on soil nitrogen mineralization in abandoned grasslands in Inner Mongolia.Acta Ecologica Sinica,2015,35(19):6335-6343.

