一株降解呕吐毒素的青霉菌的分离与鉴定
■ 李亚菲 余祖华 刘赛宝 李三栋 丁 轲
(1.河南省动物疫病与公共安全院士工作站,河南洛阳 471003;2.河南科技大学宏翔生物饲料实验室,河南洛阳 471003)
脱氧雪腐镰刀菌烯醇(呕吐毒素,DON)是分布最广泛的镰刀霉菌毒素之一,由于其广泛存在于谷物类饲料中,已经成为动物饲料中毒的重要原因之一。人和动物食用后,可引起呕吐、腹泻、流产、癌变和免疫抑制等,具有高度的危害性。农业部饲料质量监督检验测试中心2008年在全国的一些饲料和养殖企业里采集了7种主要饲料原料(玉米、豆粕、菜粕、棉粕、小麦、麦麸、鱼粉)及2种主要配合饲料共计1 018个样品,呕吐毒素平均检出率为95.5%,超标率平均为18.7%,且能量原料玉米和蛋白原料豆粕中毒素含量均较高。因此,饲料行业急需解决呕吐毒素等霉菌毒素污染的问题。近年来,生物降解逐渐成为霉菌毒素脱毒的一种新趋势,可以通过使用酶或者活菌来改变毒素的结构,将毒素转化成为对动物无毒的物质。目前关于生物降解DON菌株的报道并不多,要获得具有DON降解能力的菌株,就必须从特定的自然界中采集大量的样品,进行有针对性的分离,然后再从中分离筛选具有高活性的特异性菌株。因此,本研究旨在筛选对呕吐毒素有较好降解作用的菌株,以便为开发具有霉菌毒素降解作用的新型生物制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品
分别取自河南省洛阳市周边野外散置的秸秆及下层土壤、瘤胃内容物等样品,共55份。
1.1.2 主要试剂
呕吐毒素标准品为Sigma公司产品,纯度≥97.0%;呕吐毒素ELISA检测试剂盒购自北京华安麦科生物技术有限公司。Premix Ex Taq™、pMDl8-T载体购自宝生物工程(大连)有限公司;凝胶回收试剂盒购自天根生物有限公司。
1.1.3 主要仪器
立式压力蒸汽灭菌器(LDZX-50KBS)、酶标仪(Multiskan FC)、紫外可见分光光度计 (UV-1200),Bio-metro PCR仪。
1.1.4 主要培养基
察氏液体培养基:蔗糖 3%,NaNO30.3%,MgSO4·7H2O 0.05%,KCl 0.05%,FeSO4·7H2O 0.001%,K2HPO40.1%,调pH值7.0~7.2,121℃,高压灭菌20 min。
察氏固体培养基:蔗糖 3%,NaNO30.3%,MgSO4·7H2O 0.05% ,KCl 0.05% ,FeSO4·7H2O 0.001% ,K2HPO40.1%,琼脂粉1.5%,调pH值7.0~7.2,121℃,高压灭菌20 min。无机盐培养基:(NH4)2SO40.1%,K2HPO4·3H2O 0.6%,KH2PO40.3%,NaCl 0.05%,Mg-SO4·7H2O 0.05%,CaCl20.005%,调 pH 值 7.0~7.2,121℃,高压灭菌20 min。使用前按照4μg/ml的量添加DON。
1.1.5 引物
参照Shiang N L,等(2006)设计扩增包含真菌rDNA 18 S和28 S的部分区域和ITS1,5.8 S,ITS2的完整区域的片段,即rDNA-ITS通用引物ITSl:5’-TCCGTAGGTGAACCTGCGG-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’,由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 样品的处理
取1 g秸秆、土壤或1 ml的瘤胃内容物等样品,分别加入50 ml的灭菌蒸馏水的锥形瓶中,充分混匀。
1.2.2 DON降解菌株的初筛
DON降解菌株的初筛参考文献描述方法进行,具体如下:取上述混悬液1 ml加入250 ml含有DON的无机盐培养基中,置28℃恒温震荡培养箱中培养7 d,然后取1 ml培养后的样品液再加入另一250 ml含有DON的无机盐培养基中,再置28℃恒温震荡培养箱中培养7 d,吸取二次培养后的样品液200μl涂于含有DON的无机盐固体培养基平板,再置28℃恒温静置培养7 d,观察结果。
1.2.3 DON降解菌株的纯化
挑取在含有DON的无机盐固体培养基上生长的单菌落,转接于新的含有DON的无机盐培养基平板上,如此反复3~4次进行纯化,保存能在DON为唯一碳源的初筛培养基上生长的菌株。
1.2.4 DON降解菌株的复筛
取上述筛选、纯化的菌株接种察氏液体培养基,于28℃恒温震荡培养箱中培养7 d,取新鲜菌液按照5 ml/g的接种量接种于粉碎的玉米秸秆中,于28℃恒温培养箱中培养14 d,然后按照呕吐毒素ELISA检测试剂盒操作说明测定分离菌株降解玉米秸秆中DON的效果,以筛选具有降解玉米秸秆中DON的菌株。
1.2.5 DON降解菌株的形态学特征
将上述筛选的菌株进行平板点种或划线接种于察氏固体培养基平板上,在28℃下培养7 d后观察菌落形态、色泽。同时,在察氏培养基上划线接种线上面插进去灭菌的盖玻片,等菌落长出来以后,从培养基上直接拔出盖玻片,轻轻放在中央加有美兰染色液的洁净的载玻片上,染色后显微镜下观察观察孢子和基内菌丝的形态。
1.2.6 DON降解菌株的rDNA-ITS序列分析
采用参考邱海萍等(2014)的方法提取培养菌株的基因组DNA。用rDNA-ITS通用引物ITSl和ITS4 PCR扩增分离菌株的rDNA-ITS区域。以25μl体系进行PCR扩增,PCR反应体系包括Premix Ex Taq™12.5μl,上下游引物(20 pmol/μl)各0.5 μl,模板DNA 0.5 μl,超纯水11μl。反应程序为:94℃预变性3 min,94℃变性1 min,55 ℃退火45 s,72 ℃延伸90 s,30 个循环,72 ℃延伸10 min,4℃保存。将产物于1%的琼脂糖凝胶中电泳,并将扩增的与预期大小相符的特异性片段克隆至pMD18-T后送至生工生物工程(上海)股份有限公司进行测序。将测序结果在GenBank中进行BLAST比对,选取相似性较高的序列,利用MEGA4.0对序列进行系统进化分析,并构建系统发育树。
2 结果
2.1 菌株的分离与筛选
将在分离培养基上初步分离出能以DON为唯一碳源的菌株纯化后,接种察氏液培养液,然后接种粉碎的玉米秸秆中,于28℃恒温培养箱中培养14 d,用呕吐毒素ELISA检测试剂盒测定分离菌株降解玉米秸秆中DON的效果。根据试剂盒中的标准样品测得的OD值绘制标准曲线(见图1),计算经初筛分离的菌株降解秸秆中DON的含量。其中菌株Ma-1-4的降解率为46%,具有较强的降解效果(见表1)。
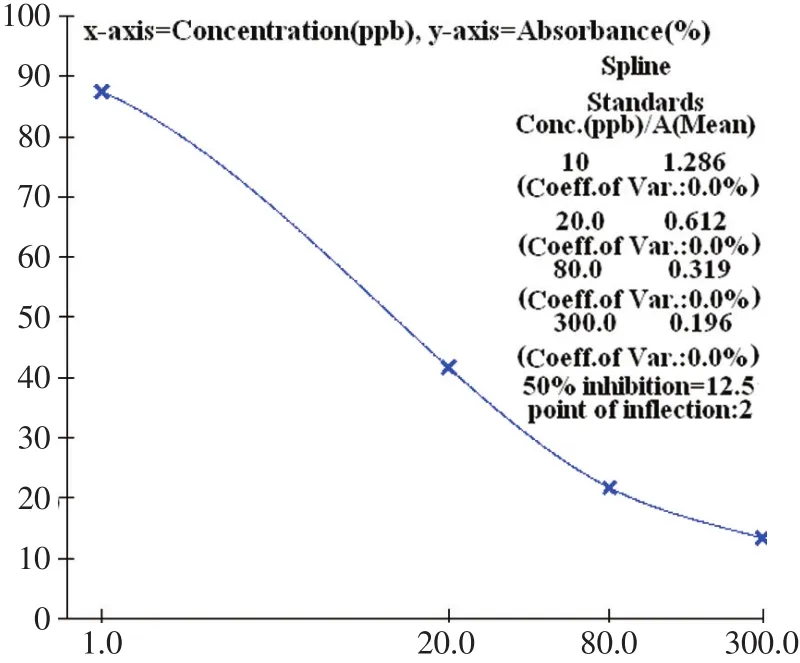
图1 DON标准品ELISA标准曲线
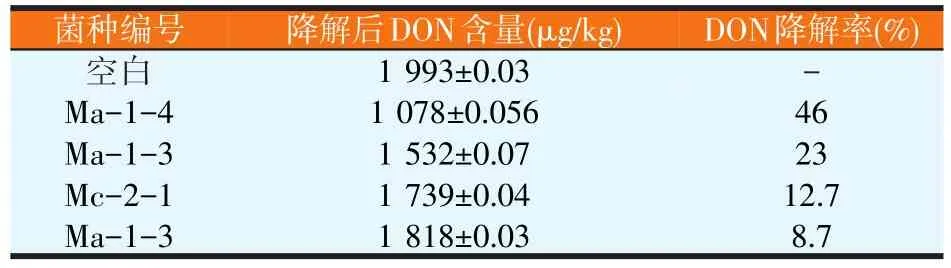
表1 降解DON菌株复筛结果
2.2 菌株的形态学特征
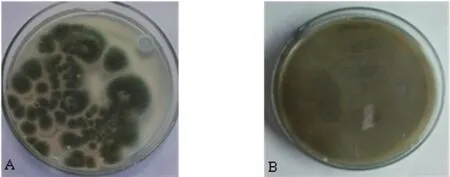
图2 复筛菌株菌落形态
将菌株Ma-1-4在察氏培养基上进行平板接种,置于28℃下培养7 d,观察菌落特征。Ma-1-4培养后可见长出菌落为白色,随菌落的生长,中心出现墨绿色并向上突起。扩展过程中菌落边缘有一圈白色菌丝,正反颜色不同,正面为墨绿色,背面为浅黄绿色。菌落生长致密,不透明。随着时间的延长,白色消失,最终为墨绿色(见图2A、图2B)。在显微镜下可见菌丝无隔膜;分生孢子梗单枝,较长,无足细胞;孢子梗顶端膨大,成帚状,对称,生分生孢子串:单个分生孢子为球形或椭圆形(图3A、图3B)。根据Ma-1-4的菌落特征和显微特征初步鉴定为青霉族,青霉属。
2.3 菌株的rDNA-ITS分子鉴定结果
以菌株Ma1-4基因组DNA为模板,rDNA-ITS通用引物ITSl、ITS4经PCR扩增后在1.2%的琼脂糖凝胶上电泳,结果如图4所示,在约580 bp处有一明亮的条带,与预期大小一致。将所扩增的特异性片段克隆至pMD18-T后送往生工生物工程(上海)有限公司进行测序。Ma-1-4菌株的rDNA-ITS测序结果表明扩增的片段长度为586 bp。

图3 复筛菌株显微镜下分生孢子形态
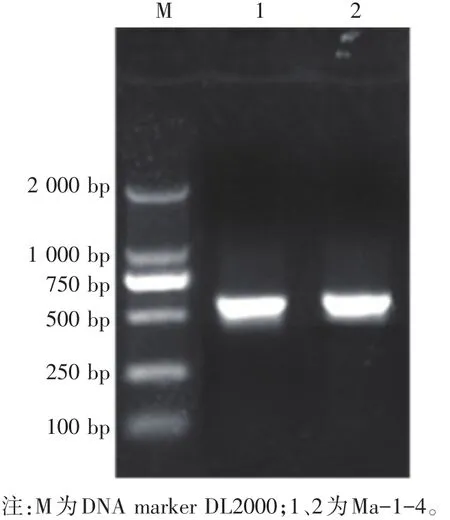
图4 Ma-1-4菌株rDNA-ITS的PCR
2.4 基于rDNA-ITS序列的系统进化树分析
将Ma-1-4菌株的rDNA-ITS序列在GenBank中进行BLAST,发现与16个青霉菌属的模式菌株的同源性最高,下载这些菌株的rDNA-ITS序列,并利用MEGA4软件构建系统发育树,如图5所示,Ma-1-4与青霉菌(Penicillium)属的尔青霉位于同一大分支。因此,综合以上菌落特征、显微特征和rDNA-ITS序列的分析,初步确认菌株Ma-1-4为青霉菌属。
3 讨论
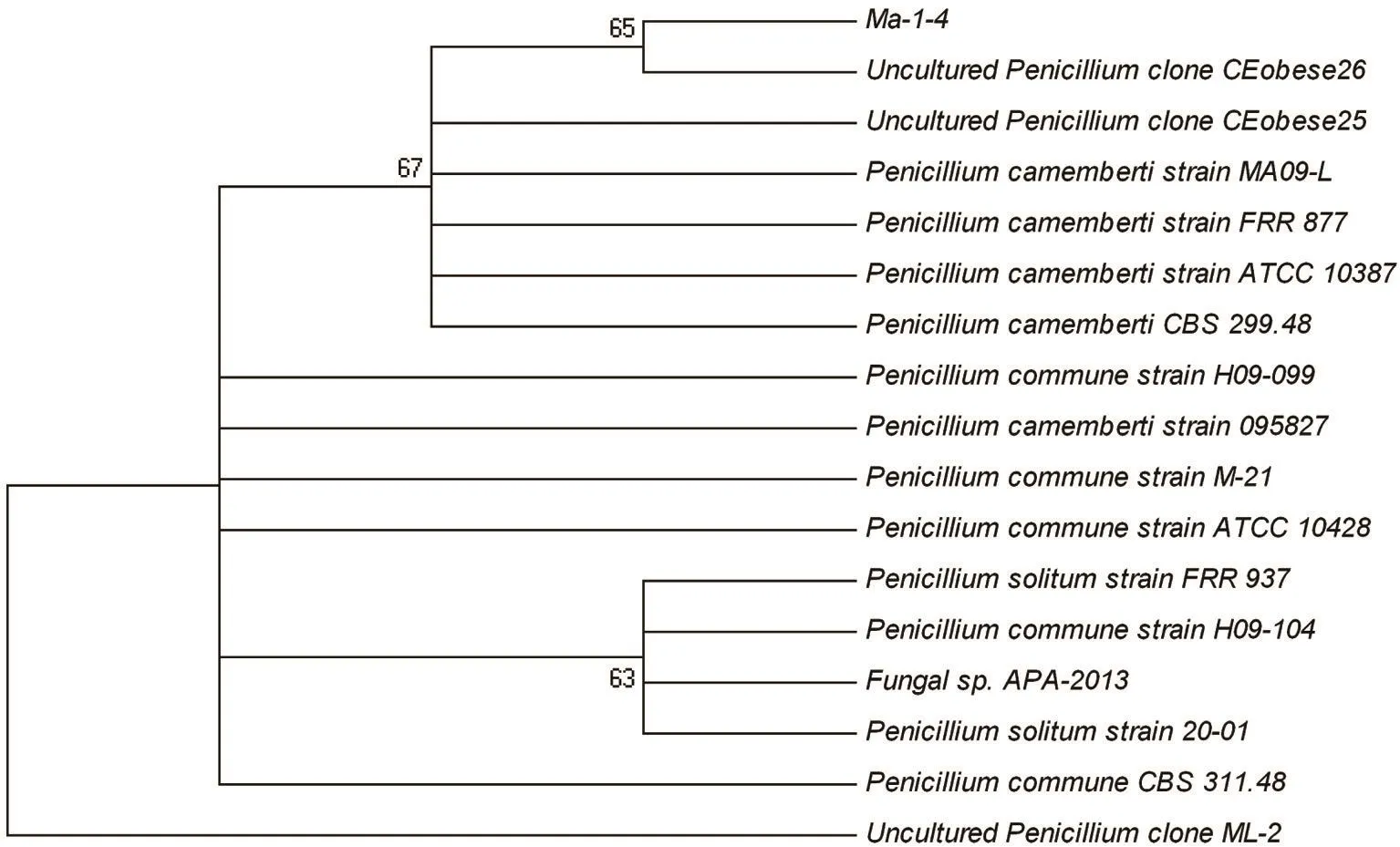
图5 基于rDNA-ITS构建的系统发生树
饲料中霉菌毒素的污染是一个普遍现象。虽然物理吸附是当前控制饲料霉菌毒素污染的主要途径,但物理吸附剂常常只对某一种霉菌毒素有较强选择性,对其他种类的霉菌毒素选择性不强,并且物理吸附剂还易导致对营养素的吸附,从而可能影响营养素的吸收。生物降解是近年来国内外霉菌毒素脱毒技术方面的一个研究热点。霉菌毒素的生物降解技术具有安全性高、特异性强的优点而被人们寄于厚望。目前生物降解研究较多的是真菌,如木霉、青霉、曲霉等。Matsushima等从动物消化系统中分离获得了能够水解单端孢霉烯酯键的厌氧菌。Binder等首次从牛瘤胃的富集培养物中分离到一株厌氧优杆菌属细菌,该菌可以在转化DON和其他单端孢霉烯族毒素,从而部分地减轻饲料中毒素的毒性。Ikunaga等从土壤中分离到一株诺卡氏菌在MM培养基中10d后可以完全降解DON;He等分离到一株能够氧化DON的塔宾曲霉NJA-1,15d内对 DON的平均降解率为94.4%,但降解产物未知;徐剑宏等利用富集培养的方法,从土壤和麦穗样品中分离获得一株徳沃斯氏菌,将该菌添加到小麦饲料中后,饲料中的DON毒素降解率达到75.47%,未明确降解产物结构。本研究从洛阳市周边采集的土壤样品中分离到了1株能降解呕吐毒素的霉菌,其降解率为46%,经形态学和分子生物学初步鉴定其分别为青霉菌属,但本研究分离的菌株降解DON的能力没有文献报道的高,这可能是分离的菌株不同有关。另外,分离到的青霉菌Ma-1-4在降解DON的过程中是否会产生其它的毒素,能否进一步开发为用于降解饲料原料中的DON发酵菌株还需进一步的研究来证实。

