HIF-1α和2α基因表达与甲状腺乳头状癌临床病理特征的相关性研究
刘艳梅 潘印 应申鹏 梁勇
HIF-1α和2α基因表达与甲状腺乳头状癌临床病理特征的相关性研究
刘艳梅 潘印 应申鹏 梁勇
目的 检测缺氧诱导因子HIF-1α和2α在甲状腺乳头状癌(PTC)中的表达及其与患者临床病理特征的相关性。方法 应用免疫组化、Western blot和实时定量RT-PCR技术检测30例PTC患者癌组织及30例结节性甲状腺肿组织中HIF-1α和2α蛋白及mRNA的表达,并分析其与PTC患者临床病理特征的相关性。结果 实时定量RT-PCR结果显示PTC组织中HIF-1α和2α的mRNA表达均高于对照组(均P<0.05),免疫组化结果显示PTC组织中HIF-1α和2α的阳性表达率分别为66.67%和76.67%,均明显高于对照组(均P<0.01);Western blot提示PTC组织中HIF-1α和2α蛋白表达量均明显高于对照组(P<0.05或0.01)。HIF-1α表达与淋巴结转移相关(P<0.05),与其他临床病理特征均无相关性,而HIF-2α的表达与患者临床病理特征均无相关性(均P>0.05)。结论 在PTC组织中,HIF-1α和2α的mRNA及蛋白质表达均出现明显升高,在PTC的发展过程中可能起促癌作用;且两者的表达呈同向变化,提示它们可能通过不同机制起着相同或相仿的作用。
HIF-1α HIF-2α 免疫组化 实时定量聚合酶链式反应 Western blot
甲状腺癌作为最常见的内分泌肿瘤,越来越受到重视,美国2013年度新发病例60 220例,且发病率逐年递增[1]。目前全球甲状腺癌发病率以平均每年4.00%的速度递增,已成为备受关注的恶性肿瘤之一,尤以沿海国家和地区为高发,其中以甲状腺乳头状癌(PTC)为主要病理类型[2]。缺氧诱导因子(HIF)是一组由结构同源的α亚基,以及共同的β亚基组成的异二聚体转录因子。研究显示,哺乳动物中存在3种HIF-α亚基(HIF-1α、2α和3α),其中HIF-1α和2α目前研究较多,也较为深入[3-6]。但HIF-1α和2α在PTC中的表达情况,以及两者对甲状腺癌发展的影响,目前尚未见进一步的报道。本研究检测了甲状腺癌组织中HIF-1α和2α的表达情况,期望进一步探讨在PTC中HIF-1α和2α的表达情况及其临床意义。
1 对象和方法
1.1 对象 收集2013年1至6月台州市中心医院肿瘤外科手术切除的甲状腺组织标本共60例,其中PTC组织30例为实验组,患者男11例,女19例,年龄21~72岁,平均48.6岁;对照组为30例随机选取的结节性甲状腺肿手术标本中相对正常的组织,患者男14例,女16例,年龄23~72岁,平均45.2岁。标本体积约5mm×5mm~25mm×25mm,其中20mm×20mm以上标本共12例,选取标本中2/3于20 min内置于-80℃冰箱中保存,用于实时定量RT-PCR及Western blot检测;剩下的1/3以10%甲醛溶液固定,石蜡包埋,用于免疫组化检测。所有病例均经病理学证实,根据患者年龄、性别、肿瘤大小、淋巴结转移、是否伴钙化、是否合并桥本病、是否侵犯包膜分成7个亚组,其中实验组中年龄≥45岁18例,<45岁12例;肿瘤直径≥2cm的12例,肿瘤直径<2cm的18例;伴淋巴结转移10例,无淋巴结转移20例;8例伴钙化,11例侵犯包膜,6例合并桥本病。
1.2 主要试剂 兔抗人HIF-1α和2α多克隆抗体为Abcam公司产品,免疫组化试剂盒和DAB试剂盒及二抗均购于北京中杉金桥公司。RIPA裂解液、cDNA试剂盒、SYBR Green荧光染料均购于温州长丰生物科技有限公司。
1.3 方法
1.3.1 实时定量RT-PCR检测HIF-1α和2α基因表达 设计HIF-1α、2α基因PCR引物序列,具体为:HIF-1α正向5′-ACT TCT GGA TGC TGG TGA TTT G-3′,反向5′-GCT TCG CTG TGT GTT TTG TTC T-3′;HIF-2α正向5′-TCA TGC GAC TGG CAA TCA GC-3′,反向5′-GTC ACC ACG GCA ATG AAA CC-3′;内参GAPDH正向5′-ATG GCC TTC CGT GTC CCC ACT G-3′,反向5′-TGA GTG TGG CAG GGA CTC CCC A-3′,所有引物均由温州长丰生物科技有限公司合成。取-80℃冰箱保存的标本,冰上操作,提取总RNA并检测纯度,然后转换成cDNA反应体系,37℃孵育60min。采用SYBR Green荧光染料,根据试剂盒使用说明完成40个PCR循环,收集荧光信号并分析结果。
1.3.2 免疫组化检测HIF-1α和2α蛋白表达 所有标本蜡块行4μm切片,68℃烤片2h,二甲苯浸泡,PBS洗涤后滴加3%H2O2,EDTA缓冲液(pH=6.0)95℃煮沸抗原修复,封闭后滴加一抗50~100μl(HIF-1α抗体浓度1∶100、HIF-2α抗体浓度1∶500)4℃过夜,37℃复温1h,滴加二抗40~50μl,37℃孵育1h,DAB显色2min,苏木精复染30s,梯度乙醇脱水、透明后封片镜检。HIF-1α和2α表达阳性为细胞染色呈棕黄色颗粒,由有经验的病理科医师根据阳性细胞所占比例及着色强度综合制定半定量计分标准:(1)阳性细胞计分:<1%计0分,1%~10%计1分,11%~50%计2分,51%~80%计 3分,>80%计4分。(2)着色强度计分:弱计1分,中计2分,强计3分。两个分值相加为最终判定结果:1分为(-);2~3分为(+);4~5分为(++);6~7分为(+++)。(++)和(+++)认定为阳性。
1.3.3 Western blot检测HIF-1α和2α蛋白表达 从保存的组织标本中提取蛋白,BCA法检测测蛋白浓度,上样检测,一抗HIF-1α抗体浓度1∶2 500、HIF-2α抗体浓度1∶1 000,化学发光试剂显色,胶片贴近曝光,显影、定影后检测蛋白条带的密度并分析灰度值。
1.4 统计学处理 应用SPSS 17.0统计软件,计量资料以表示,组间比较采用t检验,计数资料组间比较采用χ2检验,HIF-1α和2α蛋白表达的相关性及两者与患者临床病理特征的相关性行相关性分析。
2 结果
2.1 HIF-1α和2α基因在PTC组织中的表达 实时定量RT-PCR提示,目的基因HIF-1α、2α和内参基因GAPDH的熔解曲线均为单峰,峰值分别在81.27℃、87.23℃、89.32℃,说明引物的特异性好,扩增曲线效率恒定,都已达到平台期,可以用该体系对目的基因HIF-1α和2α进行定量分析,见图1。采用2-ΔΔCt法进行计算,结果提示HIF-1α和2α的mRNA在PTC及对照组中均有表达,HIF-1α的mRNA在PTC中相对表达量为对照组的1.3899±0.3912,HIF-2α的mRNA的相对表达量为对照组的1.3446±0.0272,比较均有统计学差异(均P<0.05)。
2.2 HIF-1α和2α蛋白表达情况
2.2.1 免疫组化检测HIF-1α和2α蛋白表达 PTC组织中HIF-1α的阳性率为66.67%。对照组中为13.33%,PTC组织中阳性率明显高于对照组(P<0.01);HIF-2α在PTC组织中染色呈强阳性,对照组中染色呈弱阳性或阴性,PTC组织中阳性率为76.67%,明显高于对照组的10.00%(P<0.01),见图2和表1。而且HIF-1α几乎在胞核、胞质均有表达,30例标本中,胞核阳性12例,胞核阳性率为40.00%;而HIF-2α以胞质表达为主,30例标本中仅3例胞核阳性,胞核阳性率为10.00%,两组比较具有统计学差异(χ2=7.20,P<0.05)。
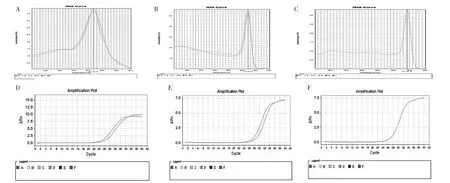
图1 HIF-1α、2α与GAPDH的熔解曲线及扩增曲线(A:HIF-1α熔解曲线;B:HIF-2α熔解曲线;C:GAPDH熔解曲线;D:HIF-1α扩增曲线;E:HIF-2α扩增曲线;F:GAPDH扩增曲线)

图2 HIF-1α和2α蛋白在PTC和结节性甲状腺肿组织中的表达(A:HIF-1α蛋白在PTC组织中的表达;B:HIF-1α蛋白在结节性甲状腺肿组织中的表达;C:HIF-2α蛋白在PTC组织中的表达;D:HIF-2α蛋白在结节性甲状腺肿组织中的表达;免疫组化染色,×400)

表1 免疫组化检测HIF-1α和2α蛋白表达
2.2.2 Western blot检测 HIF-1α和 2α蛋白表达Western blot提示HIF-1α蛋白在PTC组织中相对表达量为0.6781±0.1061,而在对照组中为0.4680±0.0484,两组比较有统计学差异(P<0.01)。HIF-2α蛋白在PTC组织中相对表达量为0.7178±0.0633,而在对照组中为0.5728±0.0867,两组比较有统计学差异(P<0.05),见图3。
2.3 HIF-1α和2α蛋白表达与PTC患者临床病理特征的关系 HIF-1α和2α蛋白表达与PTC患者的性别、年龄、肿瘤大小、肿瘤内钙化、侵犯包膜及是否合并桥本病均无关(均P>0.05);但HIF-1α与淋巴结转移相关(P<0.05),而HIF-2α与淋巴结转移与否无关(P>0.05),见表2。
2.4 PTC组织中HIF-1α和2α蛋白表达的相关性 30例PTC组织标本中HIF-1α和2α表达均阳性15例,均阴性2例,HIF-1α阳性而HIF-2α阴性8例,HIF-1α阴性而HIF-2α阳性5例,两者表达无相关性(rs=-0.056,P>0.05)。

图3 Western blot检测HIF-1α和2α蛋白表达
3 讨论
PTC约占甲状腺癌的80.00%,虽然生长缓慢,预后较好,但其具有特殊的生物学行为,容易早期发生颈部淋巴结或远处转移,这往往是导致其不良预后和患者死亡的主要原因。PTC虽然肿瘤体积较小,但肿瘤发展过程中极易伴发钙化和囊变,这可能与肿瘤细胞所处的低氧微环境有密切关系。

表2 HIF-1α、2α蛋白表达与PTC患者临床病理特征的关系(例)
HIF是一组由结构同源的α亚基,以及共同的β亚基组成的异二聚体转录因子。氧浓度主要对α亚基进行调节,因此对HIF的研究主要集中在HIF-α。实体肿瘤在发生、发展过程中普遍处于低氧微环境中,在肿瘤发生、发展的各个阶段,HIF-1α和HIF-2α通过调节不同的靶基因发挥功能,包括血管生成、细胞增殖、肿瘤干细胞分化等多个方面[4]。Jung等[7]研究显示,HIF-1α是癌变过程的一个重要转录因子,IL-1诱导活化核因子-κB/环氧合酶-2(NF-κB/COX-2)途径,上调HIF-1α蛋白的表达,并最终上调血管内皮生长因子(VEGF)的表达,促进肿瘤血管生成。已有较多研究证实HIF-1α与肺癌[8]、宫颈癌[9]、乳腺癌[10]的发生、发展密切相关。HIF-2α是1997年由Tian等克隆出的一种含bHLH-PAS域的转录因子,已有研究证实HIF-1α和2α在肿瘤的发生、发展过程中密不可分,但两者的作用并不一致,如HIF-2α与肺癌、肾癌关系密切,在这些肿瘤中发挥着至关重要的作用,是其他缺氧转录因子无法取代的[11-12]。
本研究结果提示在PTC组织中,HIF-1α和2α在基因转录和蛋白质表达方面均明显高于正常组织。而且两种蛋白表达与PTC患者的年龄、性别、肿瘤大小、是否伴有钙化等无明显相关性。此外,HIF-1α蛋白表达与淋巴转移相关,而HIF-2α蛋白表达与淋巴转移无关,此结果与李娜等[13]对乳腺癌的研究结果不一致,可能原因与本研究中淋巴结转移阳性病例数少有关,后期需扩大样本量进一步研究。
本研究中通过免疫组化检测还发现,在PTC组织中,HIF-1α在胞核、胞质中均有表达,其胞核阳性率达到40.00%,而HIF-2α在胞核中表达量明显偏低,30例标本中仅有3例在胞核表达。由此可以看出,虽然HIF-2α与HIF-1α的基本氨基酸序列中48.00%相同,bHLH区有83.00%的相似性,PAS区有70.00%的相似性,但它们之间仍然存在差异。由此可以假设,两者可能存在不同的细胞调节机制,HIF-1α的功能发挥可能更受制于细胞核调控机制,这可能和分子入核信号及其激活过程有关。
综上所述,通过本研究及复习相关文献可以假设,PTC组织中的低氧微环境可能上调HIF-1α和2α蛋白的表达,并最终使VEGF表达上调,促进肿瘤血管生成。本研究初步证实两者表达无相关性,因此目前笔者只能推断它们在PTC中通过不同的作用机制发挥作用,这与Zhu等[14]对口腔癌的研究结果相仿,但其中的具体分子机制有待进一步研究。
[1] Du L B,Li H Z,Wang X H,et al.Analysis of cancer incidence in Zhejiang cancer registry in China during 2000 to 2009[J].Asian Pac J Cancer Prev,2014,15(14):5839-5843.
[2] American Thyroid Association(ATA)Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer,Cooper D S, Doherty G M,et al.Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167-1214.
[3] Fong G H,Takeda K.Role and regulation of prolyl hydroxylase domain proteins[J].Cell Death Differ,2008,15(4):635-641.
[4] Majmundar A J,Wong W J,Simon M C.Hypoxia-inducible factors and the response to hypoxic stress[J].Mol Cell,2010,40(2): 294-309.
[5] Patel S A,Simon M C.Biology of hypoxia-inducible factor-2alpha in development and disease[J].Cell Death Differ,2008,15(4): 628-634.
[6] Loboda A,Jozkowicz A,Dulak J.HIF-1 and HIF-2 transcription factors-similar but not identical[J].MolCells,2010,29(5):435-442.
[7] Jung Y J,Isaacs J S,Lee S,et al.IL-1beta-mediated up-regulation of HIF-1alpha via an NFkappaB/COX-2 pathway identifies HIF-1 as a critical link between inflammation and oncogenesis [J].FASEB J,2003,17(14):2115-2117.
[8] Lu Q L,Liu J,Zhu X L,et al.Expression of nerve growth factor andhypoxia inducible factor-1α and its correlation with angiogenesis in non-small cell lung cancer[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(3):359-362.
[9] Huang M,Chen Q,Xiao J,et al.Overexpression of hypoxia-inducible factor-1α is a predictor of poor prognosis in cervical cancer:a clinicopathologic study and a meta-analysis[J].Int J Gynecol Cancer,2014,24(6):1054-1064.
[10] Wang W,He Y F,Sun Q K,et al.Hypoxia-inducible factor 1α in breast cancer prognosis[J].Clin Chim Acta,2014,428:32-37.
[11] Bertout J A,Majmundar A J,Gordan J D,et al.HIF2alpha inhibition promotes p53 pathway activity,tumor cell death,and radiation responses[J].Proc Natl Acad Sci U S A,2009,106(34): 14391-14396.
[12] Petrella B L,Lohi J,Brinckerhoff C E.Identification of membrane type-1 matrix metalloproteinase as a target of hypoxia-inducible factor-2 alpha in von Hippel-Lindau renal cell carcinoma[J].Oncogene,2005,24(6):1043-1052.
[13] 李娜,王洪兴,贺国洋,等.缺氧诱导因子-2α在不同侵袭能力乳腺癌细胞和组织中的表达及意义[J].广东医学,2013,34(12):1896-1898.
[14] Zhu G Q,Tang Y L,Li L,et al.Hypoxia inducible factor 1αand hypoxia inducible factor 2αplay distinct and functionally overlapping roles in oral squamous cell carcinoma[J].Clin Cancer Res,2010,16(19):4732-4741.
Expression of hypoxia-inducible factor-1α and 2α in papillary thyroid carcinoma and its association with clinicopathological fea-tures
LIU Yanmei,PAN Yin,YING Shenpeng,et al.
Department of Radiation Oncology,Taizhou Central Hospital,Taizhou 318000, China
【 Abstract】 Objective To investigate the expression of hypoxia-inducible factor-1α and 2α (HIF-1α and HIF-2α) in papillary thyroid carcinoma(PTC)and its association with clinicopathological features. Methods The expression of HIF-1α and HIF-2α proteins and mRNAs was detected by immunohistochemistry,Western blot and RT-PCR in 30 cases of papillary thyroid carcinoma(PTC group)and 30 cases of nodular goiter tissue(control group),respectively.The correlation of HIF-1α and HIF-2α expression with clinicopathological features of PTC was analyzed. Results RT-PCR showed that expression of HIF-1α and HIF-2α mRNA in PTC group was significantly higher than that in control group(P<0.05).Immunohistochemistry showed that the positive expression rates of HIF-1α and HIF-2α were 66.67%and 76.67%in PTC group,which was significantly higher than those in control group(P<0.01);and Western blot results showed the same conclusions.The expression of HIF-1α and HIF-2α was not correlated with the clinicopathological features of PTC,except for HIF-1α with lymphatic metastasis. Conclusion The expression of HIF-1α and HIF-2αis up-graduated in papillary thyroid carcinoma,but the expression is not correlated with the clinicopathological features of the cancer.
HIF-1α HIF-2α Immunohistochemistry RT-PCR Western blot
2014-11-19)
(本文编辑:胥昀)

白细胞介素(IL)变异系数(CV)丙氨酸转氨酶(ALT)丙型肝炎病毒(HCV)磁共振成像(MRI)蛋白质印迹(Western blot)低密度脂蛋白胆固醇(LDL-C)动脉血氧二氧化碳分压(PaCO2)动脉血氧分压(PaO2)辅助性T淋巴细胞(Th)干扰素(IFN)甘油三酯(TG)高密度脂蛋白胆固醇(HDL-C)核因子-κ(NF-κB)红细胞沉降率(ESR)活化部分凝血活酶时间(APTT)获得性免疫缺陷综合征(AIDS)甲型肝炎病毒(HAV)接受者操作特征曲线(ROC曲线)精制结核菌素试验(PPD)磷酸盐缓冲液(PBS)酶联免疫吸附测定(ELISA)逆转录-聚合酶链反应(RT-PCR)凝血酶时间(TT)凝血酶原时间(PT)曲线下面积(AUC)人类免疫缺陷病毒(HIV)肾小球滤过率(GFR)食品药品管理局(FDA)世界卫生组织(WHO)随机对照试验(RCT)胎牛血清(FBS)体重指数(BMI)天冬氨酸转氨酶(AST)纤维蛋白原(Fb)血管性血友病因子(vWF)血红蛋白(Hb)严重急性呼吸综合征(SARS)乙型肝炎病毒(HBV)乙型肝炎病毒表面抗体(抗-HBs)乙型肝炎病毒表面抗原(HBsAg)乙型肝炎病毒e抗体(抗-HBe)乙型肝炎病毒e抗原(HBeAg)乙型肝炎病毒核心抗体(抗-HBc)直接胆红素(DBil)肿瘤坏死因子(TNF)重症监护病房(ICU)自然杀伤细胞(NK细胞)总胆固醇(TC)总胆红素(TBil)最小抑菌浓度(MIC)
318000 台州市中心医院放疗科(刘艳梅、潘印、应申鹏);温州医科大学附属第一医院肿瘤外科(梁勇)
梁勇,E-mail:liangytu@aliyun.com

