O-GIcNAc转移酶在直肠癌中的分布及其对预后的影响
徐道绲 杨海华 钱伟 王微 边屯
●论 著
O-GIcNAc转移酶在直肠癌中的分布及其对预后的影响
徐道绲 杨海华 钱伟 王微 边屯
目的 了解O-GIcNAc转移酶(O-GlcNAc transferase,OGT)在直肠癌中的表达情况及对预后的影响。 方法 利用免疫组化技术,在直肠癌组织芯片上染色OGT,确定表达情况,并与患者临床资料结合,了解OGT的表达与直肠癌患者的生存是否有差异。 结果 OGT在直肠癌组织中的表达情况:“-”12.22%、“+”27.78%、“++”44.44%、“+++”15.56%,癌旁组织中的表达情况:“-”18.89%、“+”42.22%、“++”37.78%、“+++”1.11%;癌组织中OGT高表达(++和+++)为60.00%,高于癌旁组织中OGT高标的量38.89%;OGT高表达直肠癌患者的3年生存率分别是82.90%和60.00%,两者比较有统计学差异(χ2=7.452,P=0.006)。 结论OGT在直肠癌中的表达高于周围正常组织,直肠癌中高表达的3年生存率较低,OGT可能参加了肿瘤的发生、发展过程。
直肠癌O-GIcNAc转移酶 组织芯片 免疫组化 预后
氧连接的β-N-乙酰葡萄糖胺修饰(O-GlcNAc)是一种广泛存在于细胞浆和细胞核蛋白质丝氨酸和苏氨酸上的动态、可逆的翻译后修饰,与经典的糖基化修饰不同,而类似于磷酸化,介导O-GlcNAc基团添加和移除的酶分别是O-GIcNAc转移酶(O-GlcNAc transferase,OGT)和O-GIcNAc水解酶(O-GlcNAcase,OGA)[1-2]。OGT与肿瘤的发生可能有密切关系,因为有很多原癌基因和抑癌基因产物都表现OGlcNAc修饰,如c-Myc、p53、Rb等[3-6]。OGT在直肠癌中的表达情况和对预后的影响目前尚无报道,对OGT在直肠癌中的研究不仅有助于人们了解肿瘤的发生、发展过程,同时也可能推动新的肿瘤细胞靶向治疗的发展。
1 资料和方法
1.1 一般资料 人类直肠癌组织芯片购于上海芯超生物科技有限公司(Shanghai Outdo Biotech Co.,Ltd.)。生存期直肠癌180点组织芯片阵列编号HRec-Ade180Sur-02,人类直肠腺癌组织,福尔马林固定。总例数90例,总点数180点 (癌及相应癌旁组织各取一点),点直径2.0mm,芯片厚度4μm。OGT一抗购买于美国Abcam公司(ab96718)。羊抗兔二抗购买于美国Abcam公司。
1.2 方法
1.2.1 免疫组化
1.2.1.1 染色 常规石蜡切片脱蜡、水化;抗原修复:取柠檬酸盐缓冲液(pH6.0)煮沸,放入脱蜡水化后的组织切片,加热维持30min,室温放置自然冷却,取出玻片,PBS冲洗5min×3次;3%双氧水.甲醇溶液浸泡玻片,以消除内源性过氧化物酶,室温孵育15min,PBS冲洗5min×3次;3%BSA溶液封闭,室温10min,甩去封闭液;用3%BSA溶液按比例(OGT抗体1∶200)稀释一抗,4℃湿盒过夜孵育;次日取出后置于室温,复温30min,PBS冲洗5min×3次;用3%BSA溶液按1∶11 000稀释二抗,室温60min,PBS冲洗5min×3次;新鲜配制的DAB溶液避光显色,显微镜下观察,自来水冲洗终止显色;苏木精复染细胞核,自来水冲洗返蓝;组织切片依次经过梯度酒精(70%、80%、95%、100%)脱水,二甲苯透明化,中性树脂封片。
1.2.1.2 染色评分方法 参照Fromowitz standard方法,取五个点的平均值。每个点的OGT强度由染色的强度与范围相加得到。染色强度分为四个等级:无染色为0,弱染色为1,中度染色为2,强度染色为3;染色范围分四个等级:0表示0%~25%,1表示26%~50%,2表示51%~75%,3表示76%~100%。芯片上每个点的综合强度为五个视野的平均值。两者乘积0~1为-,2~4为“+”,4~6为“++”,7-9为“+++”。低表达为“-”和“+”,高表达为“++”和“+++”[7]。
1.3 统计学处理 采用SPSS 13.0统计软件。组间计数资料比较采用χ2检验,计量资料比较采用t检验。两组间生存曲线比较采用Log-Rank检验。
2 结果
2.1 OGT表达不同患者临床资料比较 见表1。
由表1可见,OGT表达不同患者临床资料比较差异均无统计学意义(均P>0.05)。
2.2 OGT在直肠癌及正常/癌旁组织中的表达情况 见图1、2。

图1 OGT在癌旁组织和癌组织中的表达情况
由图1、2可见,OGT在直肠癌组织中表达分别为“-”12.22%、“+”27.78%、“++”44.44%、“+++”15.56%,正常/癌旁组织中的表达情况分别为“-”18.89%、“+”42.22%、“++”37.78%、“+++”1.11%。
2.3 OGT在直肠癌及正常/癌旁组织中的表达分布比较 见图3。由图3可见,OGT在癌组织中OGT高表达(++和+++)为61%,高于正常/癌旁组织中OGT高表达的量(40%)。
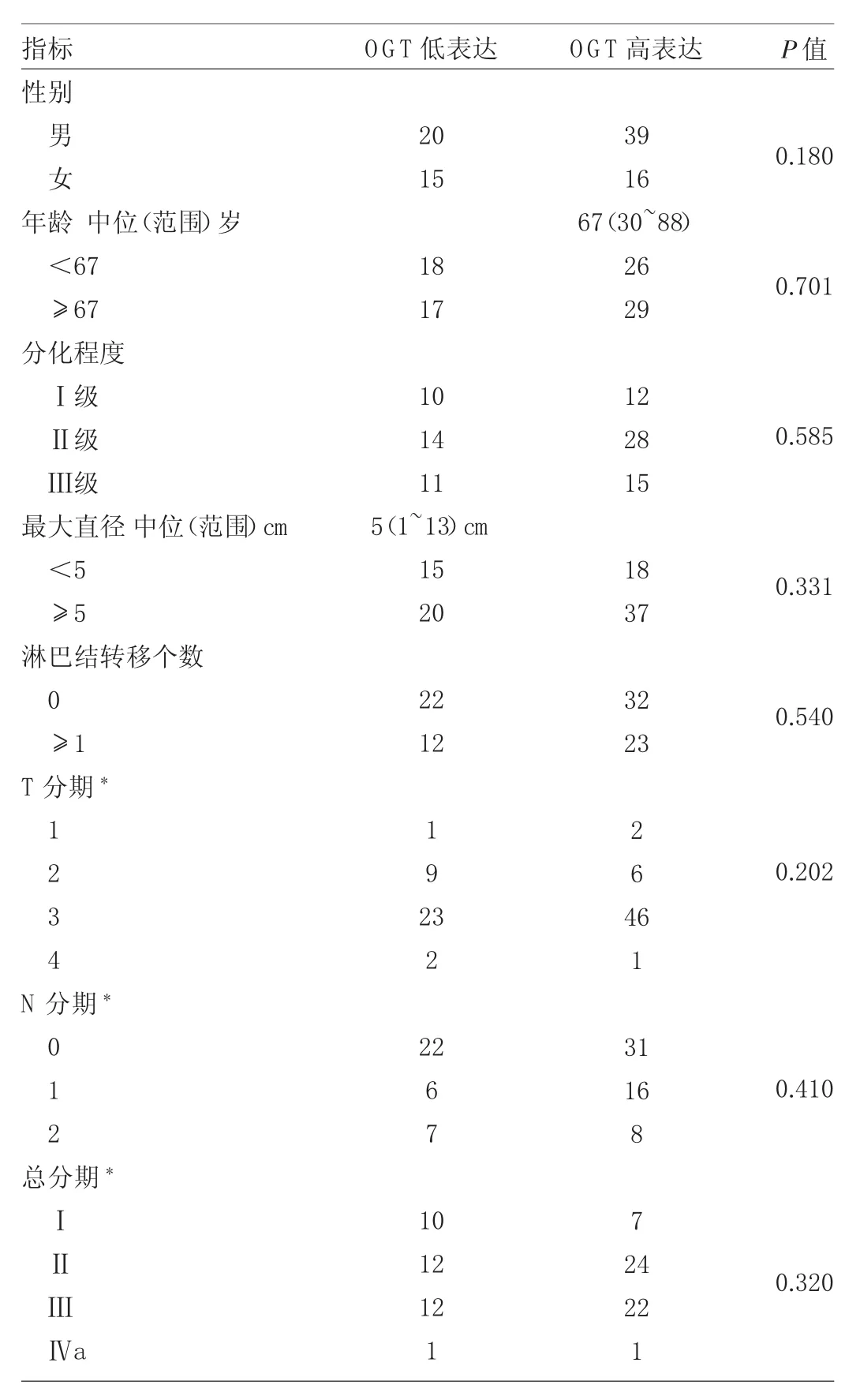
表1 OGT表达不同患者临床资料比较(例)

图2 OGT在癌组织和正常/癌旁组织中的分布图
2.4 OGT表达对直肠癌患者生存的影响 见图4。由图4可见,OGT高表达和低表达的直肠癌患者3年生存率分别是60.00%和82.90%,两者比较差异有统计学意义(χ2=7.452,P=0.006)。

图3 OGT在直肠癌及正常/癌旁组织中的表达分布比较
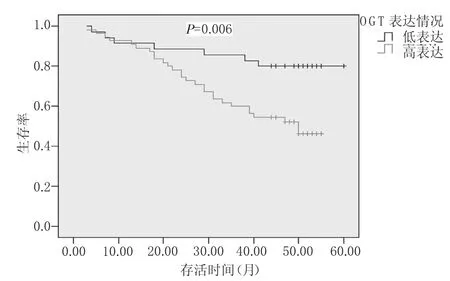
图4 OGT的表达对直肠癌患者生存的影响
3 讨论
编码OGT的基因在许多生物中都被克隆到,并且高度保守,人和大鼠的OGT有99%的同源性,OGT蛋白包括N端的蛋白质靶向信息序列、34氨基酸重复序列(TPR)、连接区域、和C端的催化结构域。OGT的催化结构域高度保守,很多与肿瘤发生、发展相关的蛋白质都被证明具有O-GlcNAc修饰,比如核蛋白c-Myc、抑癌蛋白p53、Rb03J、连环蛋白E-catenin、转录因子NFATl和NF-KB等。众多研究结果暗示,O-GlcNAc修饰可能通过调节特定的肿瘤相关蛋白的活性,参与影响肿瘤的发生、发展[8-9]。
研究证实,癌细胞具有较高的葡萄糖摄入和利用率,并且在癌细胞中可检测到HBP通路上调和UDPGlcNAc浓度的升高。HBP通路作为糖酵解的分支之一,其重要意义并不在于提供能量,而是为癌细胞快速增殖提供重要的代谢合成原料,如谷氨酰胺、乙酰辅酶A、UTP等。而UDP-GlcNAc浓度升高,可引起细胞内的O-GlcNAc修饰水平上调[2,10]。此前的研究结果已经证明,在乳腺癌和肺癌组织中,O-GlcNAc修饰水平显著增加[11]。Yang等[12]发现乳腺癌细胞中O-GlcNAc修饰水平显著升高,OGT的mRNA和蛋白表达量也增加。本研究发现,OGT高表达在直肠癌细胞中(60.00%)明显高于癌旁正常组织(38.89%,P<0.05),而且在直肠癌组织中OGT高表达的患者3年生存率(60.00%)明显低于低表达的患者(82.90%,P<0.05)。这个研究结果进一步表明,OGT修饰对肿瘤的发生、发展过程可能有重要的影响作用,值得进一步研究其作用机制。
[1] Torres C R,Hart G W.Topography and polypeptide distribution of terminal N-acetylglucosamine residues on the surfaces of intact lymphocytes[J] .J BiolChem,1984,259(5):3308-3317.
[2] Hart G W,Housley M P,Slawson C:Cycling of O-linked beta-N-acetylglucosamine on nucleocytoplasmic proteins[J] .Nature,2007,446(7139):1017-1022.
[3] Chou T Y,Hart G W,Dang C V:c-Myc is glycosylated at threonine 58,a known phosphorylation site and a mutationalhot spot in lymphomas[J] .J BiolChem,1995,270(32):18961-18965.
[4] Yang W H,Kim J E,Nam H W,et al.Cho J W:Modification of p53 with O-linked N-acetylglucosamine regulates p53 activity and stability[J] .Nat CellBiol,2006,8(10):1074-1083.
[5] Zachara N E,Hart G W.O-GlcNAc a sensor of cellular state:the role of nucleocytoplasmic glycosylation in modulating cellular function in response to nutrition and stress[J] .Biochim Biophys Acta,2004,1673(1-2):13-28.
[6] Golks A,Tran T T,Goetschy J F.Guerini D:Requirement for O-linked N-acetylglucosaminyltransferase in lymphocytes activation[J] .EMBO J,2007,26(20):4368-4379.
[7] Fromowitz F B,Viola M V,chao S,et al.Res p21expression in the progression of breast cancer[J] .Humpathol,1987,18:1268-1275.
[8] Sherr C J,McCormick F.The RB and p53 pathways in cancer[J] . Cancer Cell,2002,2(2):103-112.
[9] Kreppel L K,Blomberg M A,Hart G W.Dynamic glycosylation of nuclear and cytosolic proteins.Cloning and characterization of a unique O-GlcNAc transferose with multiple tetratricopeptide repeats[J] .J BiolChem,1997,272(14):9308-9315.
[10] Wice B M,Trugnan G,Pinto M,et al,The intracellular accumulation of UDP-N-acetylhexosamines is concomitant with the inability of human colon cancer cells to differentiate[J] .J Biol Chem,1985,260:139,146.
[11] 葛宇清,顾玉超,于文功.N-乙酰氨基葡萄糖转移酶II促进小鼠乳腺癌细胞迁移研究[J] .中国生物工程杂志,2007,27(5):6-10.
[12] Yang X,Zhang F,Kudlow J E.Recruitment of O-GlcNAc transferase to promoters by corepressor mSin3A:coupling protein O-GlcNAcylation to transcriptional repression[J] .Cell,2002, 110(1):69-80.
Expression of O-GIcNAc transferase in rectal cancer and its relation to disease prognosis
XU Daokun,YANG Haihua,QIAN Wei,et al.
Department of Coloretal Surgery,Wenling TCM Hospital,Wenling 317500,China
Objective To investigate the expression of O-GIcNAc transferase(OGT)and its relation to prognosis in rectal cancer. Methods The expression of OGT was detected with immunohistochemical technique on rectal cancer tissue microarray. The association of OGT expression with survival of patients was analyzed. Results The high OGT expression(++and+++) rate in rectal cancer was higher than that in pericancerous tissue(60.0%vs 38.9%,P<0.05).The 3-years survival rate in patients with high OGT expression was lower than that with low expression(60.0%vs 82.9%,χ2=7.452,P=0.006). Conclusion OGT expression in rectal cancer is higher than that in normal tissue.Rectal cancer patients with high OGT expression may have less favorable prognosis than those with low OGT expression.
Rectal cancer O-GIcNAc transferase(OGT) Tissue microarray ImmunohistochemicalPrognosis
2014-06-30)
(本文编辑:田云鹏)
浙江省医药卫生科技项目(2011KY B146)
317500 温岭市中医院肛肠外科(徐道绲、钱伟、边屯);台州医院放疗科肿瘤细胞和分子放射生物实验室(杨海华、王微)

