HPLC-ELSD法分析破壁灵芝孢子粉的多糖组成
尚 姝, 于 青
(1.江苏省食品药品监督检验研究院,江苏南京210008;2.中国药科大学,江苏南京210009)
HPLC-ELSD法分析破壁灵芝孢子粉的多糖组成
尚 姝1, 于 青2
(1.江苏省食品药品监督检验研究院,江苏南京210008;2.中国药科大学,江苏南京210009)
目的建立HPLC-ELSD法对破壁灵芝孢子粉中多糖的单糖组成进行分析。方法采用Shodex Asahipak NH2P-50 4E色谱柱 (4.6 mm×250 mm,5μm);流动相为乙腈-水 (83∶17);体积流量1.0 m L/m in;进样量10μL;柱温30℃;ELSD检测条件为漂移管温度85℃,载气体积流量2.0 mL/min。结果岩藻糖、阿拉伯糖、木糖、果糖、氨基半乳糖、氨基葡萄糖、甘露糖、半乳糖和葡萄糖的进样量对数与峰面积对数在一定范围内均呈现出较好的线性关系,回收率均在87.5%~97.4%之间,而且RSD(n=6)均小于2%。结论该方法准确可靠,分离效果好,可用于破壁灵芝孢子粉多糖的单糖组成分析。
破壁灵芝孢子粉;高效液相蒸发光散射;多糖;单糖
灵芝为多孔菌科真菌赤芝Ganoderma lucidum(Leyss.ex Fr.)Karst.或紫芝G.sinense Zhao,Xu et Zhang的干燥子实体[1],而灵芝孢子则是灵芝进入生长成熟期后,从其菌褶中弹射出来的灵芝种子[2]。现代研究发现,灵芝孢子粉具有比子实体更突出的功效[3],其有效成分的种类和含有量均高于子实体[4]。对灵芝孢子进行破壁处理后发现,其提取液中有效成分含有量明显高于未破壁孢子[5]。灵芝多糖作为灵芝孢子中的有效成分,具有抗肿瘤、免疫调节、降血糖、抗氧化、抗衰老等药理活性[6-7],含有量达到 0.32% ~1.61%不等[8-9]。
目前灵芝多糖的定量测定方法有紫外分光光度法、薄层色谱法[10-11]、高效液相色谱-UV检测法[12-13]、 离子色谱法[14]和高效毛细管电泳法[15]等。本实验采用HPLC结合通用型蒸发光散射检测器(ELSD)对灵芝孢子粉多糖的单糖组成进行分析,其主要优点是样品无需衍生化即可测定,并能够排除其他成分及辅料的干扰。实验中使用相对于糖柱成本较低的氨基柱,能快速有效地对多糖中的单糖组成进行定性、定量分析,且该方法通用性强,重复性好,易于推广应用,为破壁灵芝孢子粉中多糖的质量控制提供依据。
1 仪器与试药
1.1 仪器 LC-30AD型高效液相色谱仪(日本Shimadzu公司),包括Alltech ELSD 2000ES检测器;GA-10B低噪音空气泵(北京中兴汇利科技发展有限公司);EYELA旋转蒸发仪(上海爱朗仪器有限公司);MX5电子天平(瑞士Mettler公司);纯水仪(美国Millipore公司);CPA224S电子天平(德国Sartorius公司)。
1.2 试剂 三氟乙酸 (分析纯,上海凌峰化学试剂有限公司);乙腈 (色谱纯,美国Fisher公司);乙醇 (分析纯,南京化学试剂有限公司);水为超纯水 (自制)。
1.3 对照品 甘露糖、葡萄糖、木糖、果糖、核糖、阿拉伯糖 (国药集团化学试剂有限公司,纯度均大于 98%,批号分别为 20121224、20130325、20130225、20121017、20121127、20121227);半乳糖 (惠兴生化试剂有限公司,纯度100%,批号为20120916);岩藻糖 (阿拉丁化学试剂公司,纯度100%,批号为D1303057);氨基半乳糖 (美国Sigma-aldrich公司,纯度100%,批号为1001486728)。1.4 样品 来源于3个厂家的市售破壁灵芝孢子粉3批,批号分别为A、B、C。
2 方法与结果
2.1 色谱条件 Shodex Asahipak NH2P-50 4E色谱柱(4.6 mm×250 mm,5μm);流动相为乙腈-水(83∶17);体积流量为1.0 mL/min;柱温30℃;对照品进样量为10μL,样品为100μL。蒸发光散射检测器的检测条件为漂移管温度85℃,载气体积流量2.0 L/min,增益1。
2.2 溶液的制备
2.2.1 对照品溶液的制备 分别精密称取葡萄糖50.34 mg、岩藻糖50.87 mg、氨基葡萄糖40.80 mg、果糖25.28 mg、氨基半乳糖80.19 mg、木糖201.39 mg、甘露糖403.98 mg、半乳糖805.24 mg、阿拉伯糖1 008.35 mg,置同一50 m L量瓶中,加水溶解并定容至刻度,摇匀,即得。
2.2.2 供试品溶液的制备 取研细混匀的样品内容物3 g,精密称定,置250 mL碘量瓶中,加水150 mL,水浴提取2 h,取出放冷,离心后取上清液。残渣再加水提取2次,提取液合并,减压浓缩,加入无水乙醇使乙醇体积分数达80%,4℃下放置12 h后取出,离心,弃去上清液。沉淀加水溶解,加入Sevage试剂混匀,振荡后离心,取上清液。重复上述操作,直至无浑浊产生,减压浓缩,加无水乙醇使乙醇体积分数达80%,沉淀完全,减压干燥后备用。将所得多糖干燥品转移到水解罐中,加入TFA,于110℃烘箱中水解,冷却后转移至蒸发皿中,水浴蒸干,加水洗涤,蒸干,用水重复洗涤3次,至TFA蒸发完全,加60%乙腈转移至10 mL量瓶中定容,摇匀后经微孔滤膜滤过,即得。
2.3 系统适用性实验 在 “2.1”项色谱条件下,岩藻糖、阿拉伯糖、木糖、果糖、氨基半乳糖、氨基葡萄糖、甘露糖、半乳糖和葡萄糖9种单糖分离度均大于1.5,理论塔板数以9种糖计均不低于4 000,如图1所示。
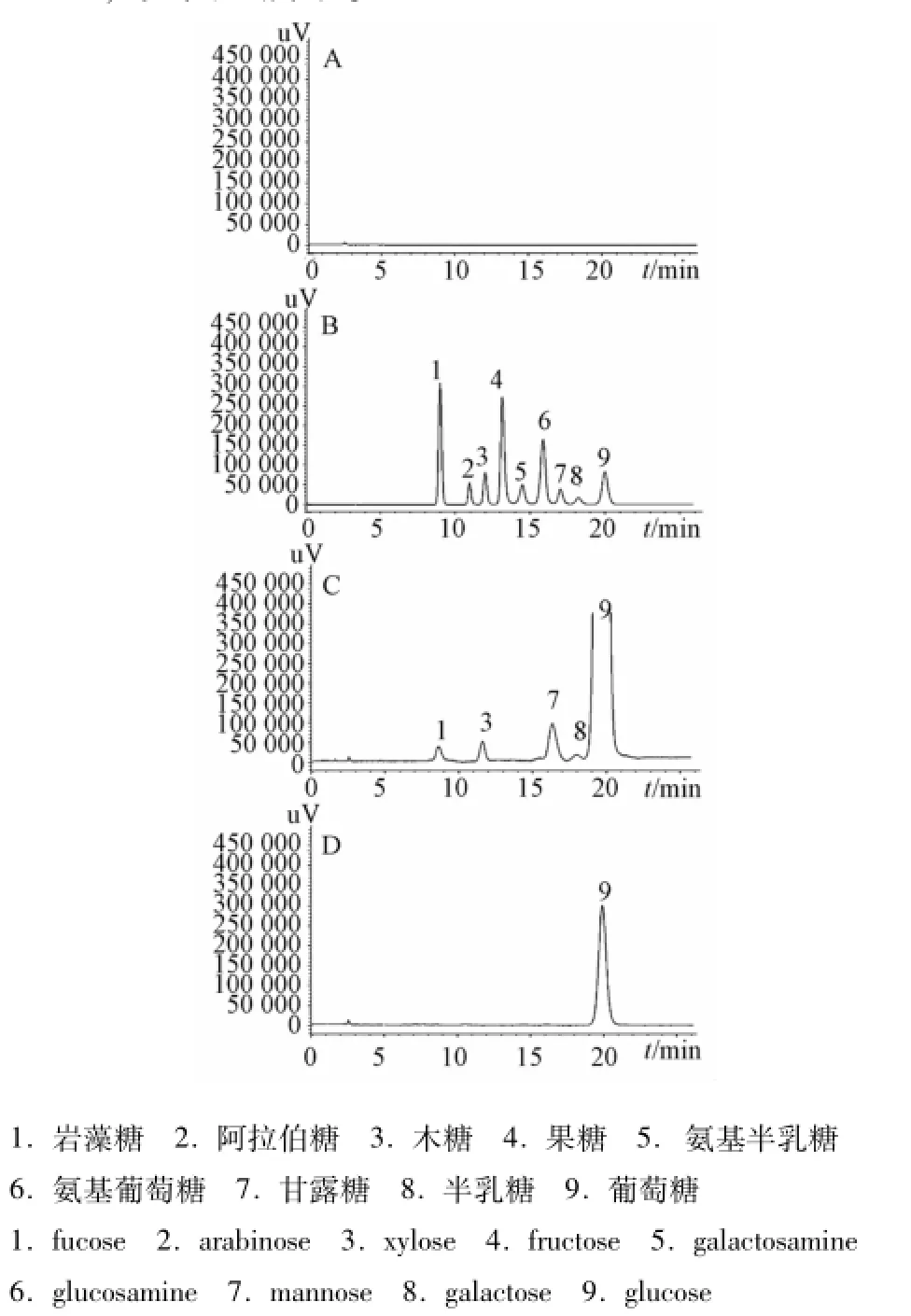
图1 溶剂空白 (A)、对照品溶液 (B)、样品溶液 (C)、稀释后的样品溶液(D)的HPLC-ELSD色谱图Fig.1 HPLC-ELSD chromatograms of blank(A)、m ixed reference substances(B),sam p le(C)and diluted sam p le(D)
2.4 线性关系 精密量取对照品溶液适量,用60%乙腈稀释成对照品系列溶液。按 “2.1”项下的色谱条件测定。以单糖峰面积的对数为纵坐标y,对照品进样量的对数为横坐标x,进行线性回归,结果见表1。
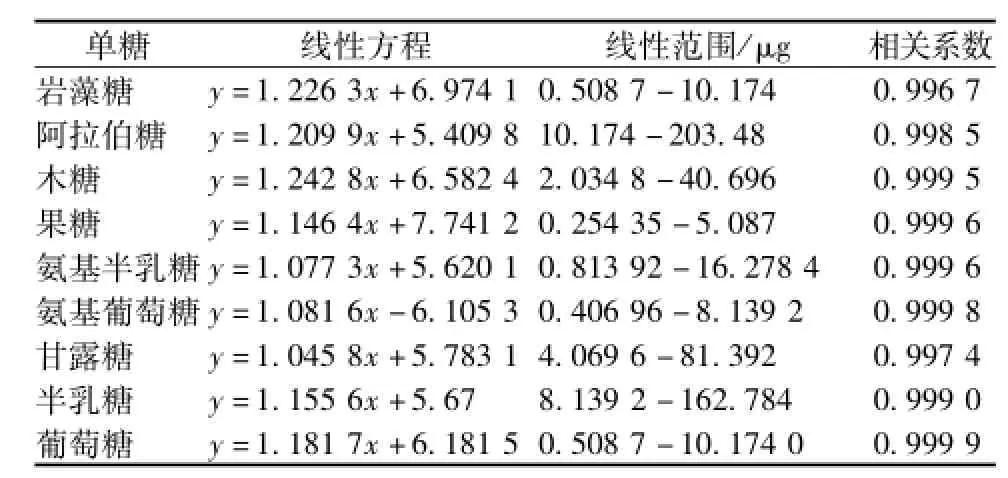
表1 9种单糖的线性方程和线性范围Tab.1 Regressive equation and linear range of 9 monosaccharides
2.5 检测限与定量限 将对照品溶液的色谱信号峰与基线信号进行比较,以信噪比约为3∶1时注入仪器的量确定为检测限,约为10∶1时注入仪器的量确定为定量限,得到9种单糖检出限和定量限。结果发现,岩藻糖、阿拉伯糖、木糖、果糖、氨基半乳糖、氨基葡萄糖、甘露糖、半乳糖和葡萄糖的检测限分别为0.1、2.0、0.4、0.05、0.16、0.08、0.8、1.6、0.1μg;定量限分别为 0.3、6.0、1.5、0.2、0.5、0.3、3.2、5.0、0.4μg。
2.6 仪器精密度 取对照品贮备液稀释到一定浓度,在 “2.1”项色谱条件下,测得9种单糖的峰面积值,得到岩藻糖、阿拉伯糖、木糖、果糖、氨基半乳糖、氨基葡萄糖、甘露糖、半乳糖、葡萄糖峰面积的RSD分别为1.8%、3.1%、1.2%、2.2%、2.5%、3.6%、2.6%、1.7%、1.5% (n =6),表明仪器精密度良好。
2.7 重复性 取厂家A灵芝孢子粉,按 “2.2.2”项下方法,平行制备6份供试品溶液,在 “2.1”项色谱条件下,检出5种单糖,并测定其峰面积。结果表明,岩藻糖、木糖、甘露糖、半乳糖、葡萄糖的RSD分别为2.4%、3.3%、5.2%、1.9%、1.7%,表明方法重复性良好。
2.8 稳定性 取同一份供试品溶液,在 “2.1”项色谱条件下,于0、2、4、8、12、24 h测定,结果检出5种单糖,并测得其峰面积。结果表明,岩藻糖、木糖、甘露糖、半乳糖、葡萄糖重复性的RSD分别为 2.1%、1.9%、1.8%、3.6%、2.3%,表明供试品在24 h内基本稳定。
2.9 准确度 取厂家A灵芝孢子粉样品6份,每份称取 1.5 g,加入一定量的对照品溶液,按“2.2.2”项方法操作,制备回收率用供试品溶液。在 “2.1”项色谱条件下,测定9种单糖峰面积,计算回收率,结果见表2,表明方法准确度良好。

表2 9种单糖的水解回收率试验考察 (n=6)Tab.2 Results of recovery tests for 9 m onosaccharides(n=6)
2.10 样品的测定 取3个品牌的破壁灵芝孢子粉,按“2.2.2”项下方法制备供试品溶液,按 “2.1”项下的色谱条件进行实验。由于葡萄糖量太高,超出线性范围,故将上述供试品溶液稀释10倍后进样10μL,测定葡萄糖的量,样品的水解产物如图1所示。结果表明,破壁灵芝孢子粉中灵芝多糖的水解产物主要为葡萄糖,另外还含有少量的木糖、甘露糖、半乳糖和岩藻糖等,见表3。
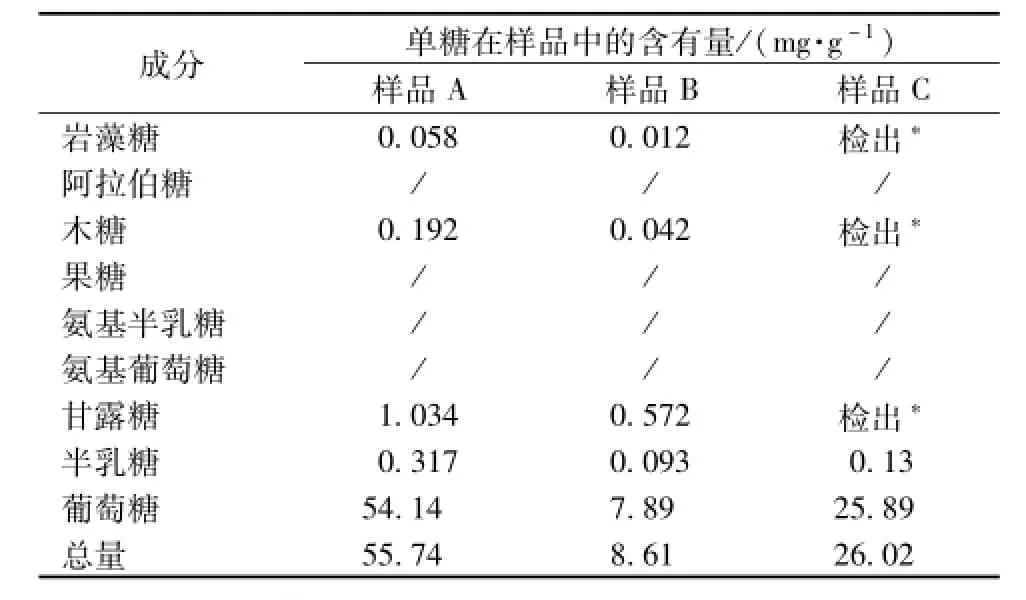
表3 破壁灵芝孢子粉样品中多糖的水解液中单糖的测定结果Tab.3 Results of monosaccharide contents in hydrolysate of polysaccharide in broken spore powder from Ganoderma lucidum sam p le
3 讨论
3.1 色谱柱的选择 测定单糖的色谱柱一般有糖柱和氨基柱,但糖柱价格昂贵,故选择常规的氨基柱进行破壁灵芝孢子粉中的单糖分析。本实验比较了Agilent ZORBAX NH2柱(4.6 mm×250 mm,5 μm)、Sepax HP-Amino氨基柱(4.6 mm×300 mm,5μm)以及Shodex Asahipak NH2P-50 4E柱(4.6 mm×250 mm,5μm)分离9种单糖的效果。结果表明,Agilent氨基柱及Sepax氨基柱可能因氨基易流失,从而基线易上移,而Shodex氨基柱是以聚合物为基材的氨基柱,化学稳定性良好,对流动相的耐受性更好,分离度理想,柱效高,故选择此柱作为本实验的分析柱。
3.2 流动相系统的优化 高效液相色谱法分析糖类化合物所用流动相一般为水和乙腈的混合溶液。氨基柱在分离单糖时表现为正相的保留机理,随着乙腈比例增加,单糖保留增强,分离度上升。调整乙腈的比例分别为80%、85%、83%,综合单糖之间的分离度和分析时间,选择83%的乙腈作为流动相。
3.3 ELSD条件的选择 影响ELSD的两个重要参数是漂移管温度和载气体积流量,两者对组分的保留时间影响较小,但对信噪比的影响较大,因此建立适当的HPLC-ELSD分析方法时,需对这两个参数进行优化。经过实验考察,综合响应和噪音大小,选择漂移管温度为85℃,载气体积流量为2.0 mL/min。
3.4 水解条件的优化 水解是单糖组成分析和含量测定的关键步骤,对其条件进行优化十分必要。本实验使用蒸发光散射检测器,故选用易挥发的TFA作为水解用酸,考察了TFA浓度、水解时间及水解温度。最终确定实验条件为TFA浓度2 mol/L,水解温度为110℃,水解时间2 h,密封。
3.5 样品比较分析 三个厂家产品的单糖含有量差异较大,最高与最低差异约有7倍,这说明不同厂家之间的产品质量有明显区别。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:174.
[2]张 伟,曾园山.灵芝孢子的研究进展[J].中西医结合学报,2004,11(2):463-465.
[3]张卫明,孙晓明,吴素玲,等.灵芝孢子粉免疫调节作用研究[J].中国野生植物资源,2000,20(1):19-20,34.
[4]陈军辉,吴凤琪,李文龙,等.灵芝孢子粉与子实体中三萜类化合物、多糖及重金属元素的含量比较[J].中国药房,2008,19(33):2585-2587.
[5]倪江洪,宋炳生,李汉宝,等.灵芝孢子破壁对其多糖提取率的影响[J].中草药,2002,33(5):422.
[6]董虹玲,夏广萍,赵 娜,等.HPLC法测定灵芝子实体和孢子粉中灵芝酸C2、灵芝酸G和灵芝酸A[J].现代药物与临床,2013,28(1):41-43.
[7]刘 佳,王 勇.灵芝多糖的研究进展[J].现代药物与临床,2012,27(6):629-634.
[8]毛维伦,许腊英,李顺超,等.灵芝胶囊中多糖含量的测定[J].中国医院药学杂志,2001,21(7):446.
[9]刘艳平,蔡红军,林丽丽,等.不同菌种培养的灵芝中多糖含量的测定[J].广州中医药大学学报,1999,16(1):54-54.
[10]钱夕惠.薄层色谱法分析灵芝多糖中的单糖组成[J].中国现代药物应用,2013,7(18):13-14.
[11]颜 军,郭晓强,李晓光,等.TLC快速分析多糖的单糖组成[J].食品科学,2006,27(12):603-607.
[12]陈 亮,彭雅娟,钱一帆,等.高效液相色谱法测定灵芝孢子粉软胶囊中多糖含量的研究[J].时珍国医国药,2007,18(6):1372-1374.
[13]王赛贞,林树钱,林志彬,等.灵芝多糖肽中单糖的组成[J].中草药,2007,38(2):174-176.
[14]于 青,尚 姝,冯有龙,等.离子色谱法测定灵芝孢子粉中多糖的含量[J].中国药学杂志,2014,49(2):344-347.
[15]梁加贝,陈 新,王 菁,等.高效毛细管电泳法测定灵芝多糖中单糖的组成[J].药物分析杂志,2008,28(11):1851-1853.
Analysis of m onosaccharides of polysaccharides in broken spore powder from Ganoderma lucidum by HPLC-ELSD
SHANG Shu1, YU Qing2
(1.Jiangsu Institute for Food and Drug Control,Nanjing 210008,China;2.China Pharmaceutical University,Nanjing 210009,China)
AIMTo develop an HPLC-ELSD method for analyzingmonosaccharide composition of polysaccharides in broken spore powder isolated from Ganoderma lucidum.METHODSThe separation was performed on Shodex Asahipak NH2P-50 4E(4.6 mm×250mm,5μm).Themobile phase was composed of acetonitrile-water(83∶17)ata flow rate of1.0mL/min,the column temperaturewasmaintained at30℃.The drift tube temperature of ELSD was set at85℃and gas flow was 2.0 mL/min.RESULTSFucose,arabinose,xylose,fructose,galactosamine,glucosamine,mannose,galactose and glucose all had good linearity.Their recoveries ranged from 87.5%-97.4%with RSDs less than 2%(n=6),respectively.CONCLUSIONThe proposedmethod isaccurate and has good separation,which can be used for the analysis ofmonosaccharide composition of polysaccharides in broken spore powder G.lucidum.
broken spore powder from Ganoderma lucidum;HPLC-ELSD;polysaccharides;monosaccharide
R284.1
:A
:1001-1528(2015)06-1272-04
10.3969/j.issn.1001-1528.2015.06.024
2014-09-24
尚 姝(1981—),女,硕士,主管药师,从事药物分析研究。Tel:(025)86630712,E-mail:copymee@126.com

