HR-HPV检测在宫颈癌同步放化疗疗效评估中的作用
朱虹 高军
1.江西省人民医院妇科,江西南昌330006;2.南昌大学医学院,江西南昌330006
HR-HPV检测在宫颈癌同步放化疗疗效评估中的作用
朱虹1,2高军1▲
1.江西省人民医院妇科,江西南昌330006;2.南昌大学医学院,江西南昌330006
目的分析宫颈癌同步放化疗后高危型人乳头瘤病毒(HR-HPV)清除情况,探讨HR-HPV检测在评价宫颈癌近期疗效中的意义。方法回顾性研究2010年1月~2013年10月在我院接受根治性放化疗的宫颈鳞癌患者共104例,治疗前HR-HPV均为阳性,FIGO分期为ⅠB~ⅢB期,采用第二代杂交捕获实验(HC2),于放疗结束后3、6个月分别进行HR-HPV检测,分析HR-HPV在评价宫颈癌同步放化疗后近期疗效的价值。结果入组病例中,HR-HPV自然清除81例,持续感染23例,放化疗后HR-HPV的阳性率明显低于治疗前;HR-HPV持续感染人群中病变残留和复发率为17.4%,高于HR-HPV转阴性组。HR-HPV阳性组与阴性组复发率比较,差异有统计学意义(P<0.05)。结论在宫颈癌同步放化疗后,HR-HPV的清除率较高,HR-HPV持续感染与病变残留或复发密切相关。
宫颈癌;高危型人乳头瘤病毒;同步放化疗;局部残留和复发
宫颈癌是女性常见的妇科恶性肿瘤之一,其发病率高居女性生殖系统恶性肿瘤的首位[1-3]。近年来,以手术治疗为主的综合治疗使宫颈癌的治愈率及生存率得到显著改善。然而中晚期宫颈癌不适合手术治疗,其复发率高,根治性放化疗是其主要的治疗手段。随着放化疗技术的提高,中晚期宫颈癌的死亡率有所下降,但仍有20%~25%的患者出现盆腔局部复发[4]。高危型人乳头瘤病毒(high-risk human papilloma virus,HRHPV)感染被认为是宫颈浸润癌和癌前病变产生的一个必要条件[5,6]。现有研究表明,HR-HPV检测对于宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)或放疗后病变残留或复发有一定的临床意义[7,8]。本研究回顾性分析2010年1月~2013年10月在我院行根治性放化疗的HR-HPV阳性的104例宫颈癌患者治疗前后的HR-HPV表达,探讨同步放化疗后HR-HPV的清除情况及病灶残留与局部复发的关系。
1 资料与方法
1.1 研究对象
选择2010年1月~2013年10月我院收治的经宫颈活检确诊的104例宫颈癌患者,治疗前HR-HPV均为阳性,病理诊断均为鳞状细胞癌,FIGO分期为ⅠB2~ⅢB期。见表1。

表1 患者的一般资料比较[n(%)]
1.2 根治性放疗和同步放化疗
所有患者采用前后对穿盆腔外照射,剂量为45~ 50 Gy[(1.5~2.0)Gy/次,分25次完成],3060或4000 cGy后中央挡铅,采用高剂量率后装治疗,5~7次,每次(6~7)Gy。除4例年龄大于70岁或合并内科疾病不适宜同步化疗的患者外,所有患者均接受4~6个周期的同步化疗[顺铂40 mg/(m2·kg)]。
1.3 随访时间及内容
所有患者均定期随访,前两年每3个月一次,第三年后每6个月一次,该组患者随访时间为6~52个月。随访期间采用超声检查、MRI检查等观察肿瘤体积变化。并进行HR-HPV检测联合液基薄层细胞学检测(thinprep cytologic test,TCT),必要时行阴道镜检查,可疑部位行宫颈活检。宫颈活检的指征为:任何一次复查TCT结果提示为大于无明确诊断意义的非典型鳞状细胞(atypical squamous cells of undetermined sig nificance,ASCUS)或TCT结果ASCUS,但HR-HPV阳性,且HR-HPV阳性持续6个月以上,TCT持续为ASCUS 6个月以上。
1.4 HR-HPV检查
采用美国DIGENE公司研制开发的第二代杂交捕获检测系统,将专用的HPV取样器插入宫颈外口,顺时针或逆时针转动6圈。取宫颈鳞柱状上皮交界处分泌物,检测高危型HPV16、18、31、33、35、39、41、52、 56、58、59、68,RLU/CO比值≥1.0,即诊断为HR-HPV感染阳性;HPV持续感染定义为6~12个月间隔时间内连续2次以上随访检测到同亚型的HPV-DNA。
1.5 结果判定
依据实体肿瘤治疗疗效标准判定[9]:治疗后肿瘤完全消失且持续4周以上为完全缓解(CR);肿瘤体积缩小50%以上,且时间持续4周以上为部分缓解(PR);治疗后肿瘤体积缩小50%以下,且持续时间4周以上为稳定(SD);治疗后肿瘤体积无变化或增大25%以上,或出现新的病灶,持续时间4周以上,为进展(PD)。总有效=CR+PR。宫颈癌放化疗后3个月以上出现新的病灶为复发,3个月以内为未控或病变残留。复发或病变残留均以组织病理学诊断为准。
1.6 统计学处理
采用SPSS17.0统计软件对数据进行统计学分析,患者的病例数、临床资料采用计数、百分比描述;组间比较采用四格表χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
所有患者均完成随访,随访时间为6~52个月。
2.1 放疗结束后HR-HPV的清除情况
治疗后6个月,在所有的病例中,HR-HPV自然清除81例(77.9%),持续感染23例,放化疗后HRHPV的阳性率明显低于治疗前;两组的临床资料比较无显著性差异,1例治疗后3个月HR-HPV阳性患者6个月时转阴,3、6个月时HR-HPV阳性率分别为23.08%(24/104)、22.12%(23/104)。
2.2 放疗后持续HR-HPV感染与复发的关系
81例HR-HPV清除的患者中CR 68例,PR 12例,SD 1例;23例持续感染的患者16例CR,3例PR,1例未控,3例出现局部复发。HR-HPV持续感染人群中病变残留和复发率17.4%(4/23),高于HR-HPV清除组。HR-HPV阳性组与阴性组复发率比较,差异有统计学意义(P<0.05),见表2。所有患者最终均依靠阴道镜活检确诊。
3 讨论
据2012年世界卫生组织统计,全球每年新发宫颈癌病例约52.8万,死亡病例约26.6万,其中85%发生在发展中国家,是女性癌症死亡的首要原因[2]。我国宫颈癌的发病率一直处于世界的前列,患病率及病死率约占世界1/3,且具有年轻化趋势,很多患者在初诊时已处于中晚期。中晚期宫颈癌患者预后差,究其原因可能与其局部复发后治疗困难有关。因此采用有效手段进行治疗后随访尤为重要。目前临床常用TCT检查,但因受到放疗后电离辐射的影响,宫颈细胞容易在形态学上发生变化,造成模棱两可的结果,影响其准确性,检出率低,临床价值有限。近期研究显示,在放疗结束后的前4个月内,28%的细胞学检测是不典型的,再往后比例逐渐降低[10]。本研究中,4例未控与局部复发的HR-HPV阳性的患者中,有2例为TCT阴性,证实了上述观点。我们的研究结果显示,在诊断局部复发之前,细胞学检测鉴别意义低。因此,寻找一种更好的常规随访手段具有重要的意义。
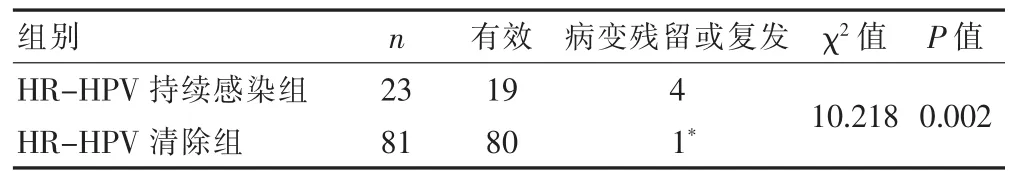
表2 治疗后HR-HPV与病变残留和局部复发的关系
HPV为一种双链嗜上皮性DNA病毒,在人和动物中分布广泛,迄今为止,共发现其有200多个基因型,而其中约40个型别涉及生殖道感染[11,12]。研究发现,HPV与宫颈癌癌前病变的发生发展密切相关,Psyrri A等[13]报道有99.7%的宫颈癌组织活检标本中可检测到HPV-DNA,HPV(特别是HR-HPV)的持续感染是宫颈癌发生的重要病因[14]。流行病学调查显示,HR-HPV感染与宫颈病变程度呈正相关,宫颈病变程度越重,HR-HPV的感染率也越高,CIN和宫颈癌中HR-HPV的感染率明显高于宫颈其他病变[10,15]。因此,我们认为监测HR-HPV的表达可用来评价宫颈癌的治疗效果,并用于预判宫颈癌的未控和复发。
本研究中,宫颈癌放化疗后HR-HPV的清除率为77.9%(81/104),高于Nagai Y等[8]报道的56.7%(110/194),我们分析可能与本组患者中大多数均接受了有效的根治性放化疗有关,而在Nagai Y[8]的报道中,仅35%的患者接受了同步放化疗。另外,各种文献报道的HR-HPV的清除规律也未达一致。本研究中,1例患者放疗后3个月检测为阳性,但在6个月时清除。因此,在放疗后早期的HR-HPV感染的处理中,我们应持谨慎态度,如果没有其他局部复发的临床证据,建议严密随访观察。
HR-HPV持续感染是CIN及宫颈癌的一个必要条件。本研究显示23例HPV持续感染的患者中,4例出现未控或局部复发,从而推测HR-HPV持续感染与放疗后未控或局部复发有密切关系。HR-HPV检测可以作为宫颈癌根治性放化疗后的一种常规的随访手段。但总的来说,本研究中局部复发率较低,可能与本组纳入的研究对象期别相对较早、无Ⅳ期患者、随访时间较短并且大多数患者均接受了全疗程的同步放化疗有关。此外,宫颈癌的局部复发还与一些其他的重要因素相关,如肿瘤大小、临床分期、分化程度等相关。因为本次研究入组病例有限,需进一步扩大病例数,行多因素分析研究对局部无病生存率及总生存率的影响。
[1]Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2]International Agency for Research on Cancer.Cervical CancerEstimatedIncidence,MortalityandPrevalence Worldwide in 2012[M].World Health Organization,2012.
[3]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[4]Gaffney DK,Erickson-Wittmann BA,Jhingran A,et al. ACR appropriateness criteria(R)on advanced cervical cancer expert panel on radiation oncology-gynecology[J]. Int J Radiat Oncol Biol Phys,2011,81(3):609-614.
[5]Kjaer SK,Frederiksen K,Munk C,et al.Long-term absolute risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection:Role of persistence[J].J Natl Cancer Inst,2010,102(19):1478-1488.
[6]Rodriguez AC,Schiffman M,Herrero R,et al.Longitudinal study of human papillomavirus persistence and cervical intraepithelial neoplasia grade 2/3:Critical role of duration of infection[J].J Natl Cancer Inst,2010,102(5):315-324.
[7]Song YJ,Kim JY,Lee SK,et al.Persistent human papillomavirus DNA is associated with local recurrence after radiotherapy of uterine cervical cancer[J].Int J Cancer,2011, 129(4):896-902.
[8]Nagai Y,Toma T,Moromizato H,et al.Persistence of human papillomavirus infection as a predictor for recurrence in carcinoma of the cervix after radiotherapy[J].Am J Obstet Gynecol,2004,191(6):1907-1913.
[9]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteriainsolidtumours:RevisedRECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[10]Rintala MA,Rantanen VT,Salmi TA,et al.PAP smear after radiation therapy for cervicalcarcinoma[J].Anticancer Res,1997,17(5B):3747-3750.
[11]夏吉荣,杨双双,祝佳丽,等.重庆地区妇女人乳头瘤病毒感染的调查分析[J].重庆医学,2012,41(9):892-894.
[12]Li J,Huang R,Schmidt JE,et al.Epidemiological features of Human Papillomavirus(HPV)infection among women living in Mainland China[J].Asian Pac J Cancer Prev,2013,14(7):4015-4023.
[13]Psyrri A,Di Maio D.Human papillomavirus in cervical and head-and-neck cancer[J].Nat Clin Pract Oncol, 2008,5(1):24-31.
[14]Schettino MT,Ammaturo FP,Grimaldi E,et al.Persistent papillomavirus type-31 and type-45 infections predict the progression to squamous intraepithelial lesion[J].Taiwan J Obstet Gynecol,2014,53(4):494-497.
[15]Pista A,de Oliveira CF,Lopes C,et al.Human papillomavirus type distribution in cervical intraepithelial neoplasia grade 2/3 and cervical cancer in Portugal:A CLEOPATREⅡstudy[J].Int J Gynecol Cancer,2013, 23(3):500-506.
The role of HR-HPV detection in assess the efficacy of concurrent chemoradiotherapy of cervical cancer
ZHU Hong1,2GAO Jun1
1.Department Gynecology,Jiangxi Provincial People's Hospital,Nanchang330006,China;2.Medical College of Nanchang University,Nanchang330006,China
ObjectiveTo analyze the clear situation of high-risk human papilloma virus(HR-HPV)after chemoradiotherapy of cervical cancer,and to explore the significance of HR-HPV detection in evaluating the effect of cervical cancer in the near future.MethodsFrom January 2010 to October 2013,104 patients of cervical squamous carcinoma who were treated with concurrent chemoradiotherapy were analyzed retrospectively.In all cases,The HR-HPV were positive before the treatment,FIGO stagingⅠB-ⅢB,the HR-HPV was detected at 3 and 6 months respectively after the chemoradiotherapy by the second-generation hybrid capture experiment(HC2),and the value of HR-HPV detection in cervical cancer in the near future curative effect after chemoradiotherapy were evaluated.Results In all cases,HRHPV disappeared in 81 cases,23 cases were persistent infection,the positive rate of HR-HPV infection was significant lower after chemoradiotherapy than before treatment;the local residual/recurrence rate was 17.4%in HR-HPV positive groups,higher than the HR-HPV negative groups.and the recurrence rate was statistically significant between two groups(P<0.05).Conclusion In cervical cancer after concurrent chemoradiotherapy,HR-HPV clearance rate is higher,HR-HPV persistent infection is closely related to the the residual or recurrence of disease.
Cervical cancer;Human papillomavirus;Chemoradiotherapy;Local residual/recurrence
R737.33
B
1673-9701(2015)18-0093-03
2015-04-09)
江西省科技计划项目(20123BBG70231)▲

