重组人血管内皮抑素联合顺铂局部治疗恶性胸腹腔积液的临床观察
郑俊琼 詹颖 廖雪燕
福建医科大学附属龙岩市第一医院放疗科,福建龙岩364000
重组人血管内皮抑素联合顺铂局部治疗恶性胸腹腔积液的临床观察
郑俊琼 詹颖 廖雪燕
福建医科大学附属龙岩市第一医院放疗科,福建龙岩364000
目的观察合并恶性胸腹腔积液的肿瘤患者予以重组人血管内皮抑素(恩度)联合顺铂局部胸腹灌注的近期疗效和安全性。方法46例经病理细胞学检查确诊合并恶性胸腹腔积液患者随机分成两组:实验组予顺铂60 mg d1.8 q3w联合重组人血管内皮抑素45 mg d1.4.8 q3w稀释灌注于胸腔,或顺铂60 mg d1.8 q3w联合重组人血管内皮抑素60 mg d1.4.8 q3w稀释灌注于腹腔;对照组予以单药顺铂60 mg d1.8 q3w稀释灌注于胸腹腔,同时予以静脉化疗,观察恶性胸腹腔积液情况、生活质量及不良反应。结果在实验组中胸腹水控制情况、生活质量提高与对照组比较,差异有统计学意义,两组比较不良反应差异无统计学意义。结论恶性胸腹腔积液予以重组人血管内皮抑素联合顺铂,配合静脉化疗,对恶性胸腹腔积液控制有较好近期疗效,无明显不良反应。
重组人血管内皮抑素;顺铂;恶性胸腹腔积液
恶性胸腹腔积液是肿瘤晚期患者常见并发症,其严重降低患者生活质量,加快肿瘤患者恶液质发展,缩短生存期。对化疗敏感肿瘤单纯静脉化疗,其胸腹水控制有一定疗效,但对化疗不敏感的肿瘤则疗效差,常需配合局部腔内治疗,如:予以胸腹腔积液引流,局部灌注细胞毒类药物或生物反应调节剂、硬化剂等。仅予胸腔抽液,胸水1个月内复发率100%,若单纯腹腔引流,腹水缓解期为10.4 d,配合细胞毒内药物腔内灌注,控制率仅30%~40%,仍有大量无法缓解的恶性浆膜腔积液。重组人血管内皮抑制素静脉使用已经成熟,其作用于血管内皮细胞,诱导肿瘤细胞凋亡,抑制癌细胞迁移。本文对2013年1月~2014年8月肿瘤患者经胸腹水病理确诊为恶性,予以局部引流后,胸腹腔内灌注药物,随机分为顺铂联合重组人血管内皮抑素组和顺铂单药组进行了前瞻性观察,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年1月~2014年8月我科46例经病理学或细胞学证实恶性胸腹腔积液的肿瘤患者,入组标准:①病理确诊恶性肿瘤患者,经病理学或细胞学确诊合并恶性胸水或腹水;②KPS≥50分,预生存期超过3个月;③无化疗禁忌证,肝肾功能正常,心功能Ⅰ~Ⅱ级;④近1个月内无胸腔、腹腔内灌注药物;⑤无明确药物过敏史,能耐受局部灌注药物治疗。患者及其家属已签署知情同意书。联合组(重组人血管内皮抑制素恩度+顺铂组)23例:恶性胸腔积液11例,腹腔积液12例;其中男16例,女7例,年龄30~76岁,中位年龄49.2岁;其中肺癌10例,食管癌2例,胃癌3例,肠癌2例,乳腺癌3例,卵巢癌3例。单药组(顺铂组):恶性胸腔积液12例,腹腔积液11例;其中男14例,女9例,年龄34~73岁,中位年龄49.6岁;其中肺癌9例,食管癌1例,胃癌2例,肠癌3例,乳腺癌5例,卵巢癌2例,宫颈癌1例。两组在年龄、性别、KPS评分方面比较,差异无统计学意义(P>0.05),肿瘤分类接近,具有可比性。
1.2 治疗方法
B超下置入胸腔、腹腔内单腔中心静脉导管,尽可能引流胸水或腹水后再进一步抽液减少胸腹腔内积液量,联合组予顺铂60 mg d1.8 q3w联合重组人血管内皮抑制素45 mg d1.4.8 q3w稀释胸腔内灌注,或顺铂60 mg d1.8 q3w联合重组人血管内皮抑制素60 mg d1.4.8 q3w腹腔内稀释灌注;单药组予以单药顺铂60 mg d1.8 q3w胸腹腔内稀释灌注,两组均给予静脉化疗药物,嘱患者腔内局部灌注药物后每15~30 min变换体位,持续2~6 h。(重组人血管内皮抑素系山东先声麦得津生物制药有限公司,批号:S20050088,顺铂系齐鲁制药有限公司,批号:8090162DB)灌注2个疗程后予以评价。
1.3 评价标准
①B超测胸腹腔积液量,按WHO评价标准:完全缓解(CR):胸腹腔积液完全消失,维持4周及以上;部分缓解(PR):胸腹腔积液量减少50%以上,并维持4周及以上;稳定(SD):积液量减少不足50%或增加不超过25%;进展(PD):积液增多超过25%。CR+ PR为有效率(RR)。②生活质量(QOL):KPS评分增加≥10分为改善,<10分为稳定,减少≥10分为下降。③不良反应按NCI CTC3.0版评价毒副反应。
1.4 统计学分析
采用SPSS17.0统计学软件处理数据,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效比较
46例患者均完成2周期腔内灌注药物,联合组有效率65.2%,单药组30.14%,两组有效率比较差异有统计学意义(χ2=5.57,P<0.05)。见表1。

表1 两组疗效比较[n(%)]
2.2 两组患者生活质量评价
实验组生活质量(QOL)改善13例,下降5例,5例无明显改变,对照组改善6例,下降9例,8例无明显改变。两组生活质量改善率差异有统计学意义(χ2=4.39,P<0.05)。见表2。

表2 两组患者KPS评分比较[n(%)]
2.3 两组患者毒副反应比较
所有患者均无胸闷、心悸、胸膜反应、心律失常、过敏反应等,完成治疗,耐受性好。毒副反应主要为骨髓抑制、胃肠道反应、乏力等,未见3~4度毒副反应,两组比较差异无统计学意义(P>0.05)。见表3。
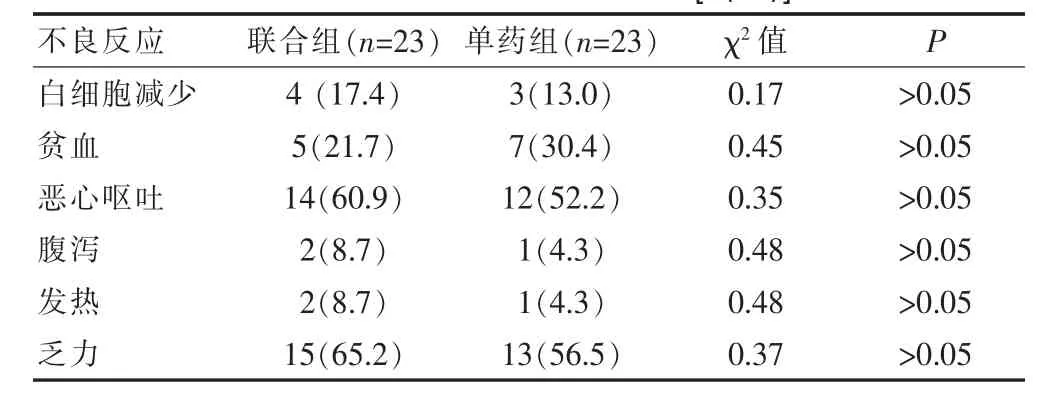
表3 两组患者不良反应比较[n(%)]
3 讨论
恶性胸、腹腔积液是晚期肿瘤患者常见并发症,是肿瘤患者主要死因之一。合并恶性胸腔积液患者平均生存期小于半年[1];恶性腹腔积液患者中位生存期不足5个月[2]。治疗恶性胸腹水对改善癌症晚期患者的生活质量和生存有重要意义。目前处理恶性胸腹水主要有利尿、限盐、全身化疗等全身治疗,另外配合局部治疗如反复穿刺抽液、长期置管引流、胸腔内局部注药等[3],以及胸膜剥离术或胸膜固定术等外科手术治疗。虽然治疗方法多种,但疗效不尽人意,目前尚缺乏高级别循证医学依据。
恶性胸腹水可能形成的机制:①肿瘤细胞分泌VEGF和金属基质蛋白等,引起新生血管形成、血管通透性增加。②癌细胞阻塞淋巴管,淋巴回流受阻,淋巴液流体静压增加,腔内积液吸收减少,潴留于胸腹腔[4]。国外运用贝伐珠单抗(VEGF单抗)来治疗恶性浆膜腔积液,治疗后VEGF降低,其降低值与疗效成正比[5]。血管内皮抑素可以直接抗VEGF,调节VEGF的表达,抑制新生血管内皮细胞分化、增殖、迁移,减少血管内皮通透性,可以调节蛋白水解酶的活性[6]。重组人血管内皮抑素是我国研发的,它在血管内皮抑素的氨基酸末端增加了9个氨基酸序列,增加稳定性,提高生物活性。静脉使用重组人血管内皮抑制素注射液,联合静脉化疗治疗肺癌、肠癌等,临床疗效可。Rong等[7]系统回顾15项重组人血管内皮抑制素联合铂类药物治疗非小细胞肺癌的临床研究,显示联合治疗可显著地提高患者疾病控制率、进展时间、有效率,改善生活质量。能调节VEGF表达,抑制血管内皮细胞、抑制癌细胞迁移,诱导细胞凋亡,发挥抗血管生成,降低瘤内压,使瘤体内血管正常化,促进细胞毒类药物渗透和分布[8]。因此重组人血管内皮抑素联合顺铂药物胸腹腔内灌注治疗有坚实基础理论。国内有将重组人血管内皮抑制素单药灌注于荷瘤小鼠浆膜腔中,该药能控制胸腹腔内肿瘤生长[9],与化疗药物有协同作用,能有效防止胸腹腔积液形成[10],并有文献提出在相同疗效下,可以减少化疗药物用量,达到高效低毒的目的[11]。
本研究中联合组治疗恶性胸腹水有效率65.2%,单药组有效率30.4%(P<0.05);KPS评分改善情况联合组56.5%,单药组26.1%(P<0.05)。重组人血管内皮抑制素联合顺铂局部灌注在控制胸腹水及KPS改善上优于单药顺铂局部灌注。重组人血管内皮抑素局部灌注使静脉化疗药物治疗无法缓解的恶性胸腹腔积液进一步得到控制,改善了患者生活质量。46例患者治疗中,主要副反应为骨髓抑制、胃肠道反应,少见发热等副反应,但两组的不良反应比较P均>0.05,考虑不良反应与顺铂局部灌注及静脉其他化疗药物有关,重组人血管内皮抑制素的加入并未增加副反应。本研究中未发现文献报道重组人血管内皮抑素的心脏毒性[12]。重组人血管内皮抑素联合顺铂局部灌注治疗恶性胸腹腔积液有较好疗效,可改善生活质量,且不增加化疗药物不良反应,安全性好,具有临床应用价值。
[1]Antony VB,Loddenkemper R.Management of malignant pleural[J].Eur Resp J,2001,18(2):402-419.
[2]Garrison RN,Kaelin LD,Galloway RH,et al.Malignant ascites:Clinical and experimental observations[J].Ann Surg, 1986,20(3):644-651.
[3]严文跃,钱晓萍,刘宝瑞.恶性胸腔积液的治疗进展[J].现代肿瘤医学,2009,17(7):1393-1396.
[4]Tamsma JT,Keizer HJ,Meinders AE.Pathogenesis of malignantascites:Starling’s law of capillary hemodynamics revisited[J].Ann Oncol,2001,12(10):1353-1357.
[5]Pichelmlayer O,Gruenberger B,Zielinski.C,et al.Bevacizum ab.is active in maliganant effusion[J].Ann Oncol, 2006,17(2):1853.
[6]Kisker O,Becker CM,Prox D,et al.Continuous administration of endostatin by intraperitoneally implanted osmotic pump improves the efficacy and potency of therapy in a mouse xenograft tumor model[J].Cancer Res,2001,61(20):7669-7674.
[7]Rong B,Yang S,Li W,et al.Systematic review and metaanalysis of ENdostar(rh-endostatin)combined with chemotherapy lung cancer[J].World J Surg Oncol,2012,10(2):170-181.
[8]Folkman J.Anti-angiogenesis in cancer therapy-endostatin and its mechanisms of action[J].Expt Cell Res,2006, 31(2):594-607.
[9]郑艳花,王琳,姜子瑜,等.腹腔内连续或间断应用重组人血管内皮抑素治疗H22腹水瘤的实验研究[J].临床肿瘤学杂志,2012,17(3):202-206.
[10]魏红梅,秦叔逵.新型重组人血管内皮抑制素(恩度)抗小鼠腹水瘤作用机制的体外研究[N].中国医学论坛报,2010-9-16(B6).
[11]魏红梅,秦叔逵,殷晓进,等.重组人血管内皮抑制素间插联合顺铂对H22小鼠腹水瘤抑制作用的研究[J].临床肿瘤学杂志,2014,19(2):122-127.
[12]刘秀峰,秦叔逵.重组人血管内皮抑制素临床应用和研究的新进展[J].临床肿瘤学杂志,2009,14(10):951-957.
Clinical observation of endostar combined with cisplatin(DDP)in treatment of malignant thoracic and celiac serous effusion
ZHENG JunqiongZHAN YingLIAO Xueyan
Department of Radiation Oncology,Longyan First Hospital Affiliated to Fujiian Medical University,Longyan364000,China
ObjectiveTo observe the efficacy and safety of thoracic and celiac injection of endostar with DDP in treatment of malignant thoracic and celiac serous effusion.MethodsA total of 46 cases of diagnosed cancer patients with malignant thoracic and celiac serous effusion were randomly divided into two groups:the experimental group was injected with endostar 45 mg d1.4.8 q3w combined with DDP 60 mg d1.8 q3w or endostar 60 mg d1.4.8 q3w combined with DDP 60 mg d1.8 q3w;the control group was injected with DDP 60 mg d1.8 q3w combined with venous chemotherapy.The effective rate,quality of life(QOL),drug adverse reaction and clinical efficacy were evaluated after the injection.Results The difference of the effective rate and QOL improvement rate between the two groups was statistical significance.The difference of drug adverse reaction between the two groups had no statistical significance.Conclusion Thoracic and celiac injection of endostar with DDP in treatment of cancer with malignant thoracic and celiac serous effusion has better short-term efficacy without obvious adverse reactions.
Endostar/Recombinant human endostatin;DDP;Malignant thoracic and celiac serous effusion
R730.5
A
1673-9701(2015)18-0019-03
2015-04-10)

