幽门螺杆菌感染后儿童与成人胃黏膜免疫状态差异
方莹杨 洪彬 韩亚楠 任晓侠 李虹 吕茵 王敏 陈一
西安市儿童医院消化内科,陕西西安710043
幽门螺杆菌感染后儿童与成人胃黏膜免疫状态差异
方莹杨 洪彬 韩亚楠 任晓侠 李虹 吕茵 王敏 陈一
西安市儿童医院消化内科,陕西西安710043
目的探讨幽门螺杆菌(Hp)感染后儿童与成人胃黏膜免疫状态差异情况。方法选取2009年1月~2012年2月因上腹部症状就诊于西安市儿童医院(以下简称“我院”)的120例儿童作为儿童组,同时选取同期我院收治的有上腹部症状的成人患者120例作为成人组,根据Hp检测结果,将儿童组分为Hp阳性组90例和Hp阴性组30例,成人组分为Hp阳性组90例和Hp阴性组30例。分别检测各组患者胃黏膜组织中的免疫相关指标。结果成人与儿童Hp阴性组的环氧化酶-2(COX-2)、核因子-κB(NF-κB)、过氧化物酶体增殖物活化受体-γ mRNA(PPAR-γ mRNA)、白介素-8(IL-8)及白介素-2(IL-2)表达比较,差异均无统计学意义(χ2=0.71、0.53,t=0.73、0.85、1.10,均P>0.05)。成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于Hp阴性组,差异均有统计学意义(χ2=128.00、114.40,t=5.63、17.86、18.82,P<0.05或P<0.01),儿童Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童Hp阴性组,差异均有统计学意义(χ2=84.73、79.91,t=4.18、3.27、14.69,P<0.05或P<0.01),成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童Hp阳性组,差异均有统计学意义(χ2=12.50、8.90,t=4.44、5.44、7.09,P<0.05或P<0.01)。结论儿童与成人Hp感染后胃黏膜的局部免疫反应差异,可以为胃黏膜损伤程度和预后判定提供理论依据。
Hp感染;儿童;成人;胃黏膜;免疫状态;差异
幽门螺旋杆菌(Helicobacter pylori,Hp)是临床常见的革兰阴性细菌,其常定植在人体胃黏膜,会引起胃、十二指肠发生炎性反应,造成胃黏膜损伤。Hp感染不仅直接造成胃黏膜损伤,同时还会介导一系列体液免疫反应[1-2]。环氧合酶-2(COX-2)、核因子κB(NF-κB)、过氧化物酶体增殖物活化受体-γ mRNA(PPAR-γ mRNA)、白介素-8(IL-8)、白介素-2(IL-2)是人体常见的炎症因子指标,可在一定程度上反映免疫状态,但是其在Hp感染相关性胃炎患者的临床研究却鲜有报道,尤其是在儿童和成人之间的差异性分析更少[3-4]。本研究通过对西安市儿童医院(以下简称“我院”)Hp感染后儿童和成人胃黏膜免疫状态差异情况进行分析,现将结果总结报道如下:
1 资料与方法
1.1 一般资料
选取2009年1月~2012年2月我院收治的上腹部症状就诊的120例儿童作为儿童组,男66例,女54例;年龄3~14岁,平均(6.5±3.6)岁;胃溃疡60例,十二指肠溃疡60例;病程(3.0±2.5)d。同时选取同期收治的上腹部疼痛、不适等症状的成人患者120例作为成人组,其中男70例,女50例;年龄22~64岁,平均(40.1±12.5)岁;胃溃疡70例,十二指肠溃疡50例;病程(3.2±2.2)d。两组研究对象性别构成、年龄、病史、病程比较差异无统计学意义(P>0.05),具有可比性。根据Hp诊断标准,将儿童组分为Hp阳性90例和Hp阴性30例,成人组分为Hp阳性90例和Hp阴性30例。
1.2 方法
1.2.1 Hp感染阳性判定两组研究对象通过胃黏膜姬姆萨染色、13C呼气试验和快速尿素酶试验,三种方法均诊断为阳性患者,判断为Hp感染阳性病例。
1.2.2 COX-2和NF-κB的测定COX-2和NF-κB采用免疫组化分析过氧化酶标记的链霉卵白素法(SP法)染色定性,试剂盒来自上海华研生物科技有限公司。Western印迹法半定量检测COX-2、NF-κB的表达。COX-2蛋白表达结果判断[5-6]:以细胞浆染呈黄色至棕褐色为阳性细胞,无着色为阴性。分别观察腺体和炎症细胞染色强度及阳性细胞比例。采用定量积分法,每张切片至少观察10个高倍视野,每个视野下计数100个细胞,并根据每张切片阳性细胞比例及着色深浅计分,着色比例:30%以下为1分,30%~60%为2分,60%以上为3分;着色程度:无着色为0分(阴性),浅黄色为1分(弱阳性),棕黄色为2分(阳性),棕褐色为3分(强阳性)。然后根据二者乘积的积分进行统计分析。NF-κB蛋白表达结果判断:以细胞核染呈黄色至棕褐色为阳性细胞,10%~20%的细胞染色为阳性,单纯细胞浆着色,而细胞核无着色,或细胞浆、细胞核均无着色为阴性。
1.2.3 IL-2和IL-8的测定IL-2检测:采用酶联免疫吸附试验(ELISA)方法对IL-2进行检测,应用深圳晶美生物工程有限公司生产的IL-2试剂盒,通过双抗体两步法夹心ELISA检测。标准品和待测样本加入已经包被了人IL-2单克隆抗体透明酶标包被板之中,通过温箱孵育一定时间,将没有完全结合的成分冲洗出去,加入酶标工作液,通过温箱孵育,将没有完全反应的成分洗涤出去。先后顺序加入底物A和底物B,底物TMB在辣根过氧化物酶的催化下转变为蓝色产物,通过酸作用下逐渐变为黄色,黄色的深浅程度和样品中IL-2浓度呈现明显的正相关。通过分光光度计在450 nm波长之下测定OD值,按照说明书要求计算IL-2的含量。IL-2标准品的回归方程式,计算样品浓度。样品的浓度=计算样品浓度和稀释倍数的乘积。IL-8含量的测定:胃窦黏膜活检组织置1 mL磷酸盐缓冲液(PBS)溶液(pH=7.4)中充分匀浆,取匀浆液于-80℃保存备用。组织蛋白浓度(mg/mL)用721紫外分光光度计,酚试剂法进行测定。IL-8浓度(pg/mL)参照ELISA试剂盒说明书进行,ELISA试剂盒购自深圳晶美生物工程有限公司,严格按药盒说明书操作,用重组IL-8的标准曲线确定IL-8的浓度。
1.2.4 采用RT-PCR测定PPAR-γ采用RNA fast 200试剂盒进行RNA的提取,按照上海研成生物科技有限公司的逆转录试剂盒合成cDNA,RT-PCR采用Bio-Rad公司的CFx96型PCR仪进行操作。通过Trizol一步法对总RNA进行提取,通过紫外分光光度计对RNA浓度和纯度进行测定,通过琼脂糖凝胶电泳进行完整性的鉴定。反转录反应总体系为20 μL,总RNA 6.0 μL,1.0 μL Oligo-dT 50 μg/mL、双蒸水5.5 μL、RNasin 40 U/μL加入剂量0.5 μL5× Buffer 4.0 μL,dNTP 10 mol/L剂量2.0 μL和1 μL。建立反应条件:70℃预热5 min,快速加入反转录酶,然后42℃60 min,95℃5 min,4℃5 min,反应后产物放在-20℃保存备检。通过定量PCR,测定不同标本中PPAR-γ表达量情况。
1.3 观察指标
分别比较成人与儿童Hp阴性组、成人与儿童Hp阳性组、成人Hp阳性组与Hp阴性组、儿童Hp阳性组与Hp阴性组的COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况。
1.4 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 成人与儿童Hp阴性组的COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况
成人Hp阴性组的COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达水平与与儿童Hp阴性组比较,差异均无统计学意义(χ2=0.71、0.53,t=0.73、0.85、1.10,均P>0.05)。见表1。
表1 成人Hp阴性组与儿童Hp阴性组各免疫相关指标表达情况

表1 成人Hp阴性组与儿童Hp阴性组各免疫相关指标表达情况
注:Hp:幽门螺杆菌;COX-2:环氧化酶-2;NF-κB:核因子-κB;PPAR-γ mRNA:过氧化物酶体增殖物活化受体-γ mRNA;IL-8:白介素-8;IL-2:白介素-2
组别例数COX-2[n(%)]NF-κB[n(%)]PPAR-γ mRNA IL-8(μg/L)IL-2(μg/L)成人Hp阴性组儿童Hp阴性组χ2/t值P值30 30 3(10.0)2(6.7)0.71>0.05 4(13.3)3(10.0)0.53>0.05 3.5±1.2 3.3±0.9 0.73>0.05 0.08±0.05 0.09±0.04 0.85>0.05 0.07±0.04 0.08±0.03 1.10>0.05
2.2 成人Hp阳性组与Hp阴性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况
成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于Hp阴性组,差异均有统计学意义(χ2=128.00、114.40,t=5.63、17.86、18.82,P<0.05或P<0.01)。见表2。
表2 成人Hp阳性组与Hp阴性组各免疫相关指标表达情况
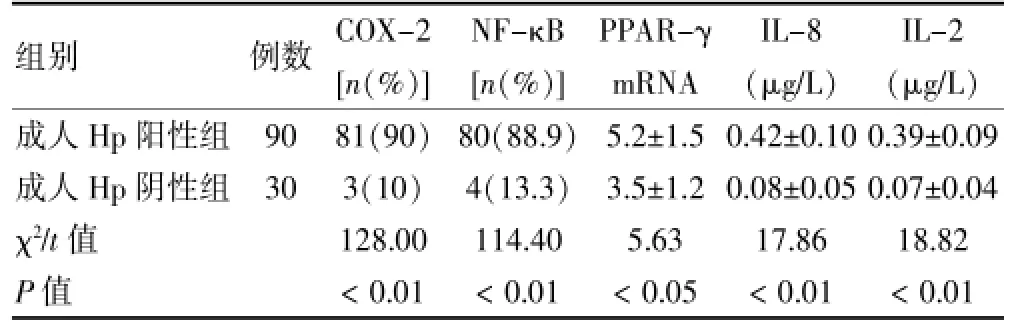
表2 成人Hp阳性组与Hp阴性组各免疫相关指标表达情况
注:Hp:幽门螺杆菌;COX-2:环氧化酶-2;NF-κB:核因子-κB;PPAR-γ mRNA:过氧化物酶体增殖物活化受体-γ mRNA;IL-8:白介素-8;IL-2:白介素-2
组别例数COX-2[n(%)]NF-κB[n(%)]PPAR-γ mRNA IL-8(μg/L)IL-2(μg/L)成人Hp阳性组成人Hp阴性组χ2/t值P值90 30 81(90)3(10)128.00<0.01 80(88.9)4(13.3)114.40<0.01 5.2±1.5 3.5±1.2 5.63<0.05 0.42±0.10 0.08±0.05 17.86<0.01 0.39±0.09 0.07±0.04 18.82<0.01
2.3 儿童Hp阳性组与Hp阴性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况
儿童Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童Hp阴性组,差异均有统计学意义(χ2=84.73、79.91,t=4.18、3.27、14.69,P<0.05或P<0.01)。见表3。
2.4 儿童Hp阳性组与成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况
成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童Hp阳性组,差异均有统计学意义(χ2=12.50、8.90,t=4.44、5.44、7.09,P<0.05或P<0.01)。见表4。
表3 儿童Hp阳性组与Hp阴性组各免疫相关指标表达情况
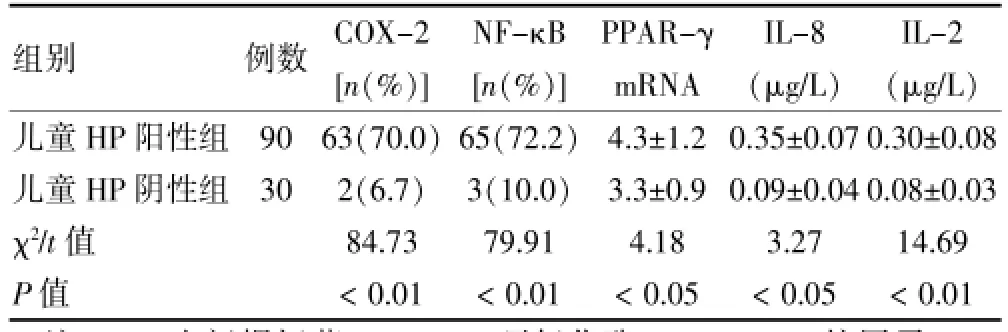
表3 儿童Hp阳性组与Hp阴性组各免疫相关指标表达情况
注:Hp:幽门螺杆菌;COX-2:环氧化酶-2;NF-κB:核因子-κB;PPAR-γ mRNA:过氧化物酶体增殖物活化受体-γ mRNA;IL-8:白介素-8;IL-2:白介素-2
组别例数COX-2[n(%)]NF-κB[n(%)]PPAR-γ mRNA IL-8(μg/L)IL-2(μg/L)儿童HP阳性组儿童HP阴性组χ2/t值P值90 30 63(70.0)2(6.7)84.73<0.01 65(72.2)3(10.0)79.91<0.01 4.3±1.2 3.3±0.9 4.18<0.05 0.35±0.07 0.09±0.04 3.27<0.05 0.30±0.08 0.08±0.03 14.69<0.01
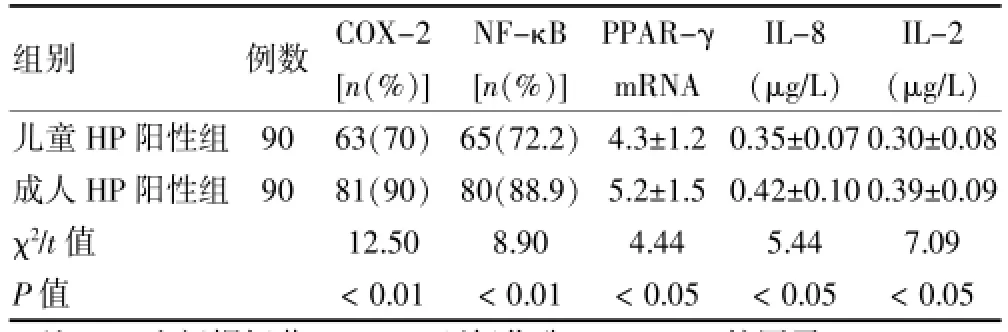
表4 儿童Hp阳性组与成人Hp阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达情况(x±s)
3 讨论
Hp感染是诱发小儿慢性胃炎、十二指肠炎和消化性溃疡的重要原因,很大一部分患者一生中感染Hp的年龄段集中在儿童期[7-8]。在发展中国家中,10岁以下儿童Hp感染发生率为45%~90%,目前儿童Hp感染发生率明显增高,每年的增长速度达到近10%。我国5岁以下儿童Hp感染发生率集中在15%~45%[9-10]。儿童感染Hp的临床表现是腹部疼痛、呕吐,甚至出现呕血等,其中有近50%患者为急性发作,胃黏膜皱襞有不同程度的增生,胃镜下以胃窦部微小结节最为典型[11-12]。Hp是微需氧型的螺旋形革兰阴性细菌,其一侧有多根鞭毛,可以定植在胃黏膜的表面,一般多聚集在细胞的交界部位,并且可以深入至细胞间隙之中[13-14]。Hp可以分泌较高活性的尿素酶,从而促进尿素分解,产生氨,对胃酸形成中和,从而形成利于Hp定植和繁殖的微环境。近年来Hp感染逐步增多,并且发生年龄呈现明显年轻的状态。Hp作为有毒性和致病能力的病原体,常会附着在胃、十二指肠黏膜上皮细胞,从而致病:①Hp会分泌毒素、尿素酶、醋酶和蛋白质水解酶,从而造成炎性反应,损伤胃十二指肠的黏膜细胞,进而形成溃疡;②Hp抗原会激发免疫反应,通过免疫应答的形式造成免疫性损伤;③Hp还会抑制胃酸胃窦G细胞分泌胃泌素的负反馈效果,从而引起长期胃泌素增高和壁细胞增生,进而引起胃泌素增多。HP感染之后出现非特异性炎性反应,从而出现特异性细胞免疫和体液免疫。
过氧化物酶体增殖物激活受体(PPARs)属于核转录因子的一类,其可以被过氧化物酶体增殖物激活。其主要包含PPARα、PPARβ、PPARδ、PPARγ等,其中PPARγ不仅在脂肪组织中呈现中高度表达,同时在消化道、输尿管、膀胱、肾、脾等重要脏器也有表达。PPARγ在多种肿瘤组织中均有不同程度的表达,其可以诱导细胞凋亡和调控细胞分化,进而调节细胞的转录[15-16]。COX-2可以促使花生四烯酸生成前列腺素和血栓素,诱发炎性反应,另外其还可以抑制细胞凋亡和促进细胞增殖。HP感染患者胃黏膜内的COX-2表达从浅表性胃炎发展到肠化生和不典型增生,进而呈现逐渐增高的趋势。COX-2在HP感染胃黏膜有中度、过度表达,加剧炎性反应[17-18]。从浅表性胃炎变为萎缩性胃炎,直到肠化生、非典型增生,最终演变成胃癌。HP感染可以通过诱导COX-2过度表达进而参与到胃癌发生、发展的早期过程之中[19-20]。NF-κB是机体重要的炎性调节因子,其与炎性反应、免疫反应、细胞周期控制、分化和应对感染的反应密切相关。当HP感染时会激活NF-κB,NF-κB又可以激活抗凋亡基因,进而阻断半胱天冬酶激活,从而介导细胞存活、凋亡调控紊乱,促进细胞发生恶变。NF-κB和HP感染从而引起胃上皮细胞增殖、分化和凋亡比较密切,进而诱导抗凋亡基因表达上调,从而导致细胞凋亡,促进细胞增殖过度和细胞分化异常,进而最终形成胃癌。HP感染之后可以通过IKKβ-NF-κB信号传导通路,从而促进XIAP上调表达,从而引起抑制细胞凋亡、细胞过度增殖和细胞分化异常,诱发胃癌,因而IKKβ可能成为HP感染引起的胃炎、胃癌等病变的新型靶点。IL-2是T细胞生长因子,其可以活化CD4+T和CD8+T细胞,从而发挥其广泛生物活性。IL-2是Th1类细胞因子,其可以促进CD4+T细胞、CLTs和B细胞发生增殖。当HP感染发生时,IL-2水平明显增高,IL-2水平变化也可以反映胃炎的治疗效果情况。IL-8是多源性细胞因子,可以促进炎性反应,选择性的诱导中性粒细胞、T淋巴细胞和嗜碱性粒细胞发生趋化,产生超氧化离子和过氧化氢,进而出现炎性作用。HP感染可能导致胃黏膜IL-8含量增高,同时IL-8增高幅度和胃炎活动的粒细胞浸润程度密切相关,给予针对HP治疗之后IL-8会有不同程度的降低,提示IL-8和HP相关性胃炎的发生和发展有着密切的关系[21-22]。
本研究通过选取我院2009年1月~2012年2月收治的上腹部症状就诊的120例儿童作为儿童组,同时选取同期收治的上腹部症状成人患者120例作为成人组,根据HP诊断标准,将儿童组分为HP阳性90例和HP阴性30例,成人组分为HP阳性90例和HP阴性30例。结果表明,成人与儿童HP阴性组的COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达无明显差异,成人HP阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于HP阴性组,儿童HP阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童HP阴性组,成人HP阳性组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达均高于儿童HP阳性组,提示儿童胃炎症状没有成人明显,相比成人发生胃黏膜炎性改变(胃黏膜固有腺体萎缩和肠上皮化生)的频率低,儿童组COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2表达低于成人组,提示炎症程度轻,出现胃黏膜萎缩及肠上皮化生的概率低。而成人可能由于胃炎等胃部症状反复复发,并进一步有癌变风险,从而造成COX-2、NF-κB、PPAR-γ mRNA、IL-8及IL-2的表达增高。
综上所述,通过对儿童与成人HP感染后胃黏膜的局部免疫反应差异的研究,了解儿童胃黏膜局部免疫的特点,促进儿童HP感染的临床和基础研究,指导开展小儿Hp感染的普查与防治,对减少成年消化疾病发病率、提高民族健康素质具有深远的意义。
[1]杨才明,陈玉忠.13C-UBT和14C-UBT等七种诊断幽门螺杆菌感染检测技术比较与评价[J].标记免疫分析与临床,2012,19(2):126-128.
[2]何敏,邹兵,陈文科,等.半量13C-UBT对幽门螺杆菌感染的诊断价值[J].海南医学,2012,23(13):30-32.
[3]邹小农,孙喜斌,陈万青,等.2003~2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
[4]San-Millán JL,Escobar-Morreale HF.The role of genetic variation in peroxisome proliferator-activated receptors in the polycystic ovary syndrome(PCOS):an original casecontrol study followed by systematic review and metaanalysis of existing evidence[J].Clin Endocrinol(Oxf),2010,72(3):383-392.
[5]刘海全,秦佳佳.淫羊藿含药血清对骨质疏松大鼠骨髓基质干细胞成脂分化PPARγ mRNA表达的影响[J].北京中医药大学学报,2012,35(9):611-614.
[6]毕铁强,廖新华,龙厚隆,等.幽门螺杆菌与胃癌关系的临床研究进展[J].现代肿瘤医学,2010,18(11):2279-2282.
[7]Jang SH,Lim JW,Kim H.Beta-carotene inhibits Helicobacter pylori-induced expression of inducible nitric oxide synthase and cyclooxygenase-2 in human gastric epithelialAGS cells[J].J Physiol Pharmacol,2009,60(7):131-137
[8]刘江月,徐洪平,张代娟,等.COX-2在胃癌组织中的表达及与Hp感染的关系[J].中国老年学杂志,2010,30(13):1800-1801.
[9]Correa P.New strategies for the prevetion of gastric cancer Helicobacter pylori and genetic suscep tibility[J].J Surg Oncol,2005,90(3):134-138.
[10]李强,党诚学.PPARγ mRNA在胃癌组织中的表达及其与胃癌预后的关系[J].实用癌症杂志,2012,27(1):18-20.
[11]Lambropoulou M,Papadopoulos N,Tripsianis G,et al.Coexpression of survivin,c-erbB2,and cyclooxygenase-2(COX-2):prognostic value and survival of endometrial cancer patients[J].J Cancer Res Clin Oncol,2010,136(3):427-35.
[12]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2 0 0 8[J].Int J Cancer,2010,127(12):2893.
[13]Ogino S,Shima K,Baba Y,et al.Colorectal cancer expression of peroxisome proliferator-activated receptor gamma(PPARG,PPARgamma)isassociatedwithgoodprognosis[J]. Gastroenterology,2009,136(4):1242.
[14]张春容,杨天文.环氧合酶-2的表达与胃癌发生的关系及Hp感染对COX-2其表达的影响[J].中国老年学杂志,2014,34(1):68-69.
[15]王亚芳,聂勇战,吴开春,等.LncRNA在缺氧诱导的胃癌细胞中表达谱的变化[J].现代肿瘤医学,2013,21(2):225-228.
[16]卢瑗瑗,王新,吴开春.胃食管返流病的诊断流程推荐[J].临床消化病杂志,2008,20(1):5-8.
[17]Takeshima E,TOmimori K,Kawakami H,et al.NF-κB activation by Helicobacter Pylori requires Akt-mediated PhosPherylation of P65[J].BMC Microbiol,2009,9(l):36.
[18]Komar CM.Peroxisome proliferator-activated receptors(PPARs)and ovarian function-implications for regulating steroidogenesis,differentiation,and tissue remodeling[J]. Reprod Biol Endocrinol,2005,(3):41.
[19]Boyanova L,Mitov I.GeograPhic map and evolution of Primary Helicobacter Pylori resistance to antibacterial agents[J].EXPert RevAnti Inlfct Ther,2010,8(l):59-70.
[20]刘小玉,冯义朝.胃癌及癌前病变中COX-2和NF-κBp65蛋白表达及其相关性研究[J].西部医学,2013,25(2):201-204.
[21]郭继进,冯腾,张海霞,等.核因子-κB、抑制蛋白IκBα在慢性浅表性胃炎、慢性萎缩性胃炎、胃癌中的表达及其临床意义[J].中国基层医药,2011,18(3):369-370.
[22]潘伟琦,胡荣,芦燕玲,等.幽门螺杆菌现症及既往感染与心脑血管疾病的关系[J].中国医药,2014,9(6):805-807.
Difference in gastric mucosal immune state between children and adults after Helicobacter pylori infection
FANG YingYANG HongbinHAN Ya'nanREN XiaoxiaLI HongLU YinWANG MinCHEN Yi
Department of Gastroenterology,Xi'an Children's Hospital,Shaanxi Province,Xi'an710043,China
ObjectiveTo approach gastric mucosa immune state difference between children and adult after Hp infection.Methods120 cases children with abdominal symptoms from January 2009 to February 2012 in Xi'an Children's Hospital(“our hospital”for short)were selected as children group,then 120 cases of adult with abdominal symptoms in our hospital from the same period were selected as adult group.According to Hp diagnostic criteria,the children group was divided into Hp positive group(90 cases)and Hp negative group(30 cases),and the adult group was divided into Hp positive group(90 cases)and Hp negative group(30 cases).Immune related indicators of gastric mucosal tissues in different groups were detected.ResultsThere was no significant difference in expression of COX-2,NF-κB,PPAR-γ mRNA,IL-8 and IL-2 between adult and children Hp negative group(χ2=0.71,0.53;t=0.73,0.85,1.10,allP>0.05). The expression of COX-2,NF-κB,PPAR-γ mRNA,IL-8 and IL-2 of adult Hp positive group were higher than those of the adult Hp negative group,the differences were statistically significant(χ2=128.00,114.40;t=5.63,17.86,18.82;P<0.05 orP<0.01);the expression of COX-2,NF-κB,PPAR-γ mRNA,IL-8 and IL-2 in children Hp positive group were higher than those of the children Hp negative group,the differences were statistically significant(χ2=84.73,79.91;t=4.18,3.27,14.69;P<0.05 orP<0.01);the expression of COX-2,NF-κB,PPAR-γ mRNA,IL-8 and IL-2 in adult Hp positive group were higher than those of the children Hp positive group,the differences were statistically significant (χ2=84.73,79.91;t=4.18,3.27,14.69;P<0.05 orP<0.01).ConclusionThe research of gastric mucosa immune state difference between children and adult after Hp infection,which can provide reliable theory basis for gastric mucosal damage degree and prognosis judgement.
Hp infection;Children;Adult;Gastric mucosa;Immune state;Difference
R573
A
1673-7210(2015)02(a)-0105-05
2014-11-14本文编辑:任念)
陕西省西安市科技发展引导计划-医疗卫生研究项目(编号SF09023-1)。

