籽瓜多糖对H2O2致PC12 细胞氧化损伤的保护作用
刘 琴,宋 珅,郭 杰,罗 顺,张 继,2*
1 西北师范大学生命科学学院;2 甘肃特色植物有效成分制品工程技术研究中心;3甘肃万州健顺生物科技有限公司,兰州 730070
由活性氧介导的氧化应激损伤在神经退行性疾病中起了至关重要的作用[1],H2O2是体内代谢产生的一种ROS,能够与多种生物靶标分子(如DNA、蛋白、脂质)反应,可以透过细胞膜[2-4]。大鼠肾上腺髓质嗜铬瘤细胞系PC12 广泛用作研究氧化应激诱导的神经细胞损伤模型[5]。近年来,从天然产物中寻找具有清除自由基活性的物质用于保护细胞免受氧化损伤备受关注[6]。
籽瓜,葫芦科,性温,有暖胃祛寒、滋嫩肌肤、清肾排毒等功效,富含果酸、核黄酸、尼可酸等18 种氨基酸、维生素及多种微量元素,具有利尿、润肺、健脾的功效因子,对糖尿病、肥胖症也有辅助医疗作用,籽瓜人药可作“白虎汤”药引[7-9]。植物多糖是一类由单糖组成的天然高分子化合物,如人参、枸杞、芦荟、牛膝、刺五加等均具有增强免疫力、抗肿瘤、降血糖、抗衰老、抗病毒作用等功能[10,11]。籽瓜多糖作为植物多糖的一种,已有报道其具有体外清除自由基的功效[12],但确切机制不明。本研究在此背景下,探讨SWP 对H2O2诱导的PC12 细胞损伤的保护作用和机制。
1 材料与方法
1.1 材料
籽瓜,产地为甘肃靖远,籽瓜切碎去除瓜子和瓜皮后粉碎得到籽瓜汁待用。
PC12 细胞购自昆明动物所。DMEM 粉末(Gibco);青霉素(华北制药股份有限公司);链霉素(大连美罗大药厂);胰蛋白酶(上海华美生物工程公司);CCK-8 试剂盒(武汉博士德有限公司);MTT(Sigma-Aldrich 公司);乳酸脱氢酶试剂盒(南京建成生物工程研究所),线粒体膜电位检测试剂盒、ROS 活性检测试剂盒和caspase-3、caspase-9 活性检测试剂盒(碧云天生物技术研究所);8-OHdG 检测试剂盒(上海欣美生物试剂公司);其他试剂均为国产分析纯。
1.2 仪器
NJC03-2 型微波提取设备(南京汇研微波系统工程有限公司);TDL5M 型台式大容量冷冻离心机(湘仪离心机厂);LGJ-185 型真空冷冻干燥机(北京松源华兴科技发展有限公司);CO2细胞培养箱(Thermo Scientific);Vi-cell 细胞计数分析仪(Beckman);生物安全柜(力康生物医疗科技控股有限公司);倒置显微镜(OLYMPUS);SpectraMax M5多功能酶标仪(美国分子仪器有限公司);UV2450紫外分光光度计(上海美析仪器有限公司);荧光分光光度计(上海精密仪器有限公司),高速低温离心机(Beckman);电子天平(天津市天马仪器厂)。
1.3 实验方法
1.3.1 籽瓜多糖的制备
取一定量的准备好的籽瓜汁,按照宋珅等[13]的方法分离和纯化籽瓜多糖,苯酚硫酸法测得糖含量为93.1%,凝胶阻滞色谱法测得其分子量为121.3×105,GC-MS 法分析表明,SWP 由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖六种单糖组成,摩尔比为4.48∶13.14∶4.16∶7.82∶10.1∶60.3。
1.3.2 PC12 细胞传代培养
用含10% 胎牛血清的DMEM 培养基培养PCI2细胞,按每毫升104个细胞接种到培养瓶中,在37℃5% CO2饱和湿度的条件下培养,每2 d 换一次液。细胞为上皮样贴壁生长,传代时加0.25%的胰蛋白酶2~3 mL,在显微镜下观察待细胞消化至刚从培养瓶底部脱落,加入含血清的DMEM 培养基终止消化,用吸管轻轻吹打成单细胞悬液,按1∶3 每2~3 d 传代一次,取对数生长期细胞用于实验。
1.3.3 H2O2诱导PC12 细胞氧化损伤模型的建立
按照李朝晖等[14]的方法确定H2O2诱导PC12细胞凋亡的浓度和时间。细胞消化、计数、配制成浓度为5×104个/mL 的细胞悬液,接种于96 孔板中,每组设6 个复孔,置于37 ℃,5% CO2培养箱中培养24 h;弃去培养基,用培养基稀释的不同浓度(100、300、500、700、1000 μmol/L)的H2O2处理细胞,设对照组,加入相同体积的不含H2O2的培养基,置于37 ℃,5% CO2培养箱中继续培养1、2、4、8、12、24 h,吸出培养液,加入无血清新鲜培养液100 μL 和CCK-8 试剂10 μL,轻微震荡5 min,37 ℃孵育2 h,于450 nm 处用多功能酶标仪测定各孔吸光度值,计算各组别细胞存活率。以对照组吸收度作为100%存活对照,不同组别吸光度值表示为对照组的百分比。
实验组细胞存活率(%)=(A药物-A空白)/(A对照-A空白)×100%
实验组抑制率(%)=1-实验组细胞存活率(%)
1.3.4 籽瓜多糖给药剂量筛选
细胞消化,制成5×104个/mL 的细胞悬液,接种于96 孔,设立对照组(不加入SWP,但加入相同体积的培养基),籽瓜多糖组(3.125、6.25、12.5、25、50 mg/mL),每组设6 个复孔。将96 孔细胞培养板置于37 ℃,5% CO2培养箱中继续培养24 h,吸出培养液,每孔加入无血清新鲜培养液100 μL 及CCK-8 试剂10 μL,轻微震荡5 min,37 ℃孵育2 h,于450 nm 处用多功能酶标仪测定各孔吸光度值。计算不同浓度SWP 对细胞的抑制率。确定籽瓜多糖给药剂量范围,按照实验分组进行如下实验。以籽瓜多糖对细胞无毒性剂量范围作为对细胞氧化损伤保护剂量范围。
1.3.5 SWP 对H2O2损伤PC12 细胞活力的影响
按照上述方法处理细胞,待细胞贴壁后,加入不同浓度等体积的籽瓜多糖(10、25、50 mg/mL),每组设六个复孔,分别孵育12、24、48 h 后,加入终浓度为500 μmol/L 的H2O2,继续孵育24h,MTT 法检测细胞活率。
1.3.6 LDH 释放量的检测
[15]的方法,分组培养细胞,背景空白对照孔为无细胞的培养液,孵育结束后,取各孔上清120 μL 于新的96 孔板中,再加入60 μL LDH 检测工作液,避光室温孵育30 min 后,在490 nm 处测量吸光度值。
计算公式:LDH(%)=(A样品-A空白)/(A对照-A空白)×100%
式中A样品、A空白、A对照分别为样品孔、空白对照孔和正常对照孔吸光度值。
1.3.7 胞内ROS 检测
采用ROS(reactive oxygen species)敏感荧光探针DCFH-DA 检测胞内ROS。细胞处理同1.3.5后,各孔加入DCFH-DA 至终浓度10μmol/L,于37℃继续孵育4h,收集细胞,PBS 洗涤,制备单细胞悬液,加入1 mL 10 μmol/L 的DCFH-DA 无血清培养液,37 ℃孵育20 min。每3~5 min 颠倒混匀,使探针和细胞充分接触。为除去未进入细胞内的DCFH-DA,需无血清培养基洗涤细胞三次,然后用荧光分光光度计测定(激发波长为488 nm,发射波长为521 nm)细胞内荧光强度。以对照组荧光强度为100%,其余各组与对照组荧光强度相比,计算胞内ROS 变化。
1.3.8 8-羟基脱氧鸟苷酶联免疫分析
应用双抗体夹心法测定8-羟基脱氧鸟苷(8-OHdG)水平。参照郭春燕[16]方法,通过标准品的稀释与加样—温育—配液—洗涤—加酶—温育—洗涤—显色—终止—测定,严格按照8-OHdG 含量的检测试剂盒说明进行操作。
1.3.9 线粒体膜电位的检测
取对数生长期的PC12 细胞,消化后接种于6孔板中,培养24 h 后按照实验分组加入不同浓度的SWP 孵育12、24、48 h,然后加入终浓度为500 μmol/L 的H2O2,继续孵育24 h,收集细胞,离心,弃上清,加细胞培养液重悬细胞,加0.5 mL JC-1 染色工作液,涡旋混匀,37 ℃孵育20 min,然后4 ℃800×g 离心3 min,弃上清,用JC-1 染色缓冲液洗涤二次,200 μL 染色缓冲液重悬后,取100 μL 细胞悬液于96 孔板,多功能酶标仪检测荧光强度,计算比值。
1.3.10 Caspase-3、caspase-9 酶活性的检测
按照1.3.4 处理细胞,待细胞贴壁后,加入不同浓度等体积的籽瓜多糖(10、25、50 mg/mL),每组设六个复孔,孵育24 后,加入终浓度为500 μmol/L 的H2O2,继续孵育24 h,收集细胞,加细胞裂解,重悬,冰浴裂解15 min。4 ℃16000×g 离心15 min。取上清,按照总体积100 μL 反应体系加入待测样品10 μL,Ac-DEVD-pNA 和Ac-LEHD-pNA 底物10 μL 的比例测定分别测定caspase-3、caspase-9 的酶活性。
1.3.11 统计学处理
所有数据结果均为计量单位,应用SPSS 统计软件,采用单因素方差分析,结果均以(±s)表示。P<0.05 认为有统计学差异。
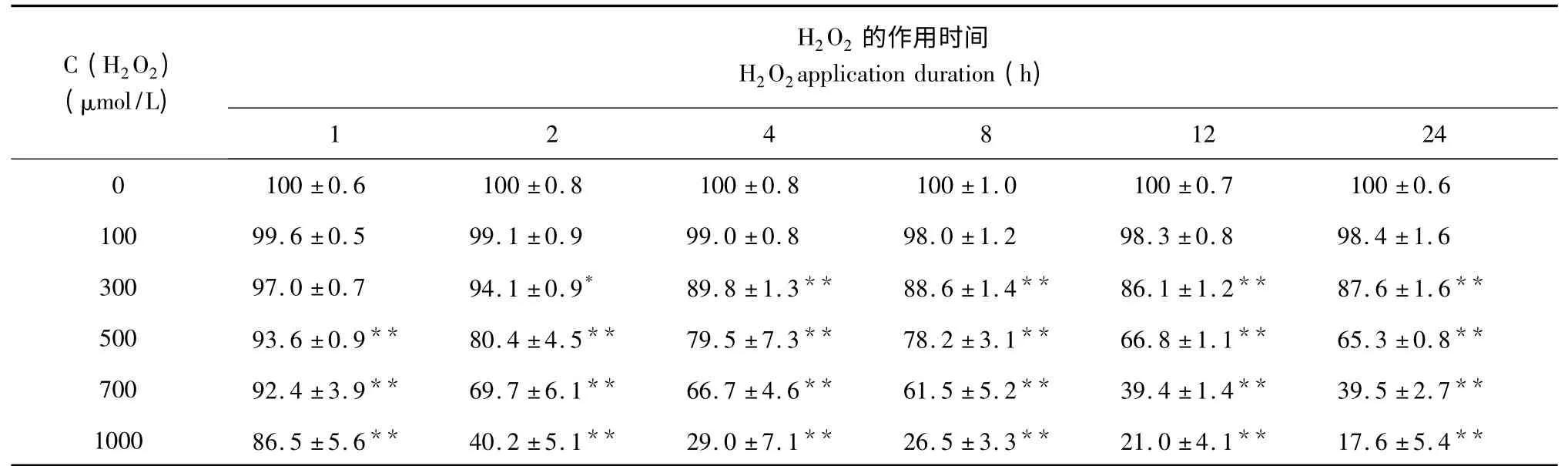
表1 不同浓度H2O2对PC12 细胞活率的影响(n=6)Table 1 Effect of different concentrations of H2O2on cell viability of PC12 cells(n=6)
2 结果与分析
2.1 H2O2诱导PC12 细胞损伤浓度和时间的确定
CCK-8 结果如表1 所示,H2O2终浓度为100 μmol/L 时对细胞没有明显的损伤作用(P>0.05),H2O2终浓度为500 μmol/L 以上时,作用2h 细胞活力明显下降(P<0.01),细胞毒性相对于正常细胞显著增强,抑制率达20%,到12 h 抑制率为33%,作用24 h,对PC12 细胞抑制率约为35%,此时细胞受损但不至于大量死亡,所以H2O2诱导细胞损伤的条件确定为500 μmol/L 损伤24 h。
2.2 SWP 单独作用于PC12 对细胞增殖毒性的影响
采用CCK-8 法筛选SWP 对H2O2损伤保护剂量范围,如图1 所示,在所设置的五个浓度范围内,SWP 单独作用于PC12 细胞,对细胞基本无毒性,我们选定12.5、25、50 mg/mL 三个剂量来研究SWP 对H2O2损伤PC12 细胞的保护作用。
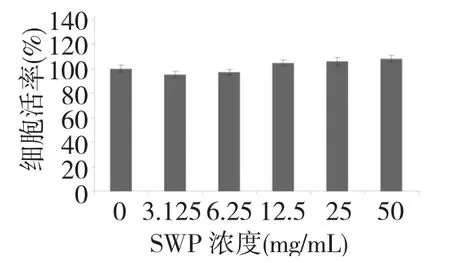
图1 不同浓度SWP 对PC12 细胞活率的影响(n=6)Fig.1 Effect of different concentrations of H2O2on cell viability of PC12 cells(n=6)

图2 不同浓度的籽瓜多糖对H2O2损伤PC12 细胞存活率的影响Fig.2 Effect of different concentrations of SWP on H2O2-induced viability of PC12 cells
2.3 SWP 对H2O2损伤PC12 细胞活力的影响
如图2 所示,与对照组相比,H2O2组的细胞活率明显下降(P<0.01),与H2O2模型组相比,不同浓度(12.5~50 mg/mL)籽瓜多糖预处理后,能够明显改善H2O2引起的PC12 细胞存活率的降低(P<0.01),并且随着作用时间和剂量浓度的增加,细胞存活率增加。说明籽瓜多糖,对H2O2损伤PC12 细胞的活力有一定的保护作用。

图3 不同浓度的籽瓜多糖对H2O2损伤的PC12 细胞LDH 释放量的影响Fig.3 Effect of different concentrations of SWP on LDH leakage of PC12 cells injured by H2O2
2.4 LDH 释放量的检测

图4 不同浓度的籽瓜多糖对H2O2损伤的PC12 细胞内ROS 水平的影响Fig.4 Effect of different concentrations of SWP on H2O2-induced intracellular accumulation of ROS in PC12 cells
如图3 所示,与对照组相比,H2O2明显引起了PC12 细胞膜的损坏,使得模型组细胞内的LDH 大量外漏,而与模型组相比,加入籽瓜多糖预处理后,LDH 漏出量明显降低(P<0.01),并且随着SWP 浓度的升高和孵育时间的增加,LDH 释放量减少,有一定的剂量和时间依赖性,表明SWP 能够保护H2O2引起的细胞损伤。
2.5 SWP 对H2O2导致的细胞内ROS 水平的影响
如图4 所示,采用DCFH-DA 荧光探针检测胞内ROS 变化情况。与对照组相比,500μmol/L H2O2单独作用PC12 细胞24 h 后DCF 荧光信号显著增高(P<0.01),即ROS 水平增加;而SWP 组(12.5、25、50 mg/mL)剂量依赖地抑制H2O2导致的胞内ROS 水平的升高(P<0.05),并且随着籽瓜多糖孵育时间的增加,这种抑制作用越明显。表明SWP 能够显著抑制H2O2诱导PC12 细胞产生活性氧。
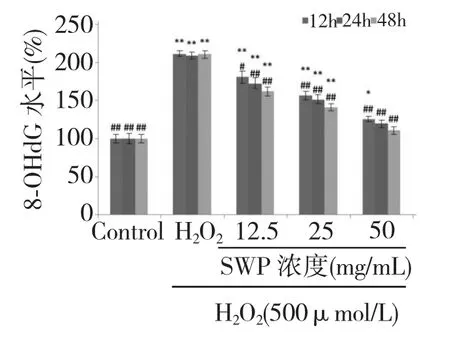
图5 不同浓度的籽瓜多糖对H2O2损伤的PC12 细胞内ROS 水平的影响Fig.5 Effect of different concentrations of SWP on H2O2-induced 8-OHdG level in PC12 cells
2.6 SWP 对H2O2导致的细胞内8-OHdG 水平的影响
如图5 所示,与对照组相比,500 μmol/L H2O2单独作用PC12 细胞24 h 后,8-OHdG 水平显著提高(P<0.01);而籽瓜多糖提前孵育12、24、48 h 后,8-OHdG 水平显著降低(P<0.01),有一定的剂量依赖性和时间依赖性。表明SWP 能在一定程度上保护H2O2引起的细胞DNA 的损伤。
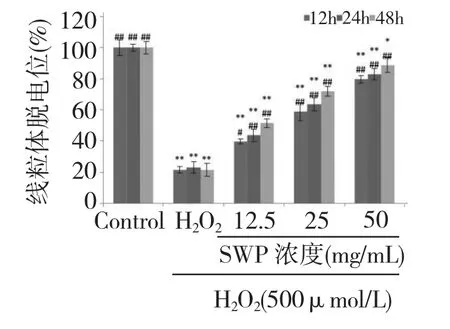
图6 不同浓度的籽瓜多糖对H2O2损伤的PC12 细胞线粒体膜电位的影响Fig.6 Effect of different concentrations of SWP on mitochondrial membrane potential induced by H2O2in PC12 cells
2.7 SWP 对H2O2诱导的细胞线粒体膜电位的影响
如图6 所示,与正常组相比,模型组中H2O2诱导的PC12 细胞线粒体膜电位明显下降(P<0.01);与模型组相比,12.5、25、50 mg/mL SWP 提前孵育后,能够抑制H2O2诱导的PC12 细胞线粒体膜电位下降(P<0.01),有一定的时间依赖性。

表2 籽瓜多糖对H2O2诱导的PC12 细胞的caspase-3、caspase-9 酶活性的影响(n=6)Table 2 Effect of SWP on activities of caspase-3,caspase-9 of H2O2-induced PC12 cells(n=6)
2.8 SWP 对H2O2诱导的细胞内caspase-3、caspase-9 酶活性的影响
如表2 所示,与对照组比较,模型组中PC12 细胞内caspase-3、caspase-9 酶的活性明显增加(P<0.01);而预先加入不同剂量SWP(12.5、25、50 mg/mL)处理后,caspase-3、caspase-9 酶的活性明显下降(P<0.05),在12.5~50 mg/mL 浓度范围内有剂量依赖关系。表明SWP 可能通过影响Caspase 通路对H2O2诱导的PC12 起到了保护作用
3 讨论
本研究为了探讨SWP 对H2O2诱导的PC12 细胞损伤的保护作用和机制,首先采用CCK-8 对H2O2诱导的PC12 细胞损伤浓度和时间进行检测。实验结果表明500 μmol/L H2O2作用细胞24 h 后,细胞活力抑制率为35%,该浓度下细胞有一定比例凋亡,但又不至于大量死亡,所以本研究选用500 μmol/L H2O2造模。为了筛选合适的SWP 量,我们仍然采用CCK-8 方法,检测SWP 单独用药对细胞无毒的剂量范围。根据此实验结果,确定了3 个剂量:12.5、25、50 mg/mL 对SWP 进行保护作用和机制的研究。
我们进行了DNA 损伤标志物8-OHdG 的检测,结果表明,与正常组相比,H2O2诱导细胞损伤后8-OHdG 显著增加僻;SWP 组与H2O2模型组相比,籽瓜多糖预孵育组8-OHdG 显著降低。8-OHdG 是DNA 氧化损伤的重要标志物,ROS 是造成DNA 氧化损伤主要原因之一,进一步地我们检测了ROS,检测结果进一步证明了该剂量范围内,SWP 的保护作用与清除活性氧,减轻DNA 损伤有关。细胞损伤时LDH 会释放入培养液中,故其上清液中LDH 的浓度可反映出细胞的损伤程度,与正常对照组相比,H2O2能造成培养液中LDH 显著提高;12.5~50 mg/mL SWP 能显著降低H2O2诱导的LDH 的提高。
ROS 会通过多种途径造成线粒体的损伤,我们推测一定剂量范围内的SWP 对过氧化氢损伤的保护作用可能与线粒体途径有关。于是我们测定了线粒体膜电位,结果表明12.5~50 mg/mL SWP 可以显著的抑制H2O2造成的线粒体膜电位的下降。
Caspase 是一个在细胞凋亡过程中起重要作用的蛋白酶家族。Caspase-9 是细胞凋亡信号转导过程中比较上游的一个Caspase,激活的Caspase-9 可以激活细胞凋亡的最关键酶Caspase-3,Caspase-3介导的蛋白剪切是细胞凋亡分子机制的重要组成部分。另外,Caspase-3 在细胞核凋亡过程中也起到了关键作用,包括染色质固缩,DNA 片段化等。为了探明Caspase 通路是否参与了SWP 对H2O2诱导PC12 的保护作用,我们检测了 Caspase-3 和Caspase-9 活性。结果表明12.5、25、50 mg/mL SWP可以显著抑制H2O2诱导的PC12 细胞Caspase-3 和Caspase-9 活性。
综合以上结果分析12.5、25、50 mg/mL SWP 对H2O2诱导的PC12 细胞损伤具有保护作用,其机制可能与清除ROS,减轻DNA 氧化损伤,抑制线粒体膜电位下降,抑制诱导细胞凋亡的Caspase 通路的激活有关。研究结果提示,SWP 在一定剂量范围内对于氧化应激相关的神经退行性疾病的治疗可能有效。
参考文献
1 Friedlander RM.Apoptosis and caspases in neurodegenerative diseases.N Engl J Med,2003,348:1365-1375.
2 Zhang HA,Gao M,Zhang L,et al.Salvianolic acid A protects human SH-SY5Y neuroblastoma cells against H2O2-induced injury by increasingstress tolerance ability.Bioc Bioph Res Com,2012,231:479-483.
3 Rhee SG.H2O2,a necessary evil for cell signaling.Science,2006,312:1882-1883.
4 Chen HY(陈红艳),Di M(耿淼),Hu YZ(胡亚卓),et al.Effects of hydrogen peroxide on SH-SY5Y cell mitochondrial membrane potential.Int J Lab Med(国际检验医学杂志),2011,32:1665-1667.
5 Li WW(黎巍威),Wang XM(王学美).Advances in cellular oxidative stress in PC12 cells as a model.Chin J Med(中国中西医结合杂志),2011,48:128-132.
6 Kwon SH,Kim JA,Hong SI,et al.Loganin protects against hydrogen peroxide-induced apoptosis by inhibiting phosphorylation of JNK,p38,and ERK 1/2 MAPKs in SH-SY5Y cells.Neu Int,2011,58:533-541.
7 Li JW(李金王),Sun XW(孙晓伟),Yang LS(杨来胜).et al.Lanzhou Watermelon.Chin Veg(中国瓜菜),2007,13(2):8-9.
8 Gansu Horticultural Society of Professional Committee of melons(甘肃省园艺学会瓜类专业委员会).Opinions on black watermelon production and research to define some of the terms of the standard.Chin Veg(中国瓜菜),2006,23(2):31-33.
9 Ma GC(马成广).Chinese Native(中国土特产大全).Watermelon and Lanzhou Tracts,1986.313-314.
10 Franz G.Polysaccharides in pharmacy:current applications and future concepts.Planta Med,1998,55:493-497.
11 Chen X(陈旋),Zhang Y(张翼),Zhang JB(张剑波).Research advances in plant polysaccharides.Flavonoids from Lycoris aurea.Nat Prod Res Dev(天然产物研究与开发),2005,17:539-541.
12 Wang CP(王翠平).Research on antitumor activity and oxidation resistant of watermelon.Anhui Agric Sci(安徽农业科学),2011,29:17833-17836.
13 Song S(宋珅),Zhao BT(赵宝堂),Yin ZX(殷振雄),et al.Separation of watermelon extract polysaccharides andmonosaccharide composition analysis by GC-MS.Food Ferment Ind(食品与发酵工业),2013,22:212-224.
14 Li ZH(李朝晖),Wang F(王芬),Liu SP(刘水平),et al.The establishment of PC12 cell injury induced by hydrogen peroxide model.J Forensic Med(法医学杂志),2007,35(3):41-46.
15 Cao BY,Yang YP,Luo WF,et al.Paeoniflorin,a potent natural compound,protects PC12 cells from MPP+and acidic damage via autophagic pathway.J Ethnopharmacol,2010,131:122-129.
16 Guo CY(郭春燕).Study of several active ingredients of traditional Chinese medicine on H2O2-induced oxidative damage in SH-SY5Y cell mechanism.Shijiazhuang:Hebei Medical University(河北医科大学),PhD.2013.
——兰州籽瓜

