芒果苷代谢产物的合成及黄嘌呤氧化酶抑制活性研究
杨 华,徐镇平,何梦婷,何严萍,李 玲,宋流东*
1 昆明医科大学生物医学工程研究中心,昆明 650500;2昆明医科大学第二附属医院,昆明 650101;3 云南大学化学科学与工程学院,昆明 650091
芒果苷(mangiferin)系四羟基吡酮的碳糖苷、属双苯吡酮类化合物,前期研究发现它具有较强降低高尿酸血症小鼠血尿酸作用,与临床一线抗痛风药别嘌醇相比,具有效价高而毒性低的特点[1]。然而研究表明芒果苷的生物利用度很低,大鼠经口给药的生物利用度仅为1.2%[2],难以解释它较强的体内降尿酸作用,因而推测它的降尿酸作用与它的代谢产物有关。
研究表明1,3,6,7-四羟基氧杂蒽酮(2)为芒果苷在消化道内的主要代谢产物,由肠道细菌分解它而得[3],吸收后再进一步代谢为其它代谢物[4];而1,3,7-三羟基氧杂蒽酮(3)则是它被吸收后经尿液排出最多的一个代谢产物[4]。由于从给药动物体内获得芒果苷代谢产物甚微,本研究采用化学方法合成了它的两个主要代谢产物2、3,并以尿酸生成的关键酶黄嘌呤氧化酶为靶点,研究2、3 及合成中间体4、5、6、7 对黄嘌呤氧化酶活性的影响,探讨代谢产物在芒果苷降尿酸作用中的地位,为诠释它的降尿酸作用提供实验和理论依据。
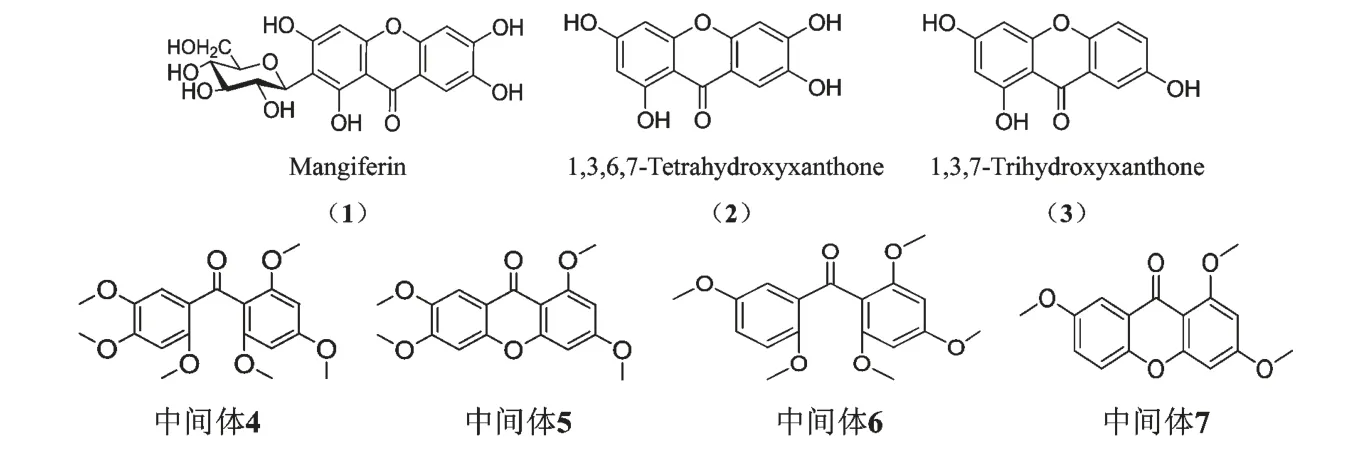
图1 芒果苷、代谢产物以及合成中间体的化学结构Fig.1 Chemical structures of mangiferin,its metabolites and their synthetic precursors
1 材料与方法
1.1 材料
1.1.1 主要试剂
2,4,5-三甲氧基苯甲酸、2,5-二甲氧基苯甲酸、1,3,5-三甲氧基苯、黄嘌呤氧化酶、黄嘌呤钠盐、焦磷酸钠、别嘌醇和EDTA 均为Sigma 公司产品;芒果苷由昆明医科大学生物医学工程中心提供,纯度>95%(HPLC);别嘌醇片系广东彼迪药业有限公司产品,氧嗪酸钾为山东中科泰斗化学有限公司生产,其余试剂均为国产分析纯。
1.1.2 实验动物
SPF 级KM 小鼠,雄性,体重18~22 g,购自昆明医科大学实验动物中心,实验动物生产许可证号:SCXK(滇)2005-0008。
1.1.3 实验仪器
熔点用四川大学科仪厂XRC-1 显微熔点测定仪测定;NMR 用Bruker DRX-400MHz 型核磁共振仪测定;BioTek 全波长紫外-可见光酶标仪型号:PowerWave XS。
1.2 方法
1.2.1 代谢产物1,3,6,7-四羟基氧杂蒽酮(2)的合成
参照文献[5]方法合成了1,3,6,7-四羟基氧杂蒽酮(2)及中间体2,2',4,4',5',6-六甲氧基二苯甲酮(4)和1,3,6,7-四甲氧基氧杂蒽酮(5)。
1.2.2 代谢产物1,3,7-三羟基氧杂蒽酮(3)的合成
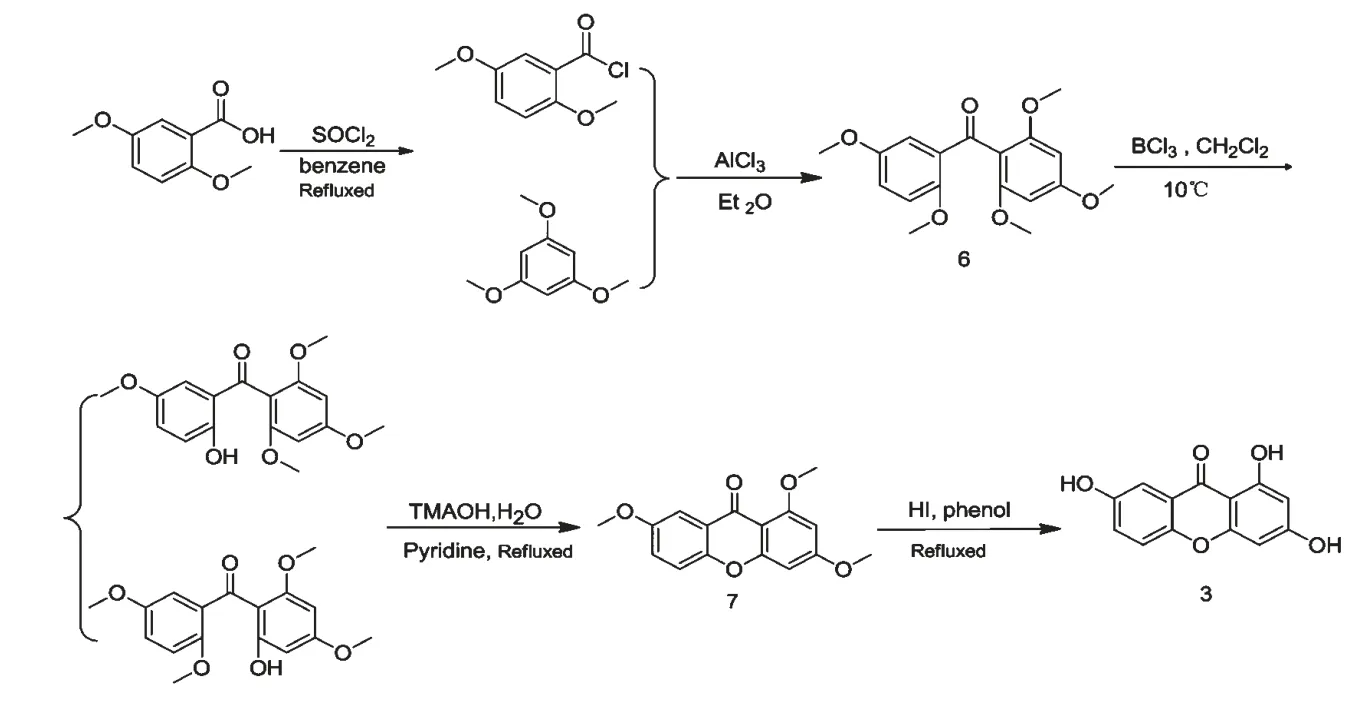
图2 1,3,7-三羟基氧杂蒽酮合成图Fig.2 Scheme for synthesis of 1,3,7-trihydroxyxanthone
1.2.2.1 中间体2,2',4,5',6-五甲氧基二苯甲酮(6)的合成
[6-8]方法,在50 mL 圆底烧瓶中加入2,5-二甲氧基苯甲酸1.000 g(5.49 mmol)、苯30 mL、氯化亚砜7 mL,干燥回流10 h,减压除去溶剂,得淡棕色油状物(2,5-二甲氧基苯甲酰氯);其中加入乙醚30 mL、1,3,5-三甲氧基苯0.930 g(5.54 mmol),在冰水浴中溶解后分批加入三氯化铝1.200 g,室温搅拌22 h;反应物中加入冰水40 mL、浓盐酸3 mL,搅拌均匀后用氯仿萃取,无水硫酸镁干燥,过滤浓缩后过硅胶柱,石油醚-二氯甲烷-乙酸乙酯(11∶2∶1)洗脱,得中间体2,2',4,5',6-五甲氧基二苯甲酮(6)0.820 g(2.47 mmol,收率45.0%)。
1.2.2.2 中间体1,3,7-三甲氧基氧杂蒽酮(7)的合成
在50 mL 圆底烧瓶中加入2,2',4,5',6-五甲氧基二苯甲酮(6)0.500 g(1.51 mmol)、无水二氯甲烷10 mL,在10 ℃水浴中搅拌并加入1 M 三氯化硼二氯甲烷溶液10 mL,继续搅拌20 min,将其倒入50 mL 冰水中搅拌至溶液呈黄色,有机层用无水硫酸镁干燥,浓缩后过硅胶柱,石油醚-二氯甲烷-乙酸乙酯(12∶1∶1)洗脱,得2'-羟基-2,4,5',6-四甲氧基二苯甲酮或2-羟基-2',4,5',6-四甲氧基二苯甲酮。
在100 mL 圆底烧瓶中加入上述所得全部2'-羟基-2,4,5',6-四甲氧基二苯甲酮或2-羟基-2',4,5',6-四甲氧基二苯甲酮,再加入吡啶20 mL、水10 mL和25%的四甲基氢氧化铵(简称TMAOH)水溶液15 mL,回流16 h,酸化后氯仿萃取,无水硫酸镁干燥,浓缩后过硅胶柱,石油醚-二氯甲烷-乙酸乙酯(20∶6∶1~2∶1∶1)洗脱,得中间体1,3,7-三甲氧基氧杂蒽酮(7)0.144 g(0.50 mmol,收率33.1%)。
1.2.2.3 代谢产物1,3,7-三羟基氧杂蒽酮(3)的合成
在50 mL 圆底烧瓶中加入1,3,7-三甲氧基氧杂蒽酮(7)0.100 g(0.35 mmol)、苯酚10 mL、氢碘酸5 mL,160 ℃油浴回流7 h,反应液倒入150 mL、4.7%的亚硫酸氢钠水溶液中搅拌,过滤、干燥后用热甲醇溶液溶解,再过滤去杂质,滤液浓缩后过硅胶柱,石油醚-丙酮(4∶1)洗脱,得代谢产物1,3,7-三羟基氧杂蒽酮(3)0.068 g(0.28 mmol,收率80.0%)。
1.2.3 芒果苷及其代谢产物对黄嘌呤氧化酶活性的影响
参照文献方法[9-11]体外测定芒果苷及其代谢产物对黄嘌呤氧化酶活性的影响,即在96 孔紫外检测板中加入黄嘌呤氧化酶(8 U/L)和系列浓度的受试化合物或阳性对照药别嘌醇,于25 ℃预温15 min,加入黄嘌呤(160 μmol/L)启动反应,25 ℃反应30 min,加入1N HCl 14.5 μL 终止反应,于全波长紫外-可见光酶标仪在295 nm 下测定紫外吸光度(OD),按下式计算抑制率,用GraphPad 5.0 软件计算IC50值。
酶活性抑制率%=[酶组OD 值-(样品组OD值-样品本底OD 值)]/(酶组OD 组-空白OD 值)×100%
1.2.4 芒果苷及其代谢产物的降尿酸作用
雄性KM 小鼠50 只,体重18~22 g,适应性饲养后,随机分为5 组,每组10 只,即:正常对照组、高尿酸血症模型对照组、芒果苷组、代谢产物2 组(1.85 mg/kg)和阳性对照药别嘌醇组(1.0 mg/kg),分别给予等体积溶媒(0.5% CMC-Na)、芒果苷3.0 mg/kg、代谢产物21.85 mg/kg 和阳性对照药别嘌醇1.0 mg/kg,均按10 mL/kg 灌胃给药,每天2次,共5 次,末次给药前1 h 一次性腹腔注射尿酸氧化酶抑制剂氧嗪酸钾450 mg/kg,造成高尿酸血症小鼠模型[11,12],正常对照组则注射等体积0.5%CMC-Na 溶液,注射体积为20 mL/kg,给药后1 h 小鼠眼球后静脉丛取血,3500 rpm 常温离心10 min,取血清,采用磷钨酸法测定血清尿酸水平。数据用均数±标准差表示,用GraphPad 5.0 软件做t-检验进行统计学处理。
2 实验结果
2.1 代谢产物2、3 和合成中间体4、5 的结构表征
代谢产物2、3 和合成中间体4、5 的结构表征与文献[5-8]报道一致。
2.2 合成中间体6、7 的结构表征
中间体6:淡黄色固体,收率45.0%,mp.86~90 ℃;1H NMR(CDCl3,400 MHz)δ:7.24(s,1H,CH),6.99(d,J=8 Hz,H,CH),6.86(d,J=8 Hz,H,CH),6.11(s,2H,2CH),4.02(s,3H,CH3),3.76(s,3H,CH3),3.66(s,3H,CH3),3.63(s,3H,CH3),3.56(s,3H,CH3);13C NMR(CDCl3,400 MHz)δ:193.1,162.0,158.6,153.8,153.2,129.8,119.4(CH),115.6(CH),114.2(CH),90.6(CH),57.0(CH3),55.8(CH3),55.7(CH3),55.3(CH3)。
中间体7:黄色固体,收率33.1%,mp.138~142 ℃;1H NMR(CDCl3,400 MHz)δ:7.67(d,J=2.8 Hz,1H,CH),7.30(d,J=8.8 Hz,1H,CH),7.22(dd,J=2.8,3.2 Hz,1H,CH),6.46(d,J=2 Hz,1H,CH),6.31(d,J=2 Hz,1H,CH),3.96(s,3H,CH3),3.89(s,3H,CH3),3.88(s,3H,CH3);13C NMR(CDCl3,400 MHz)δ:175.2,164.7,161.8,159.7,155.8,149.5,123.3,123.2(CH),118.2(CH),106(CH),94.9(CH),92.5(CH),56.3(CH3),55.8(CH3),55.7(CH3)。
2.3 芒果苷及其代谢产物对黄嘌呤氧化酶活性的影响
研究结果表明芒果苷代谢产物2 具有较强的黄嘌呤氧化酶抑制作用,且呈现出浓度依赖性,其IC50为10.89 μM,合成2 的中间体5、代谢产物3、合成3的中间体7 也有一定的抑制活性,在终浓度为87.3 μM 时,抑制率分别为45.8、52.1 和32.1%,均弱于2;在此浓度下,中间体4、6 和芒果苷对黄嘌呤氧化酶的活性没有明显的抑制作用;阳性对照药别嘌醇则浓度依赖性的抑制黄嘌呤氧化酶活性,其IC50为2.95 μM(表1)。
2.4 芒果苷及其代谢产物对高尿酸血症小鼠血尿酸的影响
研究结果表明模型组动物腹腔注射尿酸酶抑制剂氧嗪酸后,血清尿酸水平显著高于正常对照组,差异有统计学意义(P<0.01),提示模型复制成功。灌胃给予高尿酸血症小鼠芒果苷和代谢产物2 后,均显著降低高尿酸血症小鼠的血清尿酸水平,与模型对照组相比,有显著性差异(P<0.05);芒果苷与等摩尔剂量的代谢产物2 相比,差异无统计学意义,提示芒果苷和代谢产物2 降尿酸作用的效价相当(表2)
表1 芒果苷及其代谢产物对黄嘌呤氧化酶活性的影响(±s,n=4)Table 1 Inhibition effects of mangiferin and its metabolites on xanthine oxidase activity(±s,n=4)

表1 芒果苷及其代谢产物对黄嘌呤氧化酶活性的影响(±s,n=4)Table 1 Inhibition effects of mangiferin and its metabolites on xanthine oxidase activity(±s,n=4)
表2 芒果苷及代谢产物7 灌胃给药对氧嗪酸钾诱导高尿酸血症小鼠血清尿酸水平的影响(±s,n=10)Table 2 Effect of mangiferin and its metabolites on serum urate levels in potassium oxonate-induced hyperuricemic mice(±s,n=10)
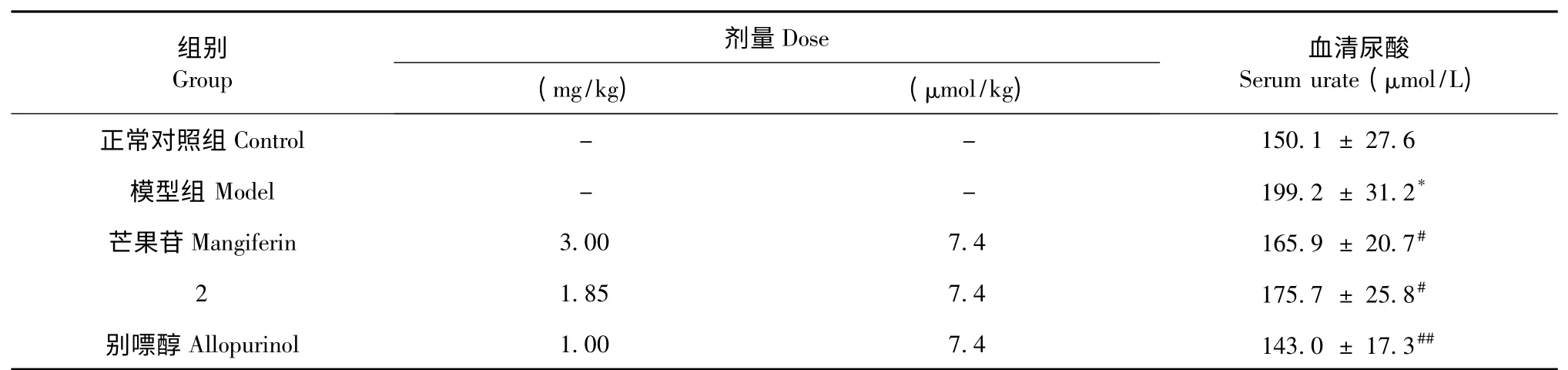
表2 芒果苷及代谢产物7 灌胃给药对氧嗪酸钾诱导高尿酸血症小鼠血清尿酸水平的影响(±s,n=10)Table 2 Effect of mangiferin and its metabolites on serum urate levels in potassium oxonate-induced hyperuricemic mice(±s,n=10)
注:与正常组比较,* P<0.01;与模型对照组比较,#P<0.05,##P<0.01(t-test 检验)。Note:Compare with control group,* P<0.01;Compare with model group,#P<0.05,##P<0.01(t-test).
3 讨论
在代谢产物3 的合成过程中,2'-羟基-2,4,5',6-四甲氧基二苯甲酮或2-羟基-2',4,5',6-四甲氧基二苯甲酮合环时,参考文献[8]方法用2M 氢氧化钠水溶液或氢氧化钾水溶液、吡啶、甲醇回流,反应效果不好,有许多原料没有反应完;当参考文献[6,7]方法改用10%或25%的四甲基氢氧化铵水溶液、吡啶-水(1∶1 或2∶1)反应,产物生成较多,结果好得多,而且用25%的四甲基氢氧化铵水溶液比用10%的四甲基氢氧化铵水溶液结果更好,吡啶-水(2∶1)也比吡啶-水(1∶1)反应结果好一些,提示水的用量可能越少越好,其相关性需要进一步研究。
黄嘌呤氧化酶作为嘌呤代谢的关键酶,其活性增高是形成高尿酸血症的主要原因,因而成为治疗痛风和高尿酸血症的重要靶点[13]。目前临床使用的黄嘌呤氧化酶抑制剂别嘌醇和非布索坦即是通过抑制黄嘌呤氧化酶活性,阻断了尿酸的生成,有效降低血清尿酸水平,从而达到预防和治疗痛风或高尿酸血症的目的。本研究以此为靶点,探讨芒果苷代谢产物对黄嘌呤氧化酶活性的影响,结果表明芒果苷的代谢产物2 和3 均具有黄嘌呤氧化酶抑制作用,2 的活性更强,IC50为10.89 μM。3 与2 相比,碳6 位上少一个羟基,在浓度为87.3 μM 时,其活性降低了39.3%;当羟基被甲氧基取代后(5、7),抑制活性也明显降低,吡喃环开环后(4、6)则黄嘌呤氧化酶的抑制作用丧失,提示芒果苷代谢产物抑制黄嘌呤氧化酶活性的核心结构应该是母核氧杂蒽酮(即双苯吡酮),羟基的位置和数量对维持黄嘌呤氧化酶抑制作用也具有重要作用。
鉴于代谢产物3 抑制黄嘌呤氧化酶的活性低于2,且3 积累的量有限,因此选择代谢产物2 进行体内降尿酸作用研究。研究表明等分子的芒果苷和代谢产物2 灌胃给药后其降低高尿酸血症小鼠血尿酸作用的效价相当,说明代谢产物2 可能是芒果苷降尿酸作用的主要代谢产物,通过抑制黄嘌呤氧化酶活性,减少了尿酸的生成,从而改善高尿酸血症。然而,文献报道芒果苷进入体内后的代谢很复杂,能分解出较多的代谢产物[4,14],这些代谢产物是否都具有黄嘌呤氧化酶抑制活性尚需进一步实验证明。
参考文献
1 Han DD,Chen CJ,Zhang C,et al.Determination of mangiferin in rat plasma by liquid-liquid extraction with UPLCMS/MS.J Pharm Biomed Anal,2010,51:260-263.
2 Niu YF,Lu W,Gao LH,et al.Reducing effect of mangiferinon serum uric acid levels in mice.Pharm Biol,2012,50:1177-1182.
3 Sanugul K,Akao T,Li Y,et al.Isolation of a human intestinal bacterium that transforms mangiferin to norathyriol and inducibility of the enzyme that cleaves a C-glucosyl bond.Biol Pharm Bull,2005,28:1672-1678.
4 Wang H,Ye G,Ma CH,et al.Identification and determination of four metabolites of mangiferin in rat urine.J Pharm Biomed Anal,2007,45:793-798.
5 Xu ZP(徐镇平),Song LD(宋流东).Total synthesis of 1,3,6,7-tetrahydroxyxanthone of metabolites from mangiferin.J Kunming Med Univ(昆明医科大学学报),2012,5:64-65.
6 Hu HG,Liao HL,Zhang J,et al.First identification of xanthone sulfonamides as potent acyl-CoA:cholesterol acyltransferase(ACAT)inhibitors.Bioorg Med Chem Lett,2010,20:3094-3097.
7 Lin CN,Liou SS,Ko FN,et al.Gamma-pyrone compounds.II:Synthesis and antiplatelet effects of tetraoxygenated xanthones.J Pharm Sci,1992,81:1109-1112.
8 Mondal M,Puranik VG,Argade NP.Facile synthesis of 1,3,7-trihydroxyxanthone and its regioselective coupling reactions with prenal:simple and efficient access to osajaxanthone and nigrolineaxanthone F.J Org Chem,2006,71:4992-4995.
9 Zhu SY(朱深银),Zhou YD(周远大),Liu QS(刘庆山),et al.Establishment and application of a high-throughput screening assay for xanthine oxidase inhibitor in vitro.Chin Pharm J(中国药学杂志),2007,42:187-189.
10 Ozyurek M,Bektasoglu B,Guclu K,et al.Measurement of xanthine oxidase inhibition activity of phenolics and flavonoids with a modified cupric reducing antioxidant capacity(CUPRAC)method.Anal Chim Acta,2009,636:42-50.
11 Niu YF,Zhu HJ,Liu J,et al.3,5,2',4'-Tetrahydroxychalcone,a new non-purine xanthine oxidase inhibitor.Chem-Biol Interact,2011,189:161-166.
12 Hall IH,Scoville JP,Reynolds DJ,et al.Substituted cyclic imides as potential anti-gout agents.Life Sci,1990,46:1923-1927.
13 Whelton A.Current and therapeutic options for the management of gout.Am J Ther,2010,17:402-417.
14 Liu HH,Wang K,Tang YH,et al.Structure elucidation of in vivo and in vitro metabolites of mangiferin.J Pharm Biomed Anal,2011,55:1075-1082.

