雨 生 红球藻中虾 青 素的提取和 稳 定性研究
刘铁楠 吴春涛 苏鹏宇 李素新 张志婓
华北理工大学,河北唐山 063000
雨 生 红球藻中虾 青 素的提取和 稳 定性研究
刘铁楠 吴春涛 苏鹏宇 李素新 张志婓
华北理工大学,河北唐山 063000
目的以雨生红球藻为原料,研究有机溶剂提取虾青素的条件及其稳定性。方法通过试验选取乙酸乙酯、丙酮、二氯甲烷、无水乙醇和二氯甲烷∶丙酮(2∶1)为提取溶剂,研究不同提取溶剂对虾青素提取效果的影响;应用试验得到的最佳溶剂分别于 20、30、40、50、60、70、80℃下提取虾青素,确定最佳提取温度;在所得到的最适温度和溶剂下分别提取 1、1.5、2、2.5、3 h 确定最佳提取时间;设定提取次数分别为 1、2、3 次,提取后测定其OD480,研究提取次数对虾青素提取效果的影响;采用上述实验中优选出的提取溶剂、温度和时间,料液比分别取1∶5、1∶10、1∶15、1∶20、1∶25,1∶30、1∶35、1∶40,提取完成后测定其OD480,考察不同料液比对总虾青素提取率的影响。 测定虾青素提取液在不同光照(自然光、日光、避光)、温度(30、40、50、60、70、80℃)、酸碱度(pH 8~14)等条件下的吸光度,以研究虾青素的稳定性。结果虾青素的提取中二次提取可获得 90%虾青素,当料液比为 1∶25 时所测吸光值最大;二氯甲烷∶丙酮(2∶1)为最佳提取液。随光照强度增加以及碱浓度增加,虾青素的降解增加。60℃以下,温度对虾青素的影响较小,60℃以上,虾青素开始受热破坏。结论二氯甲烷∶丙酮(2∶1)是最适的提取溶剂,1∶25 为最佳料液比;二次提取后已经提取出大部分虾青素,光照可导致虾青素的降解,虾青素对碱不稳定;虾青素在60℃以下比较稳定。
雨生红球藻;虾青素;丙酮;提取;稳定性
虾青素(图 1)是 一种具有很 高 经济价 值 和 广 泛生物活性的类胡萝卜素,虾青素的抗氧化能力是 β-胡萝卜素的 10 倍,是维生素 E 的 500 倍,被称为“超级维生素 E”[1-2],在食品、饲料、保健品、医药及化妆品等行业均有广泛的应用价值。 雨生红球藻中虾青素含量为 1.5%~3.0%,被看作是天然虾青素 的“浓缩品”,已成为近年来该领域的研究热点[3],目前虾青素的 产量远远不能满足全球市场的需求量[4-8]。
目前工业上提取虾青素 最常用的方法为有机溶剂提取法,因为有机溶剂具有容易回收、可以重复利用、成本低以及提取效率高等优点[9-16]。 为此,本文选用不同溶剂进行比较,对雨生红球藻中虾青素提取物的提取效率进行分析,旨在寻找能够安全、有效地提取雨生红球藻中虾青素的有机溶剂。 另外,还研究了热、光、pH 值对虾青素稳定性的影响 ,进而得到合理保存虾青素的条件,以减少在储藏、运输和使用过程中的损失。

图1 虾青素(astaxanthin)的分子结构式(C40H52O4)
1 仪器与材料
Waters 2695 高效液相色谱仪(美国 Waters 公司),Unico UV-2000 紫外检测(美国尤尼柯 unico 公司),KL-UP-III-80 超纯水 机(成都唐 氏康宁科技 发展有限公司),PS104S 电子分析天平(德国 Sartorius),SB-100DT 超声波清洗仪(太原仪诚实验室设备有限公司),THZ-92A 气浴恒温振荡器(上海博迅)。 雨生红球藻为单细胞藻。 由青岛绿萃生物科技有限公司提供实验材料(批号 08K0301)。 二氯甲烷、甲醇为色谱纯,水为超纯水。
2 方法与结果
2.1 虾青素含量计算方法
应用下列公式计算提取液中虾青素含量[17]:
C(mg/kg)= 4.6×(OD480-0.638×OD645+0.114×OD663)×稀释倍数
其中,C 为雨生红球藻中虾青素的质量浓度(mg/kg);OD480、OD645、OD663分 别 为 提 取 液 在 480、645、663 nm下的吸光度数值;稀释倍数为提取液最终的体积(mL)与称取的雨生红球藻藻粉(冷冻干燥并低温破碎)质量(g)之比。
2.2 虾青素的提取
2.2.1 虾青素提取溶剂的确定 选取乙酸乙酯、 丙酮、二氯甲烷、无水乙醇和二氯甲烷∶丙酮(2∶1)为提取溶剂,研究不同提取溶剂以及混合溶剂之间不同比例对虾青素提取效果的影响,应用 UnicoUV-2000 测定其各吸光度值,以选取最佳的提取溶剂。在 480 nm 处测量吸光度,在几种溶剂提取物中,二氯甲烷提取物是最高的,同时其在 645、663 nm 下的吸光度也最高,所以不能断定运用二氯甲烷对虾青素进行提取是效率最高的,而二氯甲烷∶丙酮(2∶1)的提取液在 480 nm下所测量的吸光值低于二氯甲烷提取液但高于其他有 机 溶 剂 提取 液 的 吸 光 值 , 且 它 在 645、663 nm 下的吸光度与其他有机溶剂提取液相差并不大,因此可以判定利用二氯甲烷∶丙酮(2∶1)作为溶剂提取虾青素的效率最高。 见表 1。

表1 不同溶剂虾青素提取液的吸光度值
2.2.2 提取温度对提取效果的影响 取 5 份藻液各 2 mL,加入适量“2.2.1”所得的最佳提取溶剂,分别于 20、30、40、50、60、70、80℃下提取虾青素。 实验中设置 3个平行样,提取完成后于 480 nm 波长处测量各样品吸光度。 分析可得,温度 60℃时,吸光度最大,因而选60℃为最适提取温度。 见图 2。

图2 不同提取温度下虾青素的提取效果比较
2.2.3 最佳提取时间的确定 取 5 份藻液各 2 mL,采用“2.2.1”中优选出的提取溶剂,在“2.2.2”所得最适温度下分别提取 1、1.5、2、2.5、3 h,实验中设置 3 个平行样,480 nm 波长下测其吸光度。 研究发现,雨生红球藻随着浸提时间的延长,其在 1~2 h 时提取液的吸光值明显增加,在 2 h 后略有下降。 故选取提取时间为2 h。 见图 3。

图3 不同浸提时间下虾青素的提取效果
2.2.4 提取次数的确定 取 5 份藻液各 2 mL,采用上述实验所得的最优提取溶剂、提取温度和时间进行虾青素的提取,提取完成后离心收集上清液,藻渣重复上述步骤。 设定提取次数分别为 1、2、3 次,以 3 次有机溶剂提取虾青素量总和计为 100%,实验中设置3 个平行样,提取后测定其OD480,研究提取次数对虾青素提取效果的影响。 研究发现,提取 3 次的虾青素提取百分比分别为 79.57%、12.24%、8.01%。 2 次提取率大于 90%,因此在雨生红球藻中提取虾青素的实际生产中可采用 2 次提取,以达到资源的合理利用,减少浪费。
2.2.5 料液比对提取效果的影响 移取 5 份藻液各 2 mL,采用上述实验中优选出的提取溶剂,温度和时间,料液比分别取 1∶5、1∶10、1∶15、1∶20、1∶25,1∶30、1∶35、1∶40,提取完成后测定其OD480。 研究结果提示,在 25 倍体积以下时,随溶剂的增加其提取效率也迅速上升,但之后增加缓慢。 因此,丙酮提取虾青素的最佳液料比为 1∶25。 见图 4。

图4 不同液料比下虾青素的提取效果
2.3 虾青素的稳定性
2.3.1 光照对虾青素稳定性的影响 将虾青素提取液分别置于室内自然光、日光、避光的条件下,每隔一段时间测定其OD480,并研究不同光照对虾青素稳定性的影响。 研究显示,日光对虾青素稳定性具有显著影响(P< 0.05),连续日光照射雨生红球藻提取液大约4 h 虾青素就会遭到完全破坏;室内自然光条件下,24 h后测定雨生红球藻丙酮提取液的吸光度显示虾青素的残存率为 70%;避光保存时,虾青素基本不会遭到破坏。 见图 5。
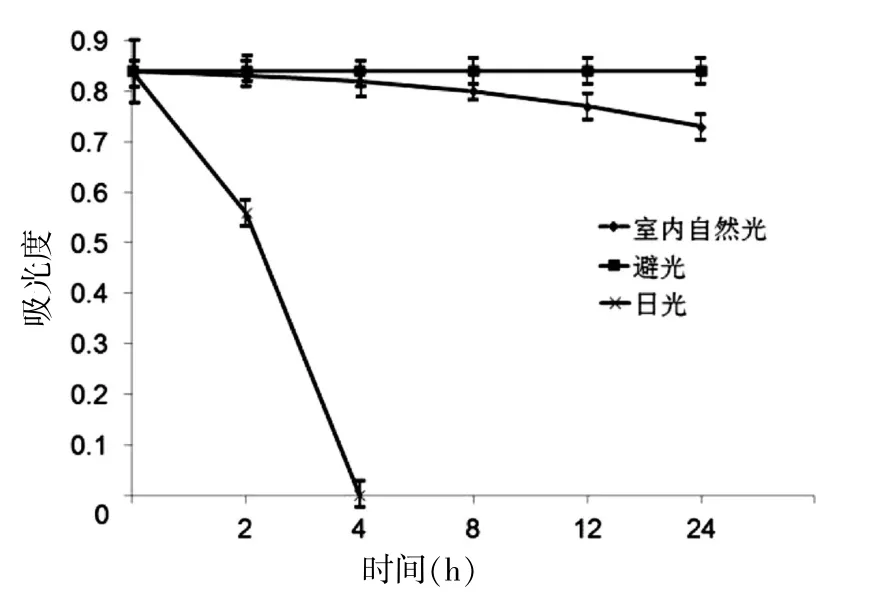
图5 光照对虾青素稳定性的影响
2.3.2 温度对虾青素稳定性的影响 将雨生红球藻提取液浓缩后用大豆油溶解,得到的虾青素色素油盛装于试管中,分别在 30、40、50、60、70、80℃温度下,每隔一段时间测定其OD480。 研究发现,30~60℃对虾青素的稳定性基本没有影响。 当温度达到 70℃时,雨生红球藻提取液吸光度随着加热时间延长而逐步下降。 当温度达到 80℃时雨生红球藻丙酮提取液吸光度下降趋势最大。 见图 6。
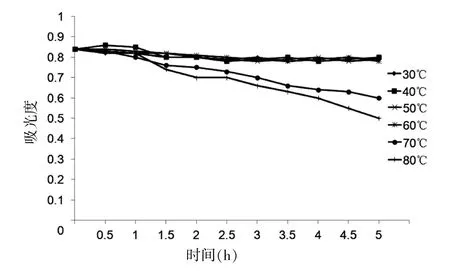
图6 温度对虾青素稳定性的影响
2.3.3 酸碱度对虾青素稳定性的影响 调节雨生红球藻丙酮提取液的 pH 达到 8~14 分别置于比色管中,于室温避光静置 4 h 后在 480 nm 下测定其吸光度。研究显示,随着 pH 增大,雨生红球藻丙酮提取液吸光度明显下降,说明虾青素遭到了破坏。 因此虾青素在碱性溶液中是不稳定的,pH 越大,虾青素被破坏得就越严重。 见图 7。
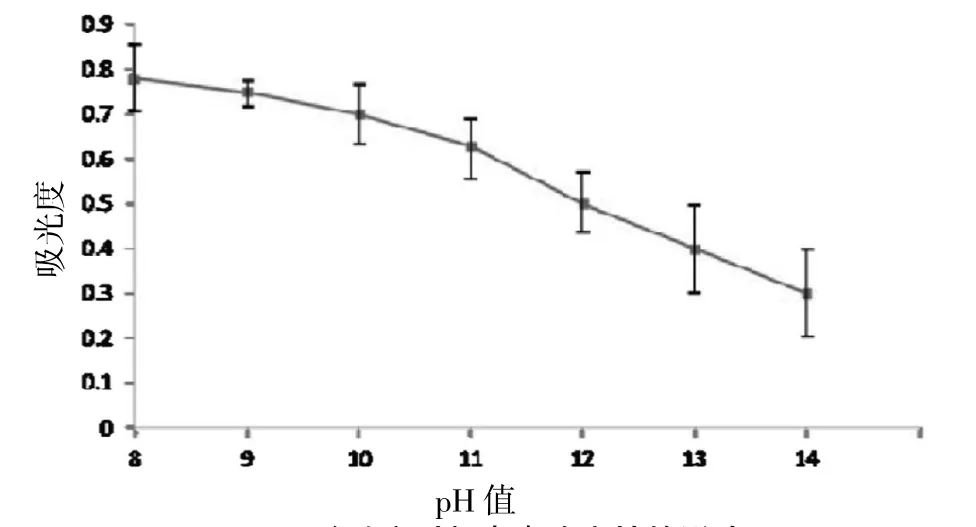
图7 酸碱度对虾青素稳定性的影响
3 讨论
目前,现代生产中提取虾青素最常用的方法为溶剂萃取法,雨生红球藻中的虾青 素 以脂类 形式 存在 ,而虾青素中脂类种类繁多且有其他胡萝卜素类,因此虾青素的提 取和纯化一直是虾青素大规模生产的最大难题[19-20]。 本研究以雨生红球藻为基本原料,通过不同溶剂对比 提取虾 青 素 ,得出二氯甲烷 ∶丙 酮(2 ∶1) 为虾青素的最适提取溶剂。 同时研究料液比、提取温度、提取时间对虾青素的影响,在料液比为1∶25时所 测吸 光度 最 大 ;2次提取后可提取出大部分虾青素 , 效率较高。在测定光、热、碱对虾青素稳定性的影响中发现,虾青素在 光照中不稳定,不同光照强度引起虾青素降解大小顺序为避光<室内光<室外光,因此虾青素应避光保存为宜;同时发现游离虾青素在碱性环境中不稳定,浓度越大,降解越严重,因此虾青素提取过程中应选择合适的碱浓度和皂化时间,以减小碱对虾青素的降解;温度在 60℃以下,虾青素较为稳定,而60℃以上,虾青素开始受热降解。 因本研究实验条件所限,未进行验证 试验,试验可能存在一定误差 ;且样本量较小,对虾青素提取过程中对实验仪器精度和试剂质量要求高,因此对于大批量生产提取虾青素以及提高虾青素的稳定性,尚待进一步研究实施。
[1] Lorenz RT,Cysewski GR. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin [J]. Tibtech Appil,2000,18(4):160-167.
[2] Dufosse L. Microbial production of food gradepigments [J]. Food Biotechnolgy,2006,44(3):313-321.
[3] Sandesh KB,Vidhyavathi R,Sarada R,et al. Enhancement of carotenoids by mutation and stress induced carotenogenic genes in Haematococcus pluvialis mutants [J]. Bioresource Technology,2008,99(18):8667-8673.
[4] Leigh S,Steven Leigh ML,Hoogevest PV. Crystal forms of astaxanthin:US,20080234521 [P]. 2007-09-23.
[5] Lorenz RT,Cysewski GR. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin [J]. Trends in Biotechnology,2000,18(4):160-167.
[6] Lee PC,Schmidt DC. Metabolic engineering towards biotechnological production of carotenoids in microorganisms [J]. Applied Microbiology and Biotechnology,2002,60(1):1 -11.
[7] 范荣新.虾青素的性质与开发[J].海湖盐与化工,2000,6(29):17-20.
[8] 綦秀芬,李恩泽,刘月芬,等.虾青素的研究进展[J].齐鲁医学杂志,2003,18(3):354.
[9] 万百惠,李敬,赵英源,等.微/纳米包封技术在改善虾青素水溶性和稳定性中的应用[J].食品工业科技,2014,35(23):382-386.
[10] 孟春晓,高政权,王依涛,等.雨生红球藻中虾青素提取方法研究现状[J].水产科,2010,29(12):745-748.
[11] 刘晓娟,伍颖华,何凤林,等.响应面法优化雨生红球藻中虾青素 的提取条 件 [J].食 品科 技,2012,37(2):233-238.
[12] 沈建新,韦金河.利用雨生红球藻生产虾青素的研究进展及其产 业化现状 [J].江苏农业科 学,2007,(3):196-199.
[13] 柴建,新万茵,付桂明,等.雨生红球藻中总虾青素提取工艺优化[J].中国食品添加剂,2011,(3):107-111.
[14] 宋光泉,闫杰,王荣辉,等.天然虾青素的提取纯化及其应用[J].广东化工,2007,34(11):63-66.
[15] 范荣新.虾青素的性质与开发[J].海湖盐与化工,2000,6(29):17-20.
[16] 张明祥,赵建国.国外虾青 素的 研究进展 [J].粮食与饲料工业,2002,(1):26-28.
[17] 韩 春 梅 , 刘 建 国 ,张 勇 .不 同 激 素 配 伍 对 雨 生 红 球 藻(Haematococcus pluvialis)细胞生长和虾青素积累的调节作用、藻株差异及应用[J].海洋与湖沼,2009,40(4):430-436.
[18] 李婷,韩丽君,袁毅.不同有机溶剂对雨生红球藻中虾青素提取成分的影响[J].海洋科学,2012,36(7):34-38.
[19] Rosana M,Galvão,Tarlen S,et al. Modeling of biomass production of haematococcus pluvialis [J]. Applied Mathematics,2013,4(8A):8-12.
[20] 高桂玲,成家杨,马炯.雨生红球藻和虾青素的研究[J].水产学报,2014,38(2):297-304.
Study on extraction and stability of astaxanthin from Haematococcus pluvialis
LIU Tienan W U Chuntao SU Pengyu LI Suxin ZHA NG Zhifei
North China University of Science and Technology,Hebei Province, Tangshan 063000, China
ObjectiveTo study the conditions and stability of astaxanthin extracted by organic solvent, takingHaematococcus pluvialisas raw materials.MethodsThe ethyl acetate, acetone, methylene chloride, absolute ethyl alcohol and methylene chloride ∶acetone (2∶1) were selected as extraction solvent by experiments, the effect of different extraction solvents for extraction of astaxanthin was studied; the optimum solvent gained from the experiment was used to extract astaxanthin at 20, 30, 40, 50, 60, 70, 80℃, so as to determine the optimum extraction temperature; under the gained optimum temperature and solvent, the astaxanthin was extracted for 1, 1.5, 2, 2.5, 3 h respectively, so as to determine the optimum extraction time;the extraction times were set as 1, 2, 3 times,OD480was measured after extraction, so as to study the effect of extraction times for extraction of astaxanthin; under the gained optimum solvent, temperature and time in the above experiments,the ratios of material to solvent were taken as 1∶5,1∶10,1∶15,1∶20,1∶25, 1∶30,1∶35,1∶40,OD480was measured after extraction, so as to investigate the effect of different ratios of material to solvent for extraction of astaxanthin. The stability of astaxanthin was researched, and the absorbance of astaxanthin extracting solution was determined at different conditions of light (natural light, sunlight, lucifuge), temperature (30, 40, 50, 60, 70, 80℃), acid-base (pH 8 - 14), and so on.ResultsIn the extraction of astaxanthin, the secondary extraction can obtain 90% of astaxanthin. When the ratio of material to solvent was 1∶25, the measured absorbance was maximum. Methylene chloride∶acetone (2∶1) was the best extracting solution.The degradation of astaxanthin increased with the increase of light intensity and the increase of alkali concentration. Below 60℃, the effect of temperature on astaxanthin was small. Above 60℃, astaxanthin began to be heated and damaged.ConclusionMethylene chloride ∶acetone (2∶1) is best extracting solution, and 1∶25 is the best ratio of material to solvent. the secondary extraction can extract most of astaxanthin, light can lead to degradation ofastaxanthin,astaxanthin is unstable to alkali,astaxanthin is relatively stable below 60℃.
Haematococcus pluvialis; Astaxanthin; Acetone; Extraction;Stability
Q949.9;S986.2
A
1673-7210(2015)08(b)-0025-04
2015-04-03 本文编辑:张瑜杰)
中国煤炭工业协会科学技术研究指导性计划项目(MTKJ2014-286)。

