产油微藻的筛选及其产油性能评价的研究
王玉荣, 师文静, 佟明友
产油微藻的筛选及其产油性能评价的研究
王玉荣1,2, 师文静2, 佟明友2
(1. 辽宁石油化工大学,辽宁 抚顺 113001; 2. 中国石化抚顺石油化工研究院,辽宁 抚顺 113001)
为了筛选具有产油潜力的能源微藻,从东北地区部分水域中分离出98种微藻。根据生长情况和尼罗红染色法筛选出14个藻种进行产油水平比较。通过藻种生物量以及油脂含量的测定,建立了富油微藻的综合评价方法,获得总脂含量超过30%的微藻10株,其中小球藻R1的油脂含量47.87%,油脂产率达到72.47 mg·L-1·d-1,并且其三酰基甘油含量较高,适合于生物柴油生产,是具有产业化潜力的优良藻种。
生物柴油; 产油微藻; 生物量; 油脂产率
为实现经济和环境的可持续发展,可再生、无污染的生物质能源已成为研究热点[1]。生物柴油是一种重要的可再生能源[2],但生产原料来源一直是限制其产业化的瓶颈。微藻因其资源丰富、生长迅速、油脂含量高等优点,成为生产生物柴油的理想原料[3,4]。但要发展能源微藻,进行含油微藻规模化生产,还面临许多技术问题,优良藻种的获得就是瓶颈之一。
很多微藻都含丰富的油脂,但不同微藻油脂含量有明显差异[5]。因此,筛选高产油微藻是产业化的关键[6]。国内外研究者对能源微藻的筛选和评价做了很多工作[7,8]。本研究从东北地区的部分自然水体中分离出微藻藻种,利用尼罗红染色法筛选出多株高产油微藻,对其生长速率、生物量和油脂含量进行分析评价,旨在获得生长速度快、生物量高、油脂含量高的优良藻种,为微藻生物柴油提供原料来源。
1 试验部分
产油微藻的筛选评价过程如图1所示。首先通过东北地区的部分水样采集得到各种微藻,分离、纯化;然后用染色法和显微检测进行初筛;再根据生物量和油脂产量两项指标进行复筛,其中生长速率和油脂含量是两个重要指标。生长速率指在单位时间和单位体积内生物量的积累量;油脂含量主要是指能做为生物柴油原料油脂的含量。最后,选取生长速率快、油脂含量高的藻种分类保藏。具体方法如下:
1.1 藻种的分离与纯化
藻种水样采自东北地区部分水域,在实验室进行平板划线法分离、纯化:吸取少量稀释的水样接种于灭菌的固体培养基上,在适宜的条件下培养2~3周,用接种环挑出单藻落,在大口三角瓶中纯化培养,3~4周后镜检,重复数次,直到获得纯的目标藻株。本研究共分离出98株藻种。将分离的藻种用50 mL大口三角瓶培养3个月左右,选择生长良好、易培养的52种藻株做下一步筛选。
1.2 微藻的尼罗红染色
小试管中取1 mL藻液,添加0.01 mL尼罗红染色液(以丙酮为溶剂配制成0.1 g/L),震荡混匀,于20 ℃避光染色10 min,用倒置荧光显微镜(蓝光激发)观察藻细胞内被染色油脂,确保油脂着色。然后用分光光度计测藻液的OD689.5值,用培养液将藻液稀释,使藻液的OD689.5值统一为5左右,再取1 mL的藻液于48孔荧光板,每孔再加入10 µL尼罗红染色液,用酶标仪检测530 nm光激发下,580 nm处的荧光强度,并扣除未染色藻液在该波长处的荧光强度即为净荧光值,重复测定三次。
1.3 筛选评价实验
首先将用尼罗红染色初筛选出的藻种移至1 L三角瓶(500 mL藻液)扩大培养,置水平摇床培养3~5 d,收集藻细胞,最后用新鲜培养基在微藻培养装置中接种。将藻种的初始浓度统一为OD689=0.1。培养周期为12 d,每两天测一次OD值,检测藻种生长速率,收集第12 d的藻液,10 000 r/min离心5 min收集藻细胞,冻干后测定生物量和油脂含量。
微藻分离纯化与筛选评价试验均采用BG-11培养基,培养温度(25±1)℃,光暗时间比12:12,光照强度200μmol/(m2·s)。筛选评价实验使用内径3.6 cm,高34cm的柱状光生物反应器(装液量为200 mL)培养。筛选评价实验持续通入压缩空气(1% CO2)。
1.4 分析方法
1.4.1 藻种比生长速率测定
比生长速率 = (lnN2- lnN1)/(T2-T1)
N1为接种时OD值,N2为培养结束时的OD值,T1和T2分别是培养开始和结束的时间。
1.4.2 生物量测定
将培养的藻液10 000 r/min离心5 min得到藻泥,-50 ℃下冷冻干燥至恒重,称重得到藻细胞干重。
1.4.3 油脂含量测定方法
用乙酸乙酯/正己烷混合溶剂萃取法对藻粉的总脂含量进行测定[9,10]
1.4.4 油脂产率计算
油脂产率 = 生物量×油脂含量/培养天数
1.5 薄层层析
利用氯仿/甲醇提取藻细胞中的油脂[11],然后进行微藻总脂的薄层层析[12,13]。
2 试验结果
2.1 藻株的分离纯化及初步鉴定
从采集的水样中分离纯化出98株藻种,其来源和细胞形态特征见表1。根据微藻的细胞形态及其生长特征,参照《中国淡水藻类—系统、分类及生态》,可以将部分微藻初步归入小球藻、栅藻、杆藻等属,要准确分类到种,还需要用分子生物学手段确定。
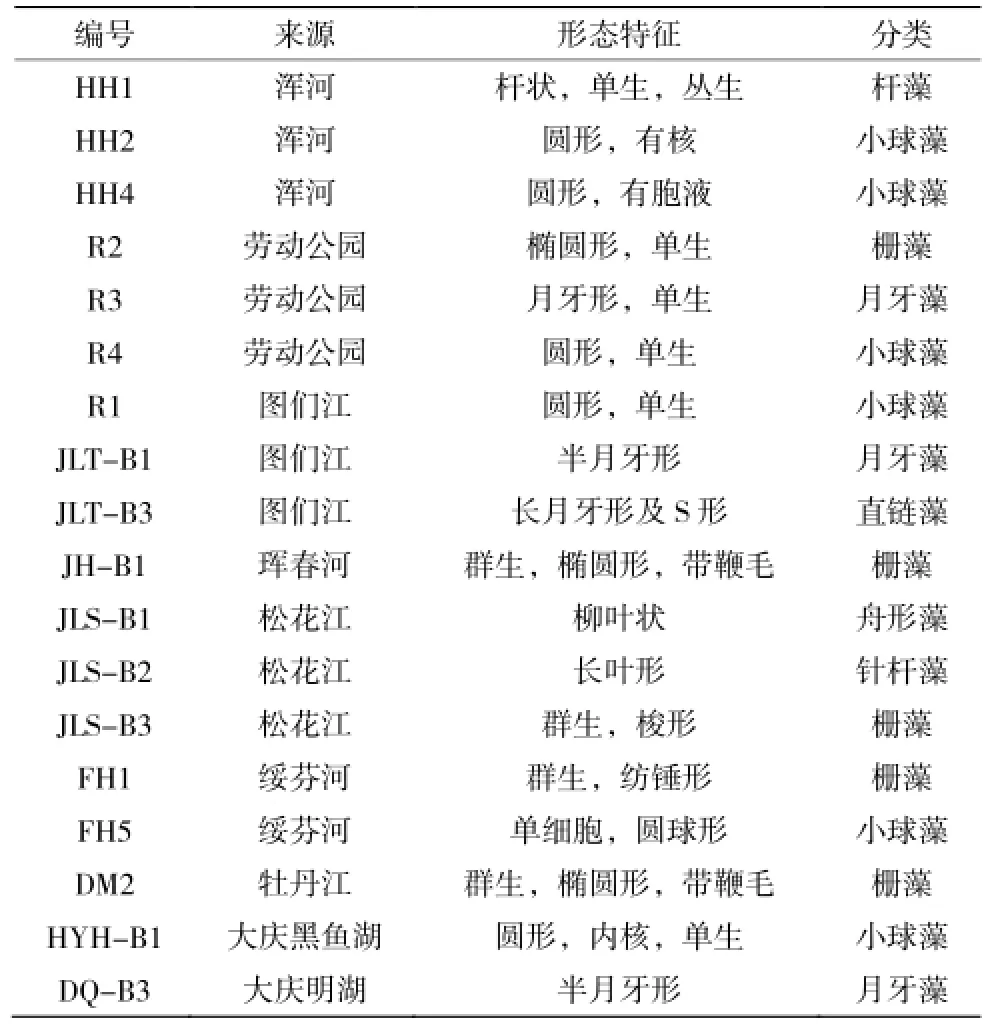
表1 部分藻种来源及特征Table 1 Sources and characteristics of part of algae species
从表1可知,分离出的藻种细胞形态均不一样,有圆形、杆状、月牙形、半月形、纺锤形、梭形、葡萄状等各种形态。栅藻细胞一般以群体形态存在,小球藻以单细胞状态存在。
2.2 藻株的尼罗红染色筛选
从98种藻种中筛选出生长快、不贴壁、不结团、易培养的藻种52株,对其进行尼罗红染色筛选。有研究表明,激发波长和散射波长分别为450~500 nm和大于528 nm时,经尼罗红染色的微藻细胞荧光强度与细胞内中性油脂的含量显著相关[14-17]。荧光强度越高则微藻油脂含量越高,因此,可通过即时测定荧光强度小来检测微藻的油脂含量。
表2是52种藻株的净荧光染色值,其中净荧光值较高的有12种,分别是N2、R1、N-2-1、HH1、HH2、HH4、W1、W2、W3、W4、W5、JLT-B1。从表2得知,不同藻种的尼罗红染色净荧光值不一样。藻株HH2的净荧光值达到135.23,而JH-1的净荧光值只有0.39,说明不同藻种的中性油脂含量差异很大。栅藻荧光值偏低,这与Luisa Gouveia[18]等报道的栅藻在自养条件下油脂含量较低相对应;而在筛选到的球藻中,多数有较高的荧光值,与文献[19,20]报道的球藻有较高的含油量相吻合。
2.3 微藻生长速率、生物量和油脂含量的测定
选出N2、R1、N-2-1等12种荧光值较高的藻种和2种生长速率较高的藻种ABH-B3、JH-D4进行藻种评价试验。表3 是藻种的生长速率、生物量和油脂含量的评价结果。比生长速率最高的是ABH-B3,达到0.5982d-1,其次是HH4、W2、JLT-B1、R1和HC-D4,都大于0.5 d-1。比生长速率较高的生物量也较高,因此藻种ABH-B3的生物量也高,达到2.32 g/L。藻种HH4、W2、JLT-B1、R1和HC-D4的生物量也都高于1 g/L。
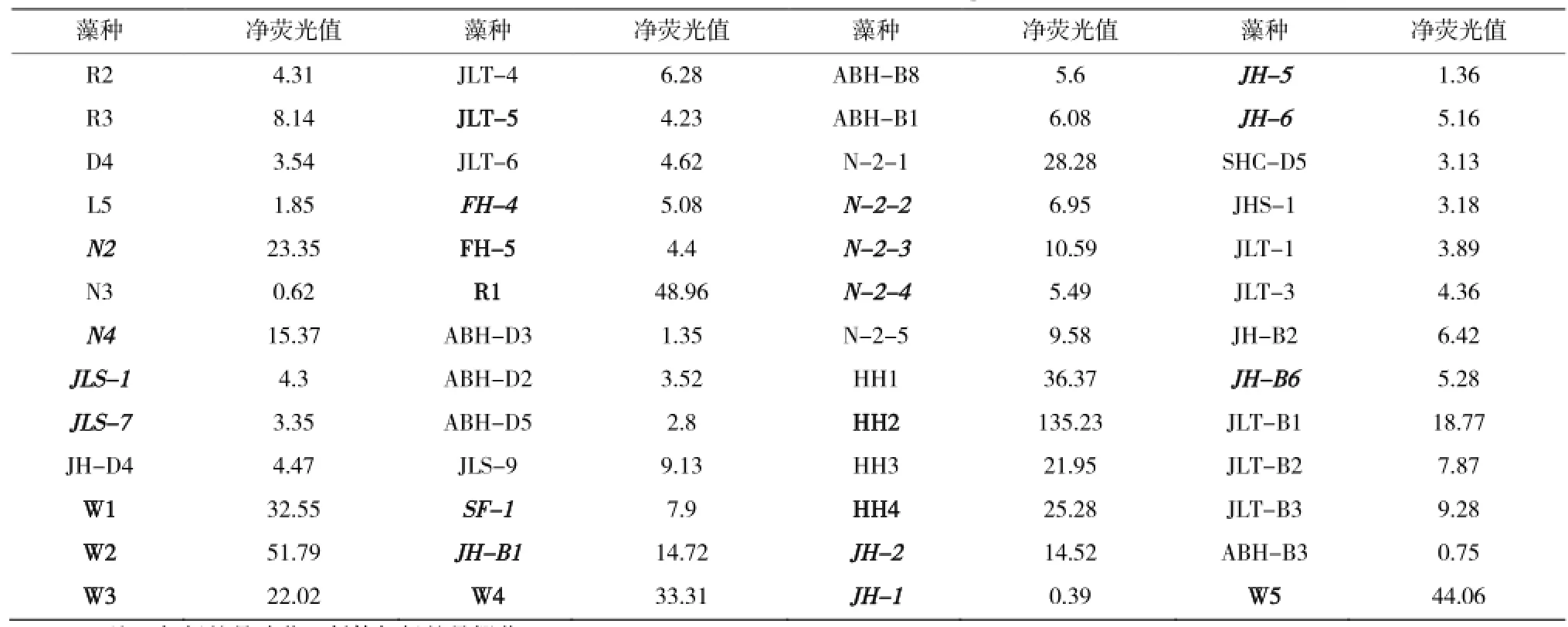
表2 尼罗红染色藻种及净荧光值Table 2 Nile red fluorescence of microalgae strains
2.4 微藻藻种的产油潜力评价
油脂产率是微藻总脂含量与生物量的乘积再除于培养天数,表示每天实际收获的油脂量。它是反映微藻生长速率、生物量与总脂含量的综合产考指标。图1为14种微藻的油脂产率图。其中R1的油脂产率最高,为72.47 mg·L-1·d-1。ABH-B3与HH4也有较高的油脂产率,分别为56.567 mg·L-1·d-1、42.03 mg·L-1·d-1。
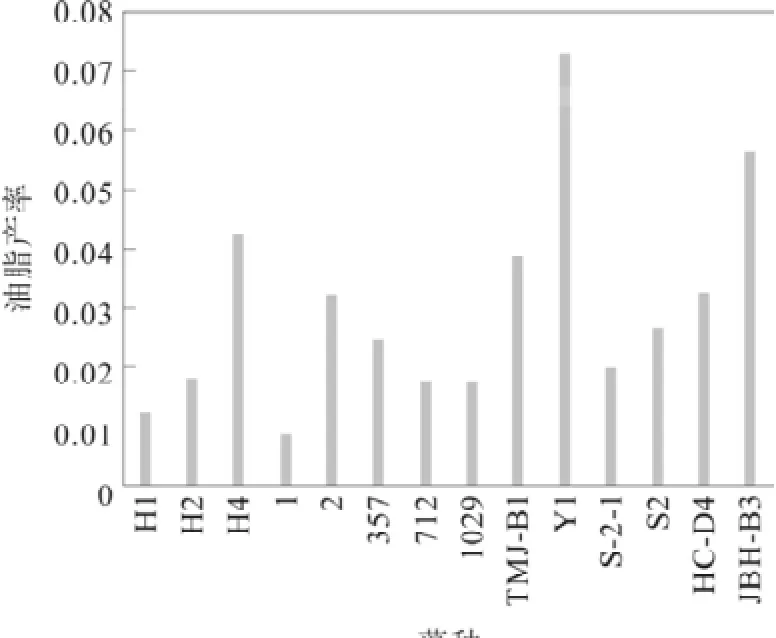
图1 微藻的油脂产率比较Fig.1 Comparison of microalgae oil yield
2.5 微藻中三酰基甘油含量的测定
微藻细胞内储存物三酰基甘油中的脂肪酸大多为饱和脂肪酸,是生产生物柴油所用原料的主要成分[21]。通过薄层层析可检测微藻中的三酰基甘油含量。该方法具有操作方便、快速检测、分离效果好等特点[22]。本研究将14种微藻培养至稳定期,以相同生物量提取油脂,通过薄层层析比较,筛选出三酰基甘油含量较高的藻种是R1、W2、W4、HH4和ABH-B3。
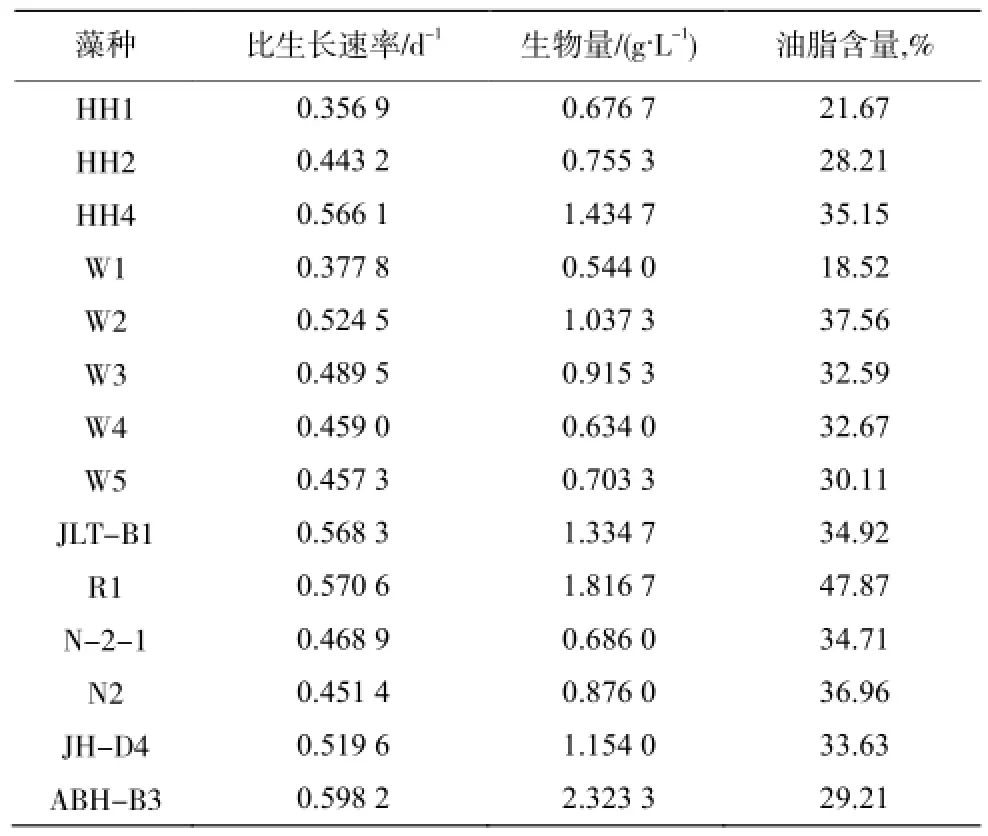
表3 藻种的生长速率、生物量和油脂含量Table 3 The growth rate,biomass and oil content of microalgae strains
3 结 论
从东北地区部分水域中分离出98种微藻,选出其中14种微藻进行产油水平评价,获得总脂含量超过30%的微藻有10株,其中藻株Y1的油脂含量47.87%,油脂产率达到72.47 mg·L-1·d-1,并且其三酰基甘油含量较高,是适于生物柴油生产的优良藻种。
本研究利用快速筛选富油微藻的尼罗红染色法、是一种很好的初级筛选方法。通过藻种比生长速率、生物量以及油脂含量的测定,建立了优良藻种的综合评价方法
为了使筛选的藻种适合于生产生物柴油,对油脂中的三酰基甘油进行薄层层析,结合油脂产率,确定小球藻R1是有产业化潜力的优良藻种。
[1]梁颖,冯俊丽,徐方娇,等.一株产油微藻—小球藻的纯化鉴定与培养基的筛选[J].科技通报,2013,29(3):40-46.
[2]孙漫,聂娟,袁维道,等.产油脂海洋微藻的筛选、鉴定及Fe3+对其生长和油脂积累的影响[J].中国油脂,2012,37 (12):70-73.
[3]Li Y, Horsman M, Wu N, et al. Biofuels from microalgae[J]. Biotechnology Progress, 2008, 24(4): 815–820.
[4]张玉玺,马红军.藻类生物燃料的发展与环境保护[J].当代化工,2013,42(12):1711-1714.
[5]张英伟,刘炜.微藻能源的研究进展[J].海洋科学,2012,36(1):132-138.
[6]Griffiths M J, Susan T L, Harrison. Lipid productivity as a key characteristic for choosing algal species for biodiesel production[J]. Journal of Applied Phycology, 2009, 21: 493–507.
[7]李涛,李爱芬,桑敏,等.富油能源微藻的筛选及产油性能评价[J].中国生物工程杂志,2011,31(4):98-105.
[8]Bai A, Jobbagy P, Durko E. Algae production for energy and foddering[J]. Biomass Conversion and Biorefinery, 2011, 1: 163–171.
[9]张桂艳,温小斌,梁芳,等.重要理化因子对小球藻生长和油脂产量的影响[J].生态学报,2011,31 ( 8) :2076-2085.
[10]温小斌,江丽丽,耿亚洪.微藻总脂定量分析方法的比较研究[J].中国油脂,2012,37(11):80-85.
[11]徐 进,徐旭东,方仙桃,等.高产油小球藻的筛选及其油脂分析[J].水生生物学报,2012 ,36( 3):426-432.
[12]Reiser S , Somerville C. Isolation of mutants of Acinetobactercal -coaceticus deficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase[J]. Journal Bacteriology, 1997,179(9): 2969-2975.
[13]Yu E T, Zendejas F J, Lane D P, et al. Triacylglycerol accumulation and profiling in the model diatoms Thalassiosira pseudonana and Phaeodactylum tricornutum (Baccilariophyceae) during starvation[J]. Journal Applied Phycology,2009, 21(6): 669-681.
[14]周文俊,郑立,韩笑天,等.基于尼罗红染色分析金藻总脂动态积累[J].水生生物学报,2014,38(2):312-319.
[15]杨勋,刘平怀,郝宗娣,等.富油微藻Monoraphidium sp.的分离及其油脂提取工艺研究[J].安徽农业科学,2011,39( 32) :19988-19990.
[16]胡小文,马帅,弓淑芬,等.荧光光谱检测微藻中油脂[J].中国油脂,2011,36(4):70-73.
[17]王海英,符茹,黄宝祥.基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J].中国油脂,2012.37(3):78-81.
[18]Luisa Gouveia, Ana Cristina Oliveira. Microalgae as a raw material for biofuels production[J].Ind Microbiol Biotechnol, 2009, 36(2): 269–274.
[19]王金娜,严小军,周成旭,等.产油微藻的筛选及中性脂动态积累过程的检测[J].生物物理学报,2010,26(6):472-480.
[20]万文文,岳燕燕,梁科鹏.两株地下海水微藻的分子鉴定及其油脂分析[J].海洋环境科学,2013,32(3):440-443.
[21]李秀波,徐旭东,孔任秋.五种微绿球藻产油和产多不饱和脂肪酸的研究[J].水生生物学报,2010,34(5):893-897.
[22]黄潇雅,陈锴,严小平.泔水油的薄层层析法快速鉴别研究[J].杭州化工,2013,43(3):19-26.
Study on Screening of Oleaginous Microalgae and Evaluation of Its Oil-producing Performance
WANG Yu-rong1,2,SHI Wen-jing2,TONG Ming-you2
(1. Liaoning Shihua University, Liaoning Fushun 113001, China;2. Fushun Research Institute of Petroleum and Petrochemicals , SINOPEC, Liaoning Fushun 113001, China)
In order to screen microalgae that has the potential of oil production,98 strains of microalgae were isolated and purified from the water samples which were collected from the natural water in parts of northeast region. According to the growth characteristics of microalgal cultures and Nile red staining,lipid production capacities of fourteen strains of microalgae were compared. The comprehensive evaluation method of oleaginous microalgae was established by measuring biomass,total lipid content and total lipid yield. The results show that the total lipid contents of ten microalgae are more than 30 percent. It’s concluded that the most potential for industrial application is Chlorella Sp Y1,whose total lipid content and lipid productivity are 47.87% and 72.47 mg / ( L·d) respectively.R1 has high content of Triglycerides for biodiesel production.
Biodiesel; Oleaginous microalgae; Biomass; Lipid productivity
TK 6;S 216.2
: A
: 1671-0460(2015)04-0680-04
中国石化集团微藻生物柴油成套技术开发,项目号:210080
2015-02-16
王玉荣(1989-),女,内蒙人,硕士研究生,从事微藻生物资源研究。E-mail:qimuge1989@163.com。
师文静(1980-),女,陕西渭南人,从事生物质能源研究。E-mail:shiwenjing @163.com。

