桃金娘组织培养初步研究
王尚显,杨光穗,曾 淇,陈金花
(1.中国热带农业科学院热带作物品种资源研究所,海南省热带观赏植物种质创新利用工程技术研究中心,农业部华南作物基因资源与种质创制重点开放实验室,海南儋州571737;2.海南大学科技应用技术学院,海南儋州571737;3.海南省农业学校,海南海口571100)
桃金娘组织培养初步研究
王尚显1,2,杨光穗1,曾 淇3,陈金花1
(1.中国热带农业科学院热带作物品种资源研究所,海南省热带观赏植物种质创新利用工程技术研究中心,农业部华南作物基因资源与种质创制重点开放实验室,海南儋州571737;2.海南大学科技应用技术学院,海南儋州571737;3.海南省农业学校,海南海口571100)
以桃金娘茎段、叶片、种子为外植体,研究0.1%H g C l2和2%N aC l O单独消毒和组合消毒的消毒效果,探索出适合不同外植体消毒的有效方法和时间;并对最佳的诱导培养基和无菌系建立途径进行筛选。实验结果表明,组合消毒和消毒效率明显优于单一消毒剂消毒,其中单一消毒剂消毒时0.1%H g C l2的消毒效果又比2%N aC l O好;桃金娘茎段、嫩叶、老叶、果实的最佳消毒方式分别为:2%N aC l O浸泡10Mi n+0.1 %H g C l2浸泡8Mi n、2%N aC l O浸泡10Mi n+0.1%H g C l2浸泡6Mi n、0.1%H g C l2浸泡10Mi n+2%N aC l O浸泡8Mi n、0.1%H g C l2浸泡16Mi n。嫩叶较老叶和茎段更易诱导出愈伤组织,最佳的诱导培养基为2号培养基,愈伤组织诱导率达77.7%。无菌播种是桃金娘无菌系建立的最佳方式,萌发率高达75.0%。
桃金娘;组织培养;消毒
桃金娘(Rhodomyrtus tomentosa)是桃金娘科桃金娘属植物,因其花色美丽、花期长,果实营养丰富,根又可入药,是一种优良的园林观花灌木和治疗风湿骨痛的药材[1-2]。目前针对桃金娘的研究主要集中在药用价值分析、加工利用、生态特性等方面,繁殖方法方面的研究少见报道,且仅限于播种繁殖和扦插繁殖。据现有报道,桃金娘扦插繁殖率极低,仅有5%左右,播种萌发率也仅有30%~40%[3-4]。目前桃金娘的利用主要依赖采集野生资源,而当前的繁殖手段无法满足人类对其的需求,因此开展桃金娘快速繁育技术研究具有重要意义。
经过近一个多世纪的发展,组织培养技术已经成为一种成熟的繁殖手段,并应用在蝴蝶兰、红掌、龙血树、竹芋等热带花卉的组织培养中。然而由于植物体的差异性,组培繁殖技术也存在一定的差异。特别在热带木本花卉的组培过程中常存在污染率和褐化率高,诱导率低的共性。为寻找一个桃金娘无菌体系建立的有效途径,本研究以茎段、叶片、种子为外植体,研究不同消毒时间的消毒效果,并筛选出有效的诱导培养基,以期建立桃金娘无菌系,并为桃金娘繁育体系增加新的途径,为桃金娘快速繁殖提供新的参考和依据。
1 材料与方法
1.1 试验材料
为桃金娘茎段(顶芽下2~4节)、叶(嫩叶和老叶)、种子(5分熟、8分熟和全熟),取自中国热带农业科学院热带作物品种资源研究所种质资源圃。
1.2 实验方法
1.2.1 消毒方法 采取新鲜桃金娘的茎段(顶芽下2~4节)、叶片(嫩叶和老叶,下同)和种子(5分熟、8分熟和全熟,下同),用洗衣粉在自来水下清洗,转至无菌工作台用75%的酒精消毒2~3 s后,在用2%的次氯酸钠(NaCl2O)、0.1%的生汞(HgCl2)中分别或依次进行消毒。消毒方法见表1。

表1不同外置体的消毒方法 (Min)
1.2.2 培养基的配制 启动培养基为添加不同浓度2,4-D、NAA、6-BA的MS培养基,见表2,附加蔗糖20 g/L、卡拉胶8 g/L,Ph值5.8。培养室温度控制在25±2℃,光强3 000 lux,每天光照12 h。
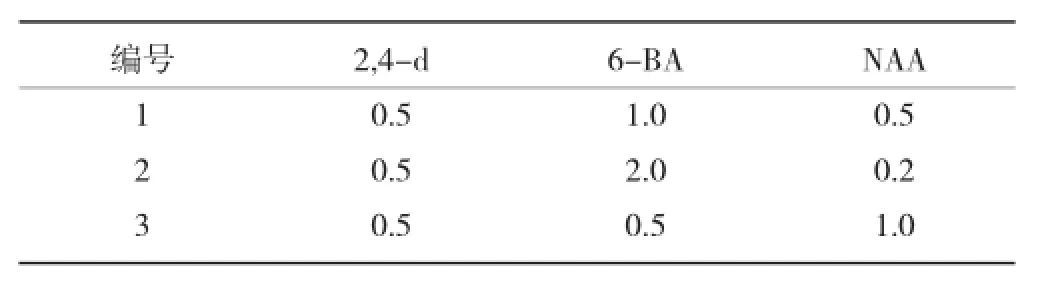
表2培养基激素配方(mg/L)
1.4 数据统计
污染率=污染外植体数/接种外植体数×100%。
褐化死亡率=褐化死亡外植体数/接种外植体数×100%。
诱导存活率=诱导存活外植体数/接种外植体数×100%。
2 结果与分析
2.1 不同消毒方法对茎段的消毒效果
不同消毒剂对茎段的消毒效率不同。在相同的消毒时间下,0.1%HgCl2的消毒效率明显高于2%NaClO,但HgCl2对外植体的毒害作用也比较大,随着消毒时间的延长,褐化死亡率明显增加。可见,如果单独使用0.1%HgCl2的消毒时间不宜超过20Min。从实验结果看,组合消毒的消毒效率明显优于单一消毒剂消毒,其中最佳的消毒组合为2%NaClO浸泡10Min后再用0.1%HgCl2浸泡8Min,诱导存活率可达到44.4%(见图1)。由于茎段表面有许多绒毛,加之茎段上腋芽部分不易消毒,所以茎段的平均污染率都比较高。
2.2 不同消毒方法对叶片的消毒效果

图1 不同消毒方法对茎段消毒效率的影响(处理1:2%N aC l2O浸泡20Mi n;处理2:2%N aC l2O浸泡25Mi n;处理3:2% N aC l2O浸泡30Mi n;处理4:0.1%H g C l2浸泡20Mi n;处理5:0.1%H g C l2浸泡25Mi n;处理6:0.1%H g C l2浸泡30Mi n;处理7:2%N aC l2O浸泡10Mi n后再用0.1%H g C l2浸泡6Mi n;处理8:2%N aC l2O浸泡10Mi n后再用0.1%H g C l2浸泡8Mi n;处理9:2%N aC l2O浸泡10Mi n后再用0.1%H g C l2浸泡10Mi n。)
从图2可知,嫩叶和老叶的组合消毒方法也明显优于单一消毒的方法,随着消毒时间的延长,褐化死亡率总体呈现逐步升高的趋势,这是由于消毒剂的毒害作用所致。由于嫩叶携带的微生物较老叶的少、单宁等物质的含量较低,在相同的消毒方法和时间下,嫩叶的污染率和褐化率都比老叶的低,而诱导成活率都比老叶的高。嫩叶最佳消毒方法:2%NaClO浸泡10Min后再用0.1%HgCl2浸泡6Min;老叶最佳消毒方法为:2%NaClO浸泡10Min后再用0.1%HgCl2浸泡8Min。嫩叶比老叶更适合作为桃金娘组织培养的外植体材料。
2.3 不同浸泡方法对种子的浸泡效果
由于果实的果肉较厚,不同浸泡方法和时间对种子的浸泡效果无明显差异,污染率均为0%,可选择0.1%HgCl2浸泡16Min作为最佳的浸泡方法和时间。
2.4 不同培养基的诱导效果
2.2.1 茎段 1~3号培养基均不利于茎段从芽到芽的诱导。茎段培养18~20 d后即可观察到白色致密的愈伤组织产生。其中2号培养基的愈伤组织的诱导时间最短,诱导率也最高,达41.3%;其次是3号培养基的诱导率为38.8%;1号培养基的诱导率最低,为27.7%(见图3)。
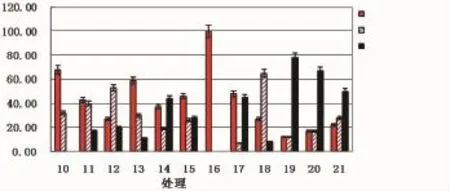
图2 不同消毒方法对叶片消毒效率的影响(处理10:老叶用0.1%H g C l2浸泡16Mi n;处理11:老叶用0.1%H g C l2浸泡20 Mi n;处理12:老叶用0.1%H g C l2浸泡24Mi n;处理13:老叶用2%N aC l O浸泡10 Mi n后0.1%H g C l2浸泡6Mi n;处理14:老叶用2%N aC l O浸泡10Mi n后0.1% H g C l2浸泡8Mi n;处理15:老叶用2%N aC l O浸泡10Mi n后0.1%H g C l2浸泡10 Mi n;处理16:嫩叶用0.1%H g C l2浸泡16Mi n;处理17:嫩叶用0.1%H g C l2浸泡20Mi n;处理18:嫩叶用0.1%H g C l2浸泡24Mi n;处理19:嫩叶用2%N aC l O浸泡10Mi n后0.1%H g C l2浸泡6Mi n;处理20:嫩叶用2%N aC l O浸泡10Mi n后0.1% H g C l2浸泡8Mi n;处理21:嫩叶用2%N aC l O浸泡10Mi n后0.1%H g C l2浸泡10Mi n)

图3 茎段诱导出的愈伤组织
2.2.2 叶片 叶片诱导愈伤组织的时间短于茎段,培养15 d后即可观察到愈伤组织的产生。从实验结果看,以幼嫩的叶片在2号培养基中的诱导率最高,达77.7%(图4);其次是幼嫩叶片在1号培养基中的诱导效果,为66.6%;诱导率最低的是老叶在1号培养基中的诱导率,仅为11.1%。嫩叶在3种培养基中的诱导率均高于老叶;嫩叶和老叶在2号培养基中的诱导率均高于其他。
2.2.3 种子 种子播种后30 d开始萌发,没有明显的萌发高峰。不同培养基的诱导效果区别较大,成熟种子在1号培养基中的萌发率最高,为75%;其次是播种2号培养基中的5分熟的种子,而8分熟的种子总体萌发率都不高。种子萌发后发现在3号培养基中的植株生长较其他培养基中健壮(见表3、图5)。

图4 嫩叶诱导出的愈伤组织

表3 不同培养基条件下不同外植体的诱导率和萌发率 (%)
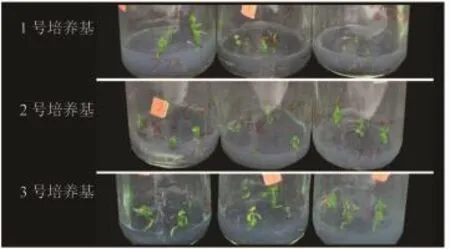
图5 不同培养基条件下种子的萌发情况
3 讨论
3.1 预处理和浸泡方法是无菌系建立的关键
植物组织培养过程中,无菌体系的建立是组织培养的关键,而采自大田的实验材料极易粘附细菌和真菌等,建立无菌体系时不易浸泡,因此,必须根据材料幼嫩程度、材料类型等来决定浸泡方式和浸泡时间[5]。桃金娘属热带植物,内生菌十分丰富,加之常年高温多雨,空气湿度大,在茎叶表面滋生大量的微生物,并附着大量的霉菌袍子和细菌芽饱,甚至一些菌丝体浸入表皮内的薄壁组织形成大量的内生菌,给外植体浸泡造成很大的困难[6]。桃金娘叶片和茎段的表面有许多绒毛,为外植体的浸泡增加了困难。
针对浸泡困难的外植体,单独使用一种浸泡剂浸泡其污染率比较高,达不到理想的浸泡效果,而多种浸泡剂的配合使用已经在多种植物外植体的浸泡实验中获得成功。如:姚娜和赖志强[7]研究象草腋芽的外植体浸泡中发现其最佳浸泡措施为:自来水冲洗60Min+0.1%HgCl2浸泡25Min+2%NaClO浸泡20Min,该措施的污染率极低而且成活率最高。韩佳宇等[8]对石栗树腋芽外植体浸泡研究表明最佳浸泡组合为:自来水冲洗120Min+0.1%HgCl2浸泡16Min+2%NaClO浸泡24Min,其组合的污染率最低达到了16.67%,而且愈伤组织诱导成功率最高达到了80.00%。陶兴魁等[9]在研究蓝莓外植体浸泡方法时发现用70%酒精30 s+2%NaClO浸泡10Min+0.1%HgCl2浸泡10Min的组合效果最好,其污染率最低,成活率最高。在本实验中,采用了组合浸泡的方法在一定程度上提高了浸泡效率,降低污染率,茎段组合浸泡的存活率将单一0.1%HgCl2浸泡的9.2%提高到44.0%,即2%NaClO浸泡10Min后再用0.1%HgCl2浸泡8Min的组合浸泡方式。叶片组合浸泡即2%NaClO浸泡10Min后再用0.1%HgCl2浸泡 6 Min的存活率将单一 0.1% HgCl2浸泡最高的45.4%提高到77.7%。
除了通过组合浸泡的方式提高浸泡效率外,还可以通过选择晴天采样、采样前移至室内培养或喷洒农药、预处理时用农药浸泡、培养基中添加抑菌剂等方式来提高浸泡效率。
3.2 无菌系建立的途径
植株再生有器官发生型和体细胞胚胎发生型两个途径。不同植物种类诱导形成愈伤组织的敏感性和难易程度不同。外植体、培养基种类、激素配比、培养条件均会影响愈伤组织的诱导情况,常规来说,幼嫩的材料比成熟的材料更易进行愈伤组织诱导及其形态建成;同种的不同基因型个体在愈伤组织的诱导及其再生能力上又有差别;分生细胞和薄壁细胞较易诱导出愈伤[10]。本实验中,叶片更比茎段容易诱导出愈伤组织。
如果采用无菌播种的方式,最佳的萌发率可达83%,极大地提高了种子萌发率,显著高于直接田间播种30%~40%的萌发率[4]。未来可借鉴此种方法开展种子敞开式培养,即可提高萌发率又可打破无菌培养条件的局限性。相比叶片诱导愈伤组织途径,无菌播种更具有无须经脱分化步骤,更易更快速地建立无菌系的优点。
3.3 愈伤组织褐化的防止方法
当外植体组织被切割和接种时,受到损伤的细胞中酚类物质会被酚氧化酶氧化成有毒的醌类物质,这些物质扩散到培养基中抑制了其他酶活性,以至毒害整个外植体组织,组织变褐甚至死亡。研究者发现,影响组织褐化的因素有基因型、外植体的生理状态、外植体种类和大小、培养基、防褐剂的使用和培养条件等[11-12]。一般来说褐变会随着材料的年龄和组织木质化程度而增加;外植体越小,而切面与体积的比率越大,褐化程度越大;在有些植物中胚培养比叶片培养褐变少、茎尖比茎段褐变少等;培养基中高浓度糖、高含量氨态氮、低水平pH值等都会不同程度地增加褐化;强光照和高温也会对褐化强度产生影响[11,13]。在黄金蒲桃的组织培养研究中,研究者发现培养基最适的pH值为6.0,冬季取材较夏季和春季取材好,WPM和Anderson培养基对芽诱导的影响差异不大,茎段的取材部位优于顶芽[14]。研究者认为夏季取材时光照充足、温度高,植物体内的酚类酶活性也较高,故污染率和褐化率都较高。根据前人的研究经验,在后续的实验中可使用低盐、低糖培养基,并加入PVP、Vc等防褐剂,来减少外植体的褐化程度。
[1]陈火君,江晓燕.桃金娘开发应用研究进展[J].广东农业科学,2007,(3):109-111.
[2]赵志刚,程伟,郭俊杰.桃金娘的资源利用与人工培育[J].广西林业科学,2006,35(2)∶70-72.
[3]杨治国.桃金娘扦插繁殖试验初报[J].江西林业科技.2005,(2):21-22.
[4]刘连海,代色平,贺漫媚.桃金娘繁殖与栽培技术初探[J].广东林业科技,2013,29(2)∶49-52.
[5] Leifert C., Morris C. E., and Waitesc W.M.. Ecology of microbial saprophytes and pathogensin tissue culture and field-grown plants∶Reasons for contamination problems in vitro[J]. Critical Reviews in Plant Sciences. 1994,13(2)∶139-183.
[6]陈少珍,卜朝阳,闭志强,等.兰花组织培养中常见问题及解决方法[J].广西农业科学,2006,37(1)∶72-74.
[7] 姚娜,赖志强.象草腋芽外植体浸泡方法的筛选[J].基金组学与应用生物学,2010,29(5)∶943-946.
[8] 韩佳宇,欧克纬,禤维言,等.石栗树腋芽外植体浸泡方法的筛选[J].南方农业学报,2012,43(8)∶1169-1172.
[9] 陶兴魁,高贵珍,赵 亮,等.几种方法对蓝莓外植体浸泡的比较研究[J].淮北师范大学学报(自然科学版),2013,34(2)∶39-41.
[10]郑成木,刘进平.热带亚热带植物微繁殖[M].长沙:湖南科学技术出版社,2001.13-39.
[11]周俊辉,周加绒,曾浩森,等.园艺植物组织培养中的褐化现象及抗褐化研究进展[J].园艺学报,2000,27(增刊)∶481-486.
[12]赫英超,罗 磊,刘云宏,等.酶促褐变中酚类化合物代谢机理研究进展.农产品加工(学刊),2013,316(5)∶55-58,66.
[13] Pindal A, Miczynski K. Regeneration of Cymbidium orchids from leaf and root explants[J]. Floria Horticulture, 1996,8(2)∶ 95-105.
[14]莫健斌,陈文燕,马 斌,等.黄金蒲桃组织培养初步研究[J].江苏林业科技,2013,40(5)∶10-13,29.
(责任编辑:张焕裕)
Primary Study on Tissue Culture of RhodoMytrus toMentosa
WANG Shang-xian1,2,YANGGuang-sui1,ZENGQi3,CHEN Jin-hua1
(1.Tropical Crops Genetic Resoures Institute,Chinese Academy of Tropical Agricultural Sciences&The Engineering Technology Research Center of Tropical Ornamental PlantGermplasMInnovation and Utilization,Hainan Province&Key Laboratory of Corp Gene Resources and GermplasMEnhancement in Southern China,Technical college of HaiNan University,Danzhou 571737,PRC;2.Institution of Technology,Hainan University,Danzhou 571737,PRC;3.Hainan Agriculture School,Haikou 571100,PRC)
Using stem,leaf,seed of Rhodomytrus tomentosa asexplants,the paperanalyzed the disinfection effectof 0.1%HgCl2and 2% NaClO alone and in combination,explored the effective explants disinfectionmethod and time for Rhodomytrus tomentosa explants,and screened the optimal approach for inducedmedium.The research results showed that:the combination disinfection effectwas better than alone disinfection,and that of 0.1%HgCl2better than 2%NaClO;the best disinfection method for stem,tender leaf,old leaf,fruit of Rhodomytrus tomentosa was 2%NaClO immersed 10 Min+0.1%HgCl2immersed 8 min,2%NaClO immersed 10 min+0.1%HgCl2immersed 6min,2%NaClO immersed 10min+0.1%HgCl2immersed 8Min,0.1%HgCl2immersed 16Min respectively.Tender leaf is more easily induced callus than old leaf and stem.The best inductionmediuMis no.2media.Young leaves of callus induction rate was 77.7%.Sowingunderaseptic condition is thebestway to clone Rhodomytrus tomentosa,and thegermination rate isashigh as75.0%.
Rhodomytrus tomentosa;tissue culture;disinfection
S723.132
A
1006-060X(2015)04-0074-04
10.16498/j.cnki.hnnykx.2015.04.024
2015-03-19
海南省重大科技项目(ZDZ X2013012);海南省星火产业带项目(H N X H201427);海南省重点科技计划项目(ZD X M201 20025)
王尚显(1992-),男,海南临高县人,研究实习员,研究方向为观赏园艺。
陈金花

