兔眼玻璃体切除联合C3F8填充术后晶状体氧化损伤的研究
杨艳芳,贾松柏,唐罗生
兔眼玻璃体切除联合C3F8填充术后晶状体氧化损伤的研究
杨艳芳1,贾松柏2,唐罗生2
作者单位:1(400041)中国重庆市,重庆新视界眼科医院;2(410011)中国湖南省长沙市,中南大学湘雅二医院眼科
目的:通过对术后不同时期晶状体内总超氧化物歧化酶(T-superoxide dismatase,T-SOD)及丙二醛(malondialdehyde,MDA)含量的检测,以探讨兔眼玻璃体切除联合非膨胀浓度全氟丙烷(C3F8)填充术后早期晶状体的损伤改变是否与氧化损伤有关。
玻璃体切除术;全氟丙烷;白内障;氧化损伤
引用:杨艳芳,贾松柏,唐罗生.兔眼玻璃体切除联合C3F8填充术后晶状体氧化损伤的研究.国际眼科杂志2015;15(11): 1873-1876
0 引言
玻璃体切除联合全氟丙烷(perfluoropropane,C3F8)气体填充术目前已成为治疗玻璃体视网膜疾病的常用手术方法之一,但该术术后最常见的并发症之一就是白内障[1]。临床观察发现[2],玻璃体切割联合C3F8气体填充术后白内障的发生分为两种情况:(1)术后早期一过性白内障;(2)术后晚期核性与后囊下性白内障。我们在先期的研究中通过对兔眼的实验发现C3F8所引起的术后早期白内障虽为一过性的,但可引起晶状体上皮细胞结构的永久性损害,但关于其具体的损伤机制尚不明确。
表1 各组术后不同时期晶状体组织中T-SOD活力的检测结果(±s,U/mgprot)
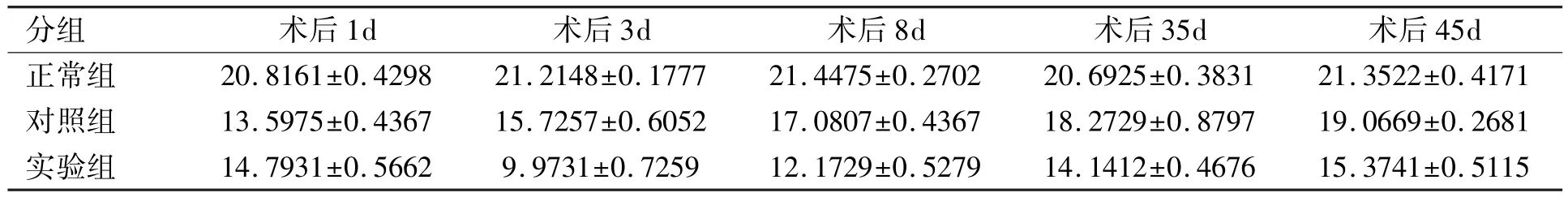
表1 各组术后不同时期晶状体组织中T-SOD活力的检测结果(±s,U/mgprot)
分组术后1d术后3d术后8d术后35d术后45d正常组20.8161±0.4298 21.2148±0.1777 21.4475±0.2702 20.6925±0.3831 21.3522±0.4171对照组13.5975±0.4367 15.7257±0.6052 17.0807±0.4367 18.2729±0.8797 19.0669±0.2681实验组14.7931±0.5662 9.9731±0.7259 12.1729±0.5279 14.1412±0.4676 15.3741±0.5115
目前,虽然白内障的确切病因及发病机制尚未完全阐明,但大多数研究[3-5]普遍认为引起白内障的病理机制主要是氧化损伤机制。因此,本研究试图通过对晶状体内总超氧化物岐化酶(T-superoxide dismatase,T-SOD)活力及丙二醛(malondialdehyde,MDA)含量的检测,以讨论玻璃体切割联合非膨胀浓度C3F8填充术后早期兔眼晶状体的损伤改变是否与氧化损伤有关。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组健康成年新西兰白兔45只90眼,雌雄不拘,体质量2.0~2.8(平均2.4±0.35)kg。散瞳后裂隙灯及直接检眼镜下观察无眼疾为入选对象。用随机数字表法将45只兔随机分组:正常组15只30眼;对照组30只兔的右眼30眼,行单纯玻璃体切除BSS液填充术;实验组30只兔的左眼30眼,行玻璃体切除联合非膨胀浓度C3F8填充术。
1.1.2 主要试剂超氧化物岐化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒、考马斯亮兰蛋白测定试剂盒(均由南京建成生物工程研究所提供)。
1.2 方法
1.2.1 动物模型制作随机取30只兔的左眼为实验组、右眼为对照组,均做玻璃体切除术。术前所有眼用0.3% FPA清洁结膜囊,复方托吡卡胺充分散瞳。手术基本步骤:30g/L戊巴比妥钠注射液(1mL/kg)静脉麻醉,10g/L丁卡因表面麻醉。距角膜缘约2.5~3mm处在颞上、鼻上及颞下行巩膜切口,分别置入切割头、光纤和灌注头,角膜上放置平凹型接触镜,在手术显微镜下行前中部玻璃体切除。术中注意避免手术器械碰伤晶状体和视网膜。玻璃体切除结束后对照组直接关闭各个穿刺口;实验组行气液交换(25mmHg)后关闭各个穿刺口,并从颞侧角巩膜缘后2.5~3.0mm穿刺,注入纯的C3F8约0.5~0.8mL(在眼内形成15%~20%的非膨胀浓度)。术后0.3%FPA滴眼液,4次/d,持续7d;复方托吡卡胺散瞳,2次/d,持续7d。
1.2.2 组织匀浆的制备于术后1、3、8、35、45d,正常组随机抽取3只兔(6眼),对照组和实验组随机抽取6只兔(每组各6眼)。以空气栓塞法处死,取出晶状体,滤纸吸干后称重,用试管量取pH=7.2的PBS液,体积总量是组织块重量的9倍。将量取的PBS液和晶状体一起倒入玻璃匀浆管中进行匀浆。将制备好的10%匀浆用低温离心机1000r/min,离心5min,取上清液测定各晶状体的TSOD活力和MDA含量。
1.2.3 总超氧化物岐化酶活力的测定(黄嘌呤氧化酶法)
取晶状体匀浆液0.03mL,与各试剂充分混匀,置37℃恒温箱中水浴40min,与2mL显色剂混匀,10min后倒入1cm光径比色杯中,蒸馏水调零,波长550nm处比色计算SOD活性高低。SOD=(对照管吸光度-测定管吸光度)÷对照管吸光度÷0.5×样品稀释倍数÷组织中蛋白含量,单位:U/mgprot。

表2 各组术后不同时期晶状体组织中T-SOD活力的比较
1.2.4 丙二醛含量的测定(巴比妥酸反应比色法)取晶状体匀浆液0.1mL,与各试剂充分混匀,95℃恒温箱中水浴40min,冷却至室温,离心10min,3500~4000r/min,蒸馏水调零,波长532nm处比色计算MDA含量。MDA=测定管(样品溶液)的吸光度÷对照管(标准溶液)×10÷组织中蛋白含量,单位:nmol/mgprot。
1.2.5 考马斯亮兰蛋白测定取晶状体匀浆液0.05mL,与各试剂充分混匀,静置10min,蒸馏水调零,波长595nm处比色计算组织蛋白含量。蛋白含量=(测定管吸光度-空白管吸光度)÷(标准管吸光度-空白管吸光度)×标准管浓度,单位:g/L。
统计学分析:所有数据建立数据库并采用SPSS 13.0软件进行方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组术后不同时期晶状体组织中T-SOD活力的比较各组术后不同时期晶状体组织中T-SOD活力见表1,经过统计学分析,结果显示:正常组T-SOD值最高,实验组最低,三组不同时期两两相互比较均有显著统计学差异(P<0.01,表2)。对照组的T-SOD值在术后第1d为最低,之后逐渐恢复。而实验组的T-SOD值于术后第1d开始下降,术后第3d降到最低,之后缓慢恢复(图1)。
2.2 各组术后不同时期晶状体组织中MDA含量的比较
各组术后不同时期晶状体组织的MDA含量见表3,经统计学分析,结果显示:正常组MDA含量最低,实验组最高,三组不同时期两两相互比较(表4),除术后第1d实验组与对照组比较无显著统计学差异外,其余各组两两相互比较均有显著统计学差异(P<0.01)。对照组的MDA值在术后第1d为最高,之后逐渐恢复。而实验组的MDA值于术后开始升高,于术后第3d达到高峰,之后缓慢恢复(图2)。
表3 各组术后不同时期晶状体组织中MDA含量的检测(±s,nmol/mgprot)

表3 各组术后不同时期晶状体组织中MDA含量的检测(±s,nmol/mgprot)
分组术后1d术后3d术后8d术后35d术后45d正常组0.7774±0.1093 0.7216±0.0876 0.7509±0.12180.7337±0.0719 0.7121±0.1551对照组1.9881±0.3288 1.5504±0.2999 1.2707±0.1708 1.0931±0.1468 0.9282±0.1758实验组2.0742±0.2449 3.3706±0.3849 2.5461±0.37392.0381±0.2463 1.6517±0.2607

图1 各组不同时间T-SOD活力变化图。
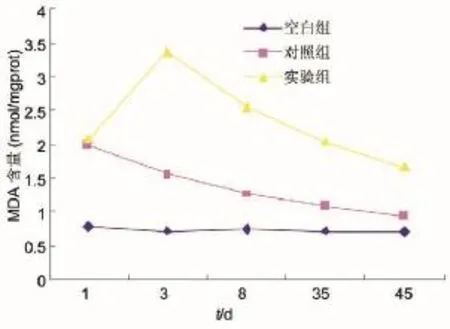
图2 各组不同时间MDA含量变化图。
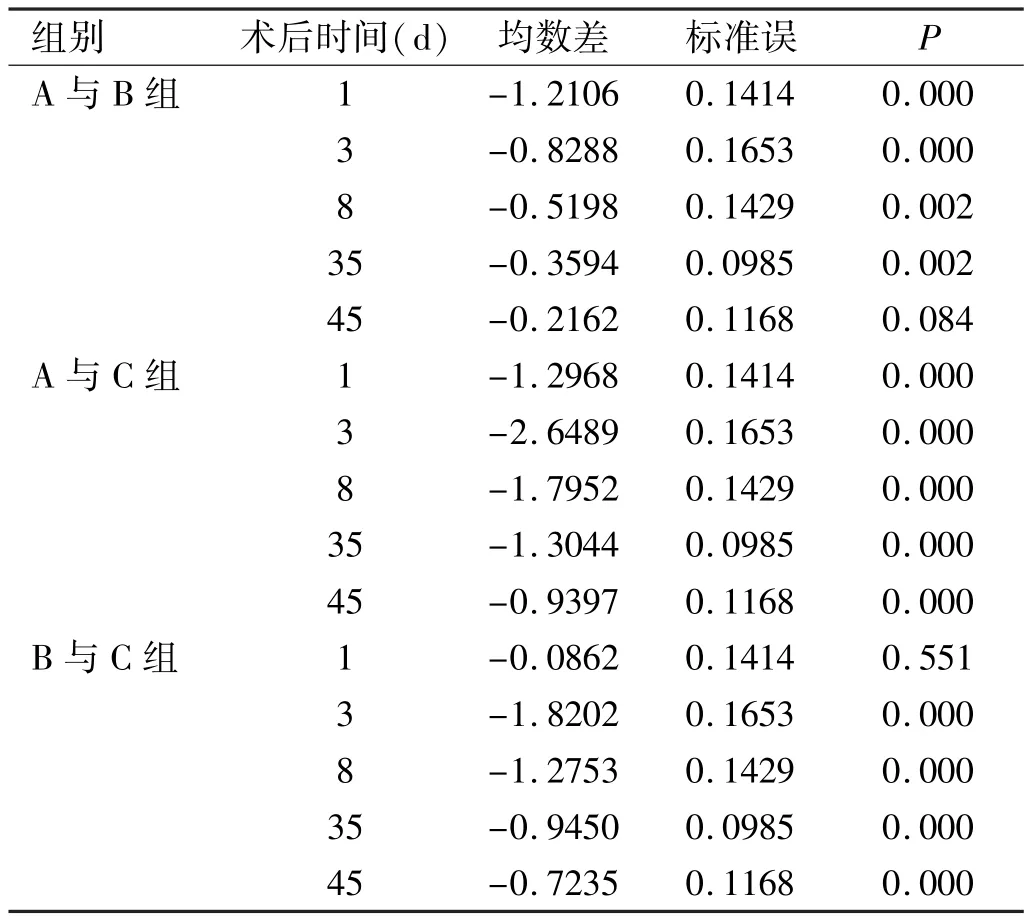
表4 各组术后不同时期晶状体组织中MDA含量的比较
3 讨论
自由基反应是机体正常生物代谢过程中必不可少的重要环节。在许多酶促反应和电子传递过程中,均有自由基及其中介产物生成。最初产生的自由基可与周围的生物分子反应生成其他自由基,形成一系列连锁反应,造成周围组织的损伤[6]。在晶状体正常的生理代谢中,也有自由基的不断产生,但能维持在正常生理范围之内。若代谢异常时,自由基生成剧增、堆积并损害周围组织。晶状体上皮细胞质膜中含有很多不饱和脂肪酸,易发生脂质过氧化反应形成脂质过氧化物,并在反应过程中形成多种自由基中间产物。而不稳定的脂质过氧化物最终产物为丙二醛(MDA)、二烯轭合物和气态的碳化氢[7]。其中的MDA可通过硫代巴比妥酸法(TBA法)检测出含量,反应晶状体内氧化损伤的程度[8]。
晶状体内的自由基在不断地产生,同时也不断地被清除。晶状体内存在着氧化-抗氧化系统,始终保持着平衡,从而保证在正常生理情况下,各种自由基的浓度维持在一个有利无害、生理性的低水平。晶状体内的抗氧化系统包括两类:一类是酶促防御系统,包括超氧化物岐化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-PX)、谷胱甘肽还原酶(GSH-R)等。另一类是非酶促反应防御系统,包括维生素E、A、C、辅酶Q、硒、巯基化合物(谷胱甘肽、半胱氨酸)等[6]。这其中SOD是一个极为重要的保护性酶,SOD属金属酶,按金属辅因子类型不同,可分为三种类型:Cu、Zn-SOD、Mn-SOD和Fe-SOD。在高等动物细胞内只有两种SOD,即Cu、Zn-SOD与Mn-SOD,二者相加等于总SOD(T-SOD)。可通过羟胺发色法检测得出SOD的活性,测定SOD的活性可以反应晶状体内抗氧化物质的水平[9]。晶状体内发生氧化损伤是两种因素共同发挥作用的结果,一方面自由基产生过多出现堆积,另一方面抗氧化功能下降。其具体损伤机制包括:(1)对阳离子泵的损伤,包括Na+-K+泵和Ca2+泵; (2)细胞膜及线粒体膜的脂质过氧化;(3)对功能蛋白和结构蛋白的损伤,包括蛋白质的聚合与降解;(4)晶状体上皮细胞DNA的损伤;(5)对糖分子的损害。此外,还有研究证实,活性氧可诱导C-fos、c-jun基因的过量表达以及TRX-1基因、TRX-1蛋白表达的上调和线粒体DNA (mtDNA)的氧化损伤。由此可见若上述任何一方面出现异常时势必会影响晶状体的代谢,导致透明性不能正常维持,引起白内障的形成[10]。
在玻璃体切除术中及术后均会产生各种因素影响晶状体生存的微环境,引起晶状体代谢异常、氧化-抗氧化平衡失常,从目前的研究结果来看主要包括以下几个方面:(1)血-眼屏障以及血-房水屏障的破坏:玻璃体切割术后血-眼屏障的破坏及血-房水屏障的破坏可导致房水中NO的迅速变化[11]。NO本身是自由基,可致细胞膜脂质过氧化、细胞核DNA断裂、细胞损伤和凋亡等改变。(2)光导纤维的光毒性作用:玻璃体切割手术过程中手术显微镜和光导纤维都会对晶状体产生光毒性作用[12-13],导致晶状体蛋白过氧化[2,14]而遭到损伤和产生自由基进一步损害晶状体内的各种成分。(3)晶状体低氧环境的改变:梁建宏等[15]和Holekamp等[16]利用光纤测氧仪在活体上测量兔眼玻璃体和晶状体的氧分压分布,分析得出,玻璃体对晶状体维持低氧水平至关重要。玻璃体切割术对晶状体氧分压的影响主要体现在两个方面:首先是手术中眼内灌注液会引起晶状体氧分压升高。即使手术时间很短,让晶状体完全暴露于灌注液中也会引起晶状体氧水平显著升高。另外玻璃体切除术后玻璃体腔最终被房水所填充,使晶状体维持低氧水平的机制被破坏。(4)抗氧化物质的减少:抗坏血酸在玻璃体内及房水的含量与血浆中的含量之比为9∶1,在玻璃体手术中使用的BSSplus被认为是一种较理想的、常用的眼内填充物,但其中不含有抗坏血酸成分。玻璃体切割术后,由于玻璃体大部分被切割掉,且使用不含抗坏血酸的BSSplus填充玻璃体腔,使得内源性抗坏血酸含量突然减少。随着房水的生成与更新,才使得内源性抗坏血酸逐渐得以恢复。从张晓梅等[17]的结果显示,玻璃体切割手术后早期玻璃体内源性抗坏血酸的含量降低可能引起眼内抗氧化能力的减弱。上述这些因素均会影响到晶状体内氧化-抗氧化的平衡。
关于玻璃体切除联合C3F8气体填充术对晶状体的影响目前国内尚未见有动物实验研究报道。但有临床研究报道[18]局部应用抗白内障药物卡林-U(吡诺克辛)可明显减轻玻璃体切割术后眼内注气所致晶状体后囊下混浊的程度,缩短混浊持续时间。吡诺克辛是许多抗白内障药物的主要成份,它有对抗自由基对晶状体损害的作用。由此也可见,玻璃体切割联合非膨胀浓度C3F8填充术后早期白内障的形成可能也与氧化损伤有关。
从表1和表2中我们可以看出对照组和实验组都存在氧化-抗氧化的失调。从图1及图2中可见各组TSOD的总体水平为:正常组>对照组>实验组,MDA的总体水平为正常组<对照组<实验组。对照组氧化损伤指标的改变在术后第1d最明显,至术后第8d这种差异开始明显缩小。这可能是由于上述原因使单纯玻璃体切除术后早期存在氧化-抗氧化体系的失衡,但很快随着术后炎症的减轻,血-眼屏障、血-房水屏障的逐渐恢复、房水的更新以及抗氧化系统的代偿,使得晶状体内产生的过多自由基逐渐得到清除,氧化-抗氧化平衡也逐渐得以恢复。而实验组氧化损伤指标的差异在术后第1d开始出现,至术后第3d达到高峰(这与气体在玻璃体体内的变化趋势相吻合),之后开始恢复,但恢复的速度明显较慢,至术后第45d时仍存在较明显的差异。这一结果充分说明C3F8在眼内对晶状体代谢产生了额外的氧化损伤的影响,这可能与C3F8和晶状体后囊的直接接触影响了晶状体与房水正常的物质交换,引起物质代谢障碍有关。在前面我们也提到在晶状体正常的生理代谢中,就有自由基的不断产生,但能维持在正常生理范围之内。若代谢异常时,自由基生成会剧增、堆积并损害周围组织。因此,我们推测可能是因为C3F8与晶状体后囊大面积的直接接触引起晶状体代谢异常,导致自由基生成剧增,再加之玻璃体切除本身引起的氧化-抗氧化失衡,使得实验组氧化损伤指标的差异高于对照组,且持续的时间也长于对照组,从而引起白内障的形成。虽然对照组的T-SOD活力和MDA含量与正常组比较也存在显著统计学差异(P<0.01),但可能由于这种差异持续的时间短,以及氧化-抗氧化失衡的程度小,所以还不足以引起晶状体的损伤。因此,我们认为实验组晶状体的早期混浊和早期显微结构的改变都可能与此相关,当然除了氧化损伤之外是否还存在其它的损伤机制还有待于进一步的研究阐明。
由上可知,玻璃体切除联合非膨胀浓度C3F8填充术后早期白内障的形成可能与氧化-抗氧化失调有关,这为此型白内障的防治提供了理论依据。
1 Wolfensberger TJ,Gonvers M.Very long-term follow-up of retnal detachment due to macular hole treated with vitrectomy and air injection.Retina2001;21(6):678-681
2 Cheng L,Azen SP,El-Bradey MH,et al.Duration of vitrectomy and postoperative catatract in the vitrectomy for macular hole study.Am JOphthalmol 2001;132(6):881-887
3李德馨,王思玲,苏德森.白内障的发病机制与药物治疗.沈阳药科大学学报2002;19(4):300-307
4唐建,刘谊.白内障发病机制的分子学研究进展.眼科新进展2003; 23(1):52-55
5陈莺,陈大本.白内障发病机制及预防治疗的研究进展.眼科新进展2005;25(2):190-193
6陈瑗,周玫.自由基医学.北京:人民军医出版社1991:13-28
7李根林.Maillard反应与白内障.国外医学眼科学分册1993;17(5): 284-287
8徐度.自由基生物学与眼组织损伤的病理机理.国外医学眼科学分册1987;11(1):1-6
9吴先诚.超氧化物歧化酶与眼病.国外医学眼科学分册1990;14 (3):139
10 Dische Z,Zil H.Studies on the oxidation of cysteine to cystine in lens proteins during cataract formation.Am J Opthalmol 1951;34(5:2):104-113
11 Jurowskl P,Gos R,Piasecka G.Nitric oxide levels in aqueous humor after lens extraction and poly(methyl methacrylate)and foldable acrylic intraocular lens implantation in rabbit eyes.J Cataract Refract Surg 2002;28(12):2188-2192
12 de Bustros S,Thompson JT,Michels RG,et al.Nuclear sclerosis after vitrectomy for idiopathic epiretinal membranes.Am J Ophthalmol 1988;105(2):160-164
13 Cherfan GM,Michels RG,de Bustros S,et al.Nuclear sclerotic cataract after vitrectomy for idiopathic epiretinal membranes causing macular pucker.Am J Ophthalmol 1991;111(4):434-438
14 Thompson JT,Glaser BM,Sjaarda RN.Progression of nuclear sclerosis and long-term visual results of vitrectomy with transforming growth factor beta-2 for macular holes.Am J Ophthalmol1995;119(1): 48-54
15梁建宏,郑雷,Irene Barbazetto,等.玻璃体切割术对晶状体氧分压的影响.眼科学报2002;18(2):67-70
16 Holekamp NM,Shui YB,Beebe DC.Vitrectomy surgery increase oxygen exposure to the lens:A possible mechanism for nuclear cataract formation.Am J Ophthalmol2005;139(2):302-310
17张晓梅,刘平,崔浩,等.兔眼玻璃体切割术后玻璃体内抗坏血酸的动态观察.中华眼底病杂志2005;21(2):128-129
18朱晓华,姜德咏,龚凌.抗白内障药物在玻璃体切割术后早期的临床应用.临床眼科杂志2003;11(2):107-109
Research of T-SOD and MDA in rabbit lens at the early period after vitrectomy combined with nonexpansile perfluoropropane gas
Yan-Fang Yang1,Song-Bo Jia2,Luo-Sheng Tang2
1Chongqing Xinshijie Eye Hospital,Chongqing 400041, China;2Department of Ophthalmology,the Second Xiangya Hospital of Central South University,Changsha 410011,Hunan Province, China
Song-Bo Jia.Department of Ophthalmology, the Second Xiangya Hospital of Central South University,Changsha 410011,Hunan Province,China.yxmjpr@yahoo.com
·AIM:To study the relationship between oxidative dam age and the early pathological changes in rabbit lens after vitrectomy combined with nonexpansile perfluoropropane gas,by detecting T-SOD activity and MDA content at different stages after the operation.·METHODS:Fourty five healthy new zealand rabbits were divided randomly to three groups:normal group, control group and experimental group.The control group was just perform edvitrectomy with BSS;the experimental group was performed vitrectomy combined with nonexpansile perfluoropropane gas.The lens were made into tissue homogenates to detect T-SOD activity and MDA content by using spectrophotometry on the 1st,3th,8th,35th and 45th day after the operation.·RESULTS:T-SOD activity:that in normal group was the hightest,that in experimental group was the lowest, and there was significant difference(P<0.01)among three groups in every periods after operation.MDA con tent:that in normal group was the low est,that in experimental group was the high test,and there was significant difference(P<0.01)am ong three groups after the operation except the 1st day.·CONCLUSION:Oxidative damage mechanism may be involved in the early damge of rabbit lens after vitrectomy combined with nonexpansile perfluoropropane gas.
vitrectom y;perfluoropropane gas; cataract;oxidative dam age
杨艳芳,硕士,主治医师,研究方向:白内障、眼底病。通讯作者:贾松柏,博士,主任医师,教授,硕士研究生导师,研究方向:白内障.yxmjpr@yahoo.com
2015-06-24
2015-10-24
:Yang YF,Jia SB,Tang LS.Research of T-SOD and MDA in rabbit lens at the early period after vitrectomy combined with nonexpansile perfluoropropane gas.Guoji Yanke Zazhi(Int Eye Sci)2015;15(11):1873-1876
10.3980/j.issn.1672-5123.2015.11.09
Received:2015-06-24 Accepted:2015-10-24
方法:健康新西兰白兔45只分为三组:正常组、对照组和实验组。对照组行单纯玻璃体切除联合平衡盐溶液(BSS)填充术;实验组行玻璃体切除联合非膨胀浓度C3F8填充术。在术后1、3、8、35、45d分别将三组兔眼晶状体取出制成组织匀浆,采用分光光度法分别检测TSOD和MDA的含量。
结果:T-SOD活力:正常组最高,实验组最低,三组不同时期两两相互比较均有显著统计学差异(P<0.01)。MDA含量:正常组最低,实验组最高,三组不同时期两两相互比较除术后第1d实验组与对照组比较无显著统计学差异外,其余各组两两相互比较均有显著统计学差异(P<0.01)。
结论:兔眼玻璃体切除联合非膨胀浓度C3F8气体填充术后早期晶状体混浊可能与氧化损伤有关。
- 国际眼科杂志的其它文章
- LASEK for the correction of hyperopia with mitomycin C using SCHWIND AMARIS excimer laser:one-year follow-up
- Hospitalised ocular injuries in Osogbo,Nigeria
- Com parison of sub-Tenon's anaesthesia in phacoemulsification w ith 3 and 5 m L lidocaine
- Comparison of combined phacoemulsification-nonpenetrating deep sclerectomy and phacoemulsificationtrabeculectom y
- 豚鼠早期实验性近视眼视网膜色素上皮细胞bFGF表达变化的研究
- 小鼠眼眶成纤维细胞TLR4基因静默对甲状腺眼病的效应研究

