小鼠眼眶成纤维细胞TLR4基因静默对甲状腺眼病的效应研究
王文英,周维明,张 意,陈华新
小鼠眼眶成纤维细胞TLR4基因静默对甲状腺眼病的效应研究
王文英1*,周维明2*,张 意2,陈华新3
作者单位:1(201203)中国上海市,上海海欣生物技术有限公司;2(200433)中国上海市,第二军医大学免疫学教研室;3(430070)中国湖北省武汉市,广州军区武汉总医院眼科
目的:构建小鼠眼眶成纤维细胞TLR4的shRNA慢病毒干扰载体,研究TL4-/-的成纤维细胞对甲状腺相关性眼病的治疗作用和机制。
shRNA;toll样受体4;成纤维细胞;甲状腺相关眼病;负向免疫调节
引用:王文英,周维明,张意,等.小鼠眼眶成纤维细胞TLR4基因静默对甲状腺眼病的效应研究.国际眼科杂志2015;15 (11):1862-1866
0 引言
甲状腺相关性眼病(thyroid-associated ophthalmopathy,TAO)是当前我国发病率最高的眼眶组织疾病之一,除眼部病变外,还伴随有甲状腺损伤与功能紊乱情况。TAO的病程分为活动期和非活动期(静止期),其眼部临床表现为眼泪、眼球运动障碍眼睑改变、视神经受损。因为TAO发病机制复杂,所以目前缺乏对其有效的诊疗措施[1-2]。新近的研究发现,TAO是一种自身免疫疾病,是机体免疫系统在甲状腺疾病所释放的甲状腺球蛋白等自身抗原的刺激下产生自身抗体,继而激活眼眶成纤维细胞,使成纤维细胞释放出T细胞趋化因子,最终使眼眶的免疫细胞相互作用并活化,产生自身免疫反应,导致眼眶组织广泛的结构改变和炎症损伤[3-5]。
成纤维细胞(Fibroblasts)是一种生长与裂殖迅速的细胞种群,是疏松结缔组织的主要组成来源,被细菌脂多糖等细菌产物和细胞因子激活后可分泌新的细胞因子,趋引免疫细胞参与机体的免疫应答[6-7]。研究表明,眼眶成纤维细胞(orbital fibroblast,OF)表面高表达的CD40与T细胞表面的CD40L(CD154)识别、结合提供T细胞的共刺激信号通路,导致T细胞的充分活化,促进炎症因子的分泌表达[8-9]。有研究指出成纤维细胞中促发炎症反应的主要信号分子是TLR4[10],为此我们研究静默眼眶成纤维细胞的TLR4基因表达对TAO的治疗效应。
1 材料和方法
1.1 材料293细胞株购自ATCC。小鼠TNF-α、IL-2、IFN-γ的ELISA试剂盒购自Sigma公司。miRNA表达载体pcDNATM6.2-GW/EmGFPmiR、慢病毒质粒pLenti6.3/ V5-DEST、包装病毒系统ViraPowerTMPackaging Mix均购自Invitrogen公司。TLR4一抗(兔抗大鼠)、β-actin一抗(小鼠抗大鼠),羊抗兔、羊抗小鼠二抗购自Santa Cruz公司。DMEM、胎牛血清购自Gibco公司。6~8周龄的SPF级Balb/c小鼠购自上海杰思捷公司。
1.2 方法
1.2.1 设计构建TLR4 siRNA干扰质粒利用RT-PCR方法从小鼠眼眶成纤维细胞中克隆TLR4的基因序列,将基因序列导入到真核载体pEGFP-N1中,构建真核表达载体pEGFP-N1-TLR4。使用在线RNA设计软件ihome设计4种可能具有TLR4基因干扰效力的序列, Bam HⅠ和HindⅢ双酶切目的基因片段和表达载体pcDNATM 6.2-GW/EmGFPmiR,以T4DNA连接酶连接载体和目的基因,构建眼眶成纤维细胞TLR4 shRNA重组干扰质粒。
1.2.2 最优干扰RNA的筛选将得到的4段干扰序列分别命名为sht001,sht002,sht003,sht004(阴性对照序列为sht NC),将各质粒分别与TLR4真核表达载体共转染进入293细胞,48h后收集细胞,抽提胞内蛋白质行蛋白质免疫印记检测,筛选最佳干扰效率的RNA。
1.2.3 慢病毒干扰载体的构建和病毒包装测定将获得的4段序列中具有最高干扰效率的sht001序列用Gateway技术重组到慢病毒表达载体pLenti6.3中,命名为pLenti6.3-sht001,经测序验证正确后进行病毒包装,将ViraPower TM Packaging Mix和慢病毒表达载体转染入293细胞,48h后收集细胞上清,包装出的病毒命名为Lvsht001,病毒滴度测定采用倍比稀释法感染293细胞法检测。

图1 pEGFP-N1-TLR4真核表达质粒的鉴定 1:pEGFP-N1-TLR4;2:Untransfeced。
1.2.4 小鼠眼眶成纤维细胞的获取处死Balb/c小鼠,无菌摘取眼眶组织,剪碎呈1mm3大小,利用Ⅱ型蛋白酶加胰蛋白酶联合消化法分离细胞,在通过差速贴壁分离法收集培养小鼠眼眶成纤维细胞。
1.2.53H-TdR掺入法检测TLR4沉默的OF刺激同种异体T细胞增殖反应将分离的OF分为4组并于24孔细胞培养板中培养,1×106/mL,每孔1mL,分4组,分别为:(1)非刺激OF组(未转染载体);(2)空载体转染OF组(转染空载体Lv-shtNC);(3)sht刺激OF组(转染Lvsht001);(4)LPS刺激OF组(未转染sht+200ng LPS刺激)。分别转染刺激,培养24h后加入同种异体的CD4+T细胞继续培养48h,加入3H,液闪计数仪检测各组反应生物cpm值。收集各组的细胞培养上清,ELISA法检测其中TNF-α、IL-2、IFN-γ的表达水平。
1.2.6 制备小鼠甲状腺眼病模型和研究重组慢病毒Lvsht001对小鼠眼眶纤维化进程的抑制效应参照文献方法[11]建立实验动物模型,取40只Balb/c雌性小鼠,分2组,每组20只。以重组质粒pcDNA3.1-TSHR多部位注射每只小鼠方法建立小鼠甲状腺眼病模型。接下来将疾病小鼠分为生理盐水组和Lv-sht001重组病毒组2组,每组20只:生理盐水组,眼眶局部内注射0.5mL生理盐水;Lv-sht001重组病毒组,采用眼眶内基因枪注入Lvsht001的重组病毒4×108TU。分别于第7、14、21、28d处死动物,每次每组处死5只,磁珠分选出眼眶中的CD4+T细胞,培养4h后收集培养上清,使用悬浮芯片系统测定其中TNF-α、IL-2、IFN-γ的表达含量。
统计学分析:采用SPSS 12.0统计软件分析处理,组间比较选择t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 构建pEGFP-N1-TLR4表达质粒和筛选最高干扰效率的shRNA采用TLR4真核基因表达载体pEGFPN1-TLR4,转染293细胞48h后,裂解细胞行蛋白质免疫印迹检测可见胞内有TLR4表达(图1)。依据软件设计的4段shRNA序列(表1),携带干扰shRNA的载体转染293细胞48h后,行TLR4蛋白质印记检测(图2),并采用Quantity One 4.0软件分析各蛋白表达条带灰度,各条shRNA的抑制效率分别为sht001(86.8±4.8)%,sht002 (15.9±1.9)%,sht003(75.1±6.3)%,sht004(78.1± 5.9)%,shtNC(6.8%±1.5)%,可见其中sht001抑制TLR4效果最佳。
2.2 慢病毒抑制载体的包装和病毒滴度测定用筛选出的抑制效率最佳的sht001序列导入慢病毒载体,包装后,得到的病毒滴定为1.5×106TU/mL。

表1 设计的shRNA序列

图2 蛋白质免疫印迹法检测筛选最优干扰效率的shRNA 1:sht001;2:sht002:3:sht003;4:sht004;5:sht NC。

图3 各组OF刺激的同种异基因T细胞增殖。
2.3 感染重组慢病毒Lv-sht001的OF抑制MLR反应
我们将Balb/c小鼠来源的眼眶成纤维细胞分为未刺激OF组,空载体刺激OF组,sht刺激OF组和LPS刺激OF组等4组,分别加入C57小鼠的同种异基因脾脏T细胞,行3H摄入检测MLR。如图3所示,结果表明:与未刺激OF组相比,Lvsht001转染组可以显著抑制MLR反应(P<0.05),而空载体刺激组和未刺激OF组相比,无统计学差异(P=0.205),均能促进MLR反应发生。
2.4 感染过Lv-sht001的重组慢病毒修饰的OF对MLR反应中细胞因子表达的影响Lv-sht001重组慢病毒感染的OF诱导的MLR反应中,如图4所示,细胞上清内Th1亚群的细胞因子TNF-α(图4A)、IL-2(图4B)、IFN-γ (图4C)的含量都比未刺激OF组和空载体组Lv-shtNC明显降低(P<0.05)。
2.5 TLR4沉默后小鼠甲状腺眼病模型中CD4+T细胞分泌炎性细胞因子的变化按常规方法建立TAO感染小鼠动物模型,导入TLR4干扰慢病毒Lv-sht001,分别于4个时间点处死小鼠,收集、磁珠分选眼眶部位内的CD4+T细胞,培养4h后,采用Bio-Plex悬浮芯片系统测定胞内TNF-α、IL-2、IFN-γ的含量,发现TNF-α、IL-2、IFN-γ含量显著下降(P<0.05,表2)。
3 讨论
格雷夫斯病(Graves disease,GD)是机体针对促甲状腺激素受体(thyrotropin receptor,TSHR)产生循环抗体,触发甲状腺功能亢进继而导致出现甲状腺毒症的一种自身免疫疾病[12-13],GD在临床上的常见表现为甲状腺的肿大、毒症、炎症病变,眼眶组织的重塑或者出现其他一些罕见皮肤病[14-15]。若GD侵入眼眶,所引起的眼部病变即称为甲状腺相关性眼病(TAO)。TAO的病程可分为活动期与非活动的静止期,活动期的病理特征是眼眶内和眼眶周围脂肪和结缔组织的广泛炎症,眼外肌肌纤维和眼眶脂肪之间大量的T淋巴细胞、肥大细胞浸润,以及偶尔出现的B细胞。活动期中眼眶组织中的单核细胞、巨噬细胞和成纤维细胞等合成的促炎性细胞因子在诱发自身炎症反应以及形成细胞外基质的进程中发挥了重要的作用;眼眶间质中沉积的透明质酸的性质与数量不仅决定TAO的病变组织学特征,还影响着眼眶组织的膨胀损伤程度。稳定静止期的TAO通常表现为炎症反应减弱消退,并伴有临床症状的改善。TAO的活动期以分泌Th1类细胞因子为主,而静止期则主要分泌Th2类细胞因子。TAO在炎症反应过程中早期出现大量活化的T细胞浸润眼眶,其产生的细胞因子和趋化因子反馈作用于T细胞,从而放大免疫炎症效应,造成强烈组织损伤,因而有学者指出控制TAO疾病过程中T细胞介导的炎症应答可以成为TAO生物治疗的关键手段[16-18]。

图4 各组OF诱导的MLR反应体系上清中Th1型细胞因子表达水平 A:各组OF诱导的MLR反应体系上清中TNF-α细胞因子表达水平;B:各组OF诱导的MLR反应体系上清中IL-2细胞因子表达水平;C:各组OF诱导的MLR反应体系上清中IFN-γ细胞因子表达水平。
表2 各时间点甲状腺眼病模型中小鼠眼眶CD4+T细胞分泌炎性细胞因子情况(±s,pg/mL,n=3)
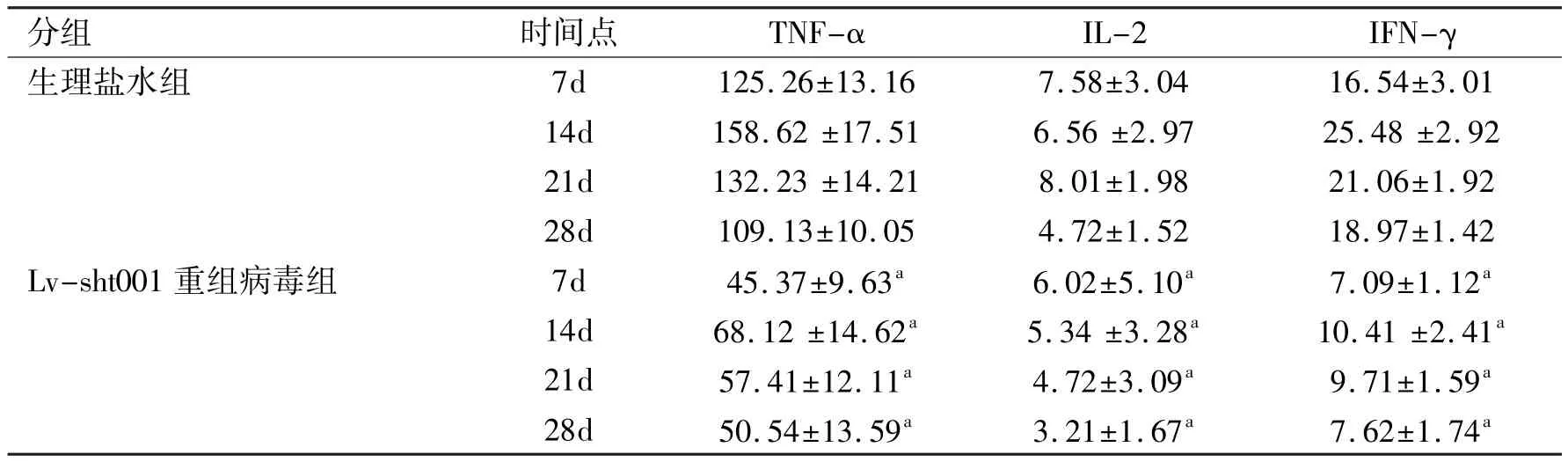
表2 各时间点甲状腺眼病模型中小鼠眼眶CD4+T细胞分泌炎性细胞因子情况(±s,pg/mL,n=3)
注:aP<0.05 vs生理盐水组同时间段。
分组时间点TNF-αIL-2IFN-γ生理盐水组7d125.26±13.167.58±3.0416.54±3.01 14d158.62±17.516.56±2.9725.48±2.92 21d132.23±14.218.01±1.9821.06±1.92 28d109.13±10.054.72±1.5218.97±1.42 Lv-sht001重组病毒组7d45.37±9.63a6.02±5.10a7.09±1.12a14d68.12±14.62a5.34±3.28a10.41±2.41a21d57.41±12.11a4.72±3.09a9.71±1.59a28d50.54±13.59a3.21±1.67a7.62±1.74a
成纤维细胞,过去认为仅是局部微环境中的组织结构成分,作用是合成细胞外基质成分并维持组织的动态平衡。但新近研究发现,成纤维细胞还是一种能与特定免疫细胞之间进行信号传递通讯的细胞。成纤维细胞能通过增殖、分化为免疫效应细胞来合成细胞因子、趋化因子和脂质中间体等成分参与炎症的活化通路[19-20]。眼眶成纤维细胞(OF)特别是来源于TAO患者的OF,在与细胞因子反应时具有独特性,OF与IL-1β、CD40L作用时,可产生过量的前列腺素E2(prostaglandin E2,PGE2),并能促进合成细胞外基质透明质酸[21-22]。T细胞通过膜表面的CD40L与OF表面的CD40作用从而在OF的活化中发挥重要作用,一旦CD40与T细胞表面的CD40L结合,诱发幼稚T细胞的大量增殖,提高促炎细胞因子如IL-1、IL-6、IL-8等的产生,这些因子会导致透明质酸合成酶以及葡萄糖脱氢酶的表达升高,增强炎症反应。受刺激的OF分泌的多种细胞因子中含有IL-16与趋化因子rantes,可以趋引T细胞迁徙[23-24]。因而有效阻断OF的活化或是阻止OF于T细胞之间的相互信号作用通路对于相关疾病的治疗是一个关键。
TLR4是OF表面的一种重要膜表面受体,其可以识别细菌脂多糖后被活化,激活的TLR4经过胞内一系列下游信号启动细胞因子,从而诱发一系列的免疫反应并导致急慢性炎症[25],而在炎症演变的进程中,炎症导致眼眶组织病变。因而阻断或抑制TLR4信号传递有望成为探索TAO的发病机制和生物干预治疗的一种手段。
短发夹RNA(short hairpin RNA,shRNA)对干扰基因表达具有高效性和特异性,在科研实践中已被用于干扰基因表达的有效载体用[26]。在本实验中,依据设计软件设计可能的TLR4 shRNA干扰序列片段,筛选得到最佳干扰TLR4基因表达的shRNA序列,克隆入慢病毒系统,导入细胞内实现胞内TLR4基因的特异性静默。慢病毒的转染效率较高且安全性较好,当前已经成为科研中病毒转染的首选载体[27]。我们从小鼠OF的TLR4序列中筛选了有效干扰靶点序列,并成功构建重组慢病毒转染OF,有效抑制了其胞内TLR4的表达,体外结果显示了LV-sht001能有效抑制OF中TLR4基因的表达,其转染的OF能有效抑制MLR反应中T细胞的增殖,并且降低T细胞相关炎性细胞因子分泌水平。体内小鼠动物实验也证实,导入干扰TLR4基因慢病毒实验组小鼠,其眼眶内T细胞分泌的细胞因子水平显著下降。这些结果显示经shRNA沉默的TLR4在抑制TAO的发展中可能起重要作用,有望成为治疗TAO的新型生物靶点。但由于TAO的发生发展机制非常复杂,对于探索经TLR4干扰OF,调控眼眶内细胞炎症反应进程的效应和作用机制仍需要深入探索和研究。
1 Fatourechi V.Medical management of extrathyroidal manifestation of graves disease.Endocr Pract 2014;20(12):1333-1344
2 Lim HS,Back KO,Kim HJ,et al.Hyaluronic Acid Induces COX-2 Expression via CD44 in Orbital Fibroblasts From Patients With Thyroid-Associated Ophthalmopathy.Invest Ophthalmol Vis Sci 2014;55(11): 7441-7450
3 Antonelli A,Ferrari SM,Corrado A,et al.Extra-ocular muscle cells from patients with Graves'ophthalmopathy secrete α(CXCL10)and β (CCL2)chemokines under the influence of cytokines that are modulated by PPARγ.Autoimmun Rev 2014;13(11):1160-1166
4 Kan E,Kan EK,Ecemis G,et al.Presence of thyroid-associated ophthalmopathy in Hashimoto's thyroiditis.Int J Ophthalmo 2014;7(4): 644-647
5 Salvi M.Immunotherapy for Graves' ophthalmopathy.Curr Opin Endocrinol Diabetes Obes 2014;21(5):409-414
6 Wu X,Zhang G,Wang X,et al.Endotoxin tolerance induction in human periodontal ligament fibroblasts stimulated with different bacterial lipopolysaccharides.Arch Oral Biol 2014;60(3):463-470
7 Ren A,Moon C,Zhang W,et al.Asymmetrical Macromolecular Complex Formation of Lysophosphatidic Acid Receptor 2(LPA2)Mediates Gradient Sensing in Fibroblasts.J Biol Chem2014;289(52): 35757-35769
8 Chng CL,Lai OF,Chew CS,et al.Hypoxia increases adipogenesis and affects adipocytokine production in orbital fibroblasts-a possible explanation of the link between smoking and Graves' ophthalmopathy.IntJ Ophthalmol 2014;7(3):403-407
9 Martins TM,de Paula AC,Gomes DA,et al.Alkaline phosphatase expression/activity and multilineage differentiation potential are the difference between fibroblasts and orbital fat-derived stem cells--a study in animal serum-free culture conditions.Stem Cell Rev 2014;10(5): 697-711
10 Shan SJ,Douglas RS.The pathophysiology of thyroid eye disease.JNeuroophthalmol 2014;34(2):177-185
11 Costagliola S,Many MC,Denef JF,et al.Genetic immunization of outbred mice with thyrotropin receptor cDNA provides a model of Graves'disease.J Clin Invest2000;105(6):803-811
12 Javadi H,Pashazadeh AM,Mogharrabi M,et al.Comparison of Thyroid Blood Flow and Uptake Indices Using Technetium-99m Pertechnetate in Patients with Graves'Disease and Euthyroid Subjects.Mol Imaging Radionucl Ther2014;23(3):96-100
13 Antonelli A,Ferrari SM,Corrado A,et al.Autoimmune thyroid disorders.Autoimmun Rev 2014;14(2):174-180
14 Samuelsson K,Palmer M,Press R.Sensory ataxia associated with Graves'disease.J Neurol Sci2014;347(1-2):406-407
15 Yin J,Zhu J,Huang D,et al.Unilateral Symptomatic Intracranial Arterial Stenosis and Myopathy in an Adolescent with Graves Disease:A Case Report of an High-resolution Magnetic Resonance Imaging Study.JStroke Cerebrovasc Dis 2015;24(1):e49-52
16 Fatourechi V.Thyroid dermopathy and acropachy.Best Pract Res ClinEndocrinol Metab2012;26(4):553-565
17 Ardley M,McCorquodale T,Laahooti H,et al.Eye findings and immunological markers in probands and their euthyroid relatives from a single family with multiple cases of thyroid autoimmunity.Thyroid Res2012;5(1):4
18 Bartalena L.Prevention of Graves'ophthalmopathy.Best Pract ResClin Endocrinol Metab2012;26(3):371-379
19 Riemann A,Ihling A,Thomas J,et al.Acidic environment activates nflammatory programs in fibroblasts via a cAMP-MAPK pathway.Biochim Biophys Acta2014;1853(2):299-307
20 Gölz L,Bayer S,Keilig L,et al.Possible implications of Ni(II)on oral IL-1β-induced inflammatory processes.Dent Mater2014;30(12): 1325-1335
21 Rhiu S,Chae MK,Lee EJ,et al.Effect of tanshinone II A in an in vitro model of Graves' orbitopathy.Invest Ophthalmol Vis Sci2014;55 (9):5900-5910
22 Virakul S,Dalm VA,Paridaens D,et al.The tyrosine kinase inhibitor dasatinib effectively blocks PDGF-induced orbital fibroblast activation.Graefes Arch Clin Exp Ophthalmol2014;252(7):1101-1109
23 Lee SH,Lim SY,Choi JH,et al.Benzylideneacetophenone derivatives attenuate IFN-γ-induced IP-10/CXCL10 production in orbital fibroblasts of patients with thyroid-associated ophthalmopathy through STAT-1 inhibition.Exp Mol Med 2014;46:e100
24 Lee WM,Paik JS,Cho WK,et al.Rapamycin enhances TNF-αinduced secretion of IL-6 and IL-8 through suppressing PDCD4 degradation in orbital fibroblasts.Curr Eye Res2013;38(6):699-706
25 Pone EJ,Lou Z,Lam T,et al.B cell TLR1/2,TLR4,TLR7 and TLR9 interact in induction of class switch DNA recombination: Modulation by BCR and CD40,and relevance to T-independent antibody responses.Autoimmunity2015;48(1):1-12
26 Moffat J,Sabatini DM.Building mammalian signaling pathways with RNAi screens.Nat Rev Mol Biol2006;7(1):177-187
27 Wiznerowicz M,Szulc J,Trono D.Tuning silence:conditional systems for RNA inerference.Nat Methods 2006;3(9):682-688
Inhibition effect of mouse orbital fibroblasts TLR4 gene silencing on the thyroid-associated ophthalmopathy
Wen-Ying Wang1,Wei-Ming Zhou2,Yi Zhang2, Hua-Xin Chen3
1Shanghai Haixin Biological Technology Co.,Ltd,Shanghai 201203,China;2Department of Immunology,Second Military Medical University,Shanghai 200433,China;3Department of Ophthalmology,Wuhan General Hospital of Guangzhou Military Command of Chinese PLA,Wuhan 430070,Hubei Province, China
Co-first authors:Wen-Ying Wang and Wei-Ming Zhou
Hua-Xin Chen.Department of Ophthalmology,Wuhan General Hospital of Guangzhou Military Command of Chinese PLA,Wuhan 430070,Hubei Province, China.971213506@qq.com
·AIM:To construct shRNA lentivirus interference vector of mice orbital fibroblasts TLR4 and to research the therapeutic effect and mechanism of TL4-/-fibroblasts on thyroid-associated ophthalmopathy.·METHODS:Optimal shRNA interference expression plasmid of mouse orbital fibroblasts TLR4 gene was designed,built,and screened.Then the best shRNA was introduced into lentiviral expression vector by Gateway method and recombinant lentiviral vector was used to infect mouse orbital fibroblasts.Its capability of negative regulating the immune inflammatory response was researched.At last the method of fibroblast TLR4 gene silencing in the model mice of thyroid-associated ophthalmopathy was used,the in vivo therapeutic effect was observed.·RESULTS:ShRNA sequences with the best effect of gene silencing were selected and introduced into lentiviral vectors(virus titer was 1.5×106TU/m L).Balb/cmice orbital fibroblasts transfected lentivirus could negatively regulate the immune response,inhibit immune inflammatory response.The proceeding of thyroid-associated ophthalmopathy of the mice transfected TLR4-/-recombinant lentivirus was obviously prior to that of the control mice.·CONCLUSION:Mouse fibroblast TLR4-/-siRNA lentiviral vectors are successfully obtained,which has the favourable inhibitory effect on immune inflammatory responses.The recombinant entivirus could protect the proceeding of thyroid-associated ophthalmopathy, therefore the TLR4 expression interference is a novel potential target for thyroid-associated ophthalmopathy.
shRNA;TLR4;fibroblast;thyroidassociated ophthalmopathy;negative regulation to immune responses
王文英,女,硕士,工程师,研究方向:细胞免疫治疗;周维明,男,助理研究员,研究方向:细胞免疫治疗。
陈华新,男,硕士,主治医师,研究方向:眼整形、眼眶病.971213506@qq.com
2015-05-25
2015-10-22
:Wang WY,Zhou WM,Zhang Y,et al.Inhibition effect of mouse orbital fibroblasts TLR4 gene silencing on the thyroidassociated ophthalmopathy.Guoji Yanke Zazhi(Int Eye Sci)2015; 15(11):1862-1866
10.3980/j.issn.1672-5123.2015.11.06
*:作者王文英和周维明对本文贡献一致。
Received:2015-05-25 Accepted:2015-10-22
方法:设计、构建、筛选小鼠眼眶成纤维细胞TLR4基因的最优干扰shRNA表达质粒,选择Gateway方法将质粒导入慢病毒表达载体中,使用重组慢病毒载体感染小鼠眼眶成纤维细胞,研究其对免疫炎性反应的负向调控能力,并在小鼠甲状腺眼病模型中采用沉默成纤维细胞TLR4基因的方法,观察其体内治疗效果。
结果:筛选出具有最好基因静默效果的shRNA序列,导入慢病毒载体,病毒滴度为1.5×106TU/mL。转染慢病毒的Balb/c小鼠眼眶成纤维细胞能够负向调控免疫应答,抑制免疫炎症反应。在疾病动物模型中转染了干扰病毒载体实验组小鼠,其眼病发生发展情况均优于对照组。
结论:成功获得了小鼠成纤维细胞TLR4-/-shRNA的慢病毒载体,转染了该载体的小鼠眼眶成纤维细胞能够抑制正向免疫应答,可以有效地抑制甲状腺眼病的发展,揭示干扰TLR4表达可能成为防治甲状腺眼病的生物诊疗措施。
- 国际眼科杂志的其它文章
- LASEK for the correction of hyperopia with mitomycin C using SCHWIND AMARIS excimer laser:one-year follow-up
- Hospitalised ocular injuries in Osogbo,Nigeria
- Com parison of sub-Tenon's anaesthesia in phacoemulsification w ith 3 and 5 m L lidocaine
- Comparison of combined phacoemulsification-nonpenetrating deep sclerectomy and phacoemulsificationtrabeculectom y
- 豚鼠早期实验性近视眼视网膜色素上皮细胞bFGF表达变化的研究
- 小鼠视网膜电图随生长发育的变化特点

