越鞠丸对代谢综合征模型大鼠的治疗作用及其对肝脏AMPK-α表达的影响
杨红莲 张 丽 段玉红
(陕西中医学院附属医院,陕西咸阳712000)
越鞠丸对代谢综合征模型大鼠的治疗作用及其对肝脏AMPK-α表达的影响
杨红莲 张 丽 段玉红
(陕西中医学院附属医院,陕西咸阳712000)
目的:研究越鞠丸对代谢综合征大鼠肝脏-磷酸腺苷激活的蛋白激酶-α(AMPK-α)表达的影响。方法:大鼠随机分为正常对照组、模型组、越鞠丸大剂量组、越鞠丸小剂量组、二甲双胍组,除正常对照组以外,其余各组用高脂饲料诱导代谢综合征大鼠模型,8周后各药物组分别灌胃相应药物,正常对照组和模型组给予等量生理盐水,连续灌胃4周。观察并比较各组大鼠体重、血压与空腹血糖、血脂水平和肝脏AMPK表达。结果:与正常对照组比较,模型组大鼠体重、血压、空腹血糖、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白-胆固醇(LDL-C)水平明显升高(P<0.05),肝脏磷酸化AMPK-α(P-AMPK-α)表达水平明显降低(P<0.05)。与模型组比较,越鞠丸组大鼠血压、空腹血糖、TG、TC、LDL-C明显降低(P<0.05,P<0.01),P-AMPK-α蛋白表达明显升高(P<0.05)。结论:越鞠丸能改善代谢综合征大鼠代谢紊乱症候群,其上调P-AMPK-α蛋白的表达是其可能的作用机制。
越鞠丸 代谢综合征 肝AMPK-α 血脂 SD大鼠
代谢综合征(MS)是多种代谢成分异常聚集的病理状态,是一组复杂的代谢紊乱症候群。本病病因病机尚不明确,目前多数学者认为能量代谢失衡是MS的主要病因[1]。磷酸腺苷激活的蛋白激酶(AMPK)是调节全身能量平衡的关键因素,不仅可以在细胞水平作为能量感受器,还可以通过激素和细胞因子来参与调节机体的能量代谢[2-4],提示AMPK有可能在预防机体发生代谢性疾病中起重要作用[5]。中医认为,“郁”是MS的核心病机,并且贯穿其病理变化的始终,对其发生发展均有影响。越鞠丸能行气解郁,主治各种因素导致的郁,其所治病症与MS十分吻合。目前临床已将越鞠丸广泛应用于治疗肥胖、高血压病、糖尿病等疾病,均取得了较好的疗效[6-9]。本研究试图以AMPK为切入点研究越鞠丸治疗MS的机理,从而为临床上提供药效机理明确的治疗药物。
1 实验材料
1.1 动物 SD雄性大鼠,体重(160±8)g,由第四军医大学实验动物中心提供,动物合格证号:SCXK军2013-009号。
1.2 试剂 GLU检测试剂盒(批号512051),TG检测试剂盒 (批号506051),TC检测试剂盒 (批号0707031),HDL-C和 LDL-C试 剂 盒 (批 号0707041、0707042),均为北京利德曼生化技术有限公司产品。PVDF膜(MilliPore,USA),Rabbit Anti-AMPK Polyelonal Antibody(Cell Signaling,USA),Rabbit Anti-PhosPhor-AMPK Polyclonal Antibody(Cell Signaling,USA)。
1.3 仪器 贝克曼CX4型全自动生化分析仪,电子天平,沈阳龙腾电子有限公司生产。TDL-5型高速台式离心机,上海安亭科学仪器厂生产。大鼠动脉血压测量仪,正华生物仪器设备有限公司生产。
1.4 药物 越鞠丸 (北京同仁堂制药有限公司,批号:131016),用万能粉碎机粉碎,每次称取110g用生理盐水配置成0.42g/mL,置于冰箱4℃保存,用时温水加热至常温,小剂量稀释成0.21g/mL。盐酸二甲双胍片,深圳市中联制药有限公司生产,批号: 1201060。
2 实验方法
2.1 造模与分组、给药 随机将大鼠分为正常对照组及造模组,正常对照组给予饲料+自来水喂养,造模组给予高盐高脂饲料(普通饲料63%,猪油20%,蛋黄5%,食用盐10%,胆固醇2%)+30%的果糖水喂养,造模共8周。8周后以大鼠体重、尾动脉收缩压、空腹血糖、血脂水平(TG、TC、LDL-C和HDL-C)为观察指标,确定造模成功。造模成功的大鼠随机分为模型组、二甲双胍组(0.15g/kg)和越鞠丸大、小剂量组(4.2g/kg和2.1g/kg),每组10只。分组后,正常对照组继续给予大鼠饲料+自来水,其余各组大鼠给予高盐高脂饲料+30%果糖水。同时各药物组按照1mL/100g灌胃给予相应药物,正常对照组和模型组给予等量生理盐水,连续灌胃4周。
2.2 血清、肝组织收集 各组大鼠于末次给药后,禁食不禁水 12h,3%戊巴比妥钠腹腔注射麻醉(0.1mL/100g),腹主动脉取血,取血后迅速摘取肝脏,动脉血液室温静置20min,4℃,3500r/min离心10min,分离血清,分装冻存于-80℃冰箱以备检测生化指标。收集肝脏,滤纸吸干,分装于冻存管中,做好标记迅速置于液氮罐中以备提取蛋白质。
2.3 大鼠MS相关指标测定 麻醉取血前,称量各组动物体重,测量大鼠尾动脉血压。用全自动生化分析仪检测大鼠血清空腹血糖、血脂水平。
2.4 肝脏组织AMPK-α、磷酸化 AMPK-α(PAMPK-α)蛋白测定 从液氮中取出约100mg肝脏组织,充分裂解,4℃、12000g×5min离心,吸取上清,采用BCA法测定肝脏组织的蛋白含量。制备8%SDSPAGE凝胶,进行电泳,转膜,染色,封闭。用抗AMPK-α抗体(1∶1000)、抗P-AMPK(Thr172)抗体、抗GAPDH抗体 (1∶3000)4℃孵育过夜;TBS-T洗涤PVDF膜3次×5min,分别用对应辣根过氧化物酶标记二抗 (1∶5000),室温孵育lh;TBS-T洗涤PVDF膜3次×5min,滤纸吸干水分,加上发光液,于暗室曝光,在X光片上显影。Western blot结果使用光密度测量仪扫描,使用Quantity One分析软件进行灰度值比较。
2.5 统计学方法 采用SPSS 13.0软件进行数据处理,数据采用(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
3 实验结果
3.1 治疗后各组大鼠体重、血压及血糖比较 与正常对照组比较,模型组大鼠体重、血压、空腹血糖均明显升高(P<0.05)。与模型组比较,越鞠丸大剂量组大鼠血压明显降低(P<0.05);越鞠丸大、小剂量组及二甲双胍组空腹血糖水平明显降低(P<0.05)。越鞠丸大、小剂量组大鼠体重、血压、空腹血糖与二甲双胍组比较无统计学差异(P>0.05)。见表1。
表1 各组大鼠体重、血压及空腹血糖比较(±s)
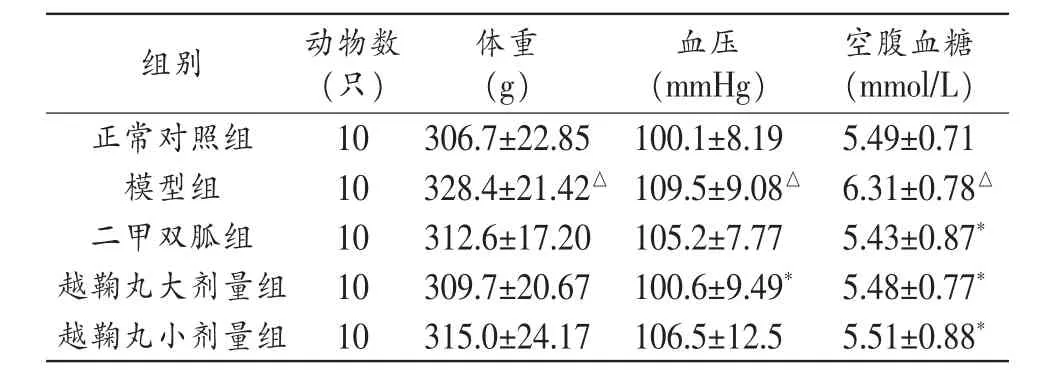
表1 各组大鼠体重、血压及空腹血糖比较(±s)
注:与正常对照组比较,△P<0.05;与模型组比较,*P<0.05。
组别 动物数(只)体重(g)血压(mmHg)空腹血糖(mmol/L)正常对照组10306.7±22.85100.1±8.19 5.49±0.71模型组 10 328.4±21.42△109.5±9.08△6.31±0.78△二甲双胍组 10 312.6±17.20 105.2±7.77 5.43±0.87*越鞠丸大剂量组 10 309.7±20.67 100.6±9.49*5.48±0.77*越鞠丸小剂量组 10 315.0±24.17 106.5±12.5 5.51±0.88*
3.2 治疗后各组大鼠血脂指标比较 与正常对照组比较,模型组大鼠甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白-胆固醇 (LDL-C)水平均明显升高(P<0.05)。与模型组比较,越鞠丸大剂量组大鼠TG、TC、LDL-C水平明显降低(P<0.05,P<0.01),越鞠丸小剂量组TG、TC水平明显降低(P<0.05),二甲双胍组TC、LDL-C水平明显降低(P<0.05)。越鞠丸大、小剂量组各血脂指标与二甲双胍组比较均无统计学差异(P>0.05)。见表2。
表2 各组大鼠血脂指标比较(±s) mmol/L

表2 各组大鼠血脂指标比较(±s) mmol/L
注:与正常对照组比较,△P<0.05;与模型组比较,*P<0.05,**P<0.01。
组别TC HDL-C正常对照组动物数(只) TG LDL-C 1.49±0.29 1.03±0.17 10 1.32±0.50 0.6±0.14 1.82±0.28△0.95±0.19二甲双胍组 10 1.36±0.51 1.51±0.30*0.85±0.12 0.62±0.12*越鞠丸大剂量组 10 1.31±0.56*1.29±0.39**0.91±0.18 0.63±0.09*越鞠丸小剂量组 10 1.26±0.52*1.45±0.33*0.86±0.16 0.68±0.11模型组 10 1.80±0.43△0.73±0.11△
3.3 治疗后各组大鼠肝脏AMPK-α和P-AMPK-α蛋白水平比较 与正常对照组比较,模型组大鼠PAMPK-α表达水平显著降低(P<0.05)。与模型组比较,越鞠丸大、小剂量组P-AMPK-α表达水平明显升高(P<0.05)。越鞠丸大、小剂量组AMPK-α、PAMPK-α表达水平与二甲双胍组比较无统计学差异(P>0.05)。见表3。
表3 各组大鼠肝脏AMPK-α和P-AMPK-α表达比较(±s)

表3 各组大鼠肝脏AMPK-α和P-AMPK-α表达比较(±s)
注:与正常对照组比较,△P<0.05;与模型组比较,*P<0.05。
组别 动物数(只) AMPK-α P-AMPK-α正常对照组10 0.92±0.17 0.94±0.22模型组 10 0.82±0.19 0.73±0.15△二甲双胍组 10 1.00±0.25 0.88±0.18越鞠丸大剂量组 10 0.93±0.14 0.92±0.16*越鞠丸小剂量组 10 0.99±0.24 0.89±0.16*
4 讨论
中医学认为素体肥胖,或饮食不节,嗜食肥甘厚味,损伤脾胃,酿生痰湿,阻滞气机,化瘀阻络,致使MS成为以痰、瘀、热为标,脾肾亏虚、肝阳偏亢为本的顽证,故认为气郁、血郁、痰郁、火郁、湿郁、食郁是导致MS的主要病机。上述论述恰恰与朱丹溪“六郁”理论相一致。越鞠丸是朱丹溪根据“六郁”之说创立的方剂,方名“越鞠”具发越鞠郁之气的涵义,主治气、血、痰、火、湿、食等郁,由苍术、香附、川芎、神曲、栀子五药组成。香附行气解郁,以治气郁,为君药;苍术燥湿运脾,以治湿郁;川芎活血化瘀,以治血郁;栀子清热泻火,以治火郁;神曲消食导滞,以治食郁。五味中药可分别针对MS早期诸邪进行协同干预。我们选用二甲双胍作为阳性对照药,主要因为目前研究表明二甲双胍对MS具有全面的调节作用,除了具有降糖、增强胰岛素敏感性、改善脂代谢紊乱、降低血压等作用外[10-11],还可以增加大鼠AMPK-α的表达及活性[12-13]。
2005年国际糖尿病联盟(IDF)颁布的人MS诊断标准,即在中心型肥胖基础上,伴有胰岛素抵抗或空腹血糖受损/糖耐量异常、高血压、低HDL和高LDL血症等其中两项者,判定为MS。动物MS成模与否亦参考上述标准,其中是否符合中心型肥胖指标主要通过测量大鼠体重和腹围判定。本实验结果显示,与正常对照组比较,模型组大鼠体重、血压、空腹血糖及血清TG、TC、LDL-C水平均显著升高,且估测模型组大鼠腹围大于正常对照组,提示造模成功。与模型组比较,越鞠丸大、小剂量可不同程度降低上述指标,表明越鞠丸对MS具有一定的治疗作用。
AMPK是近年发现的一种调节机体糖、脂肪和蛋白质代谢的重要蛋白分子。研究表明,当AMP/ATP的比值升高时,AMPK可磷酸化激活大量的下游靶分子,从而减少ATP的利用,增加ATP的产生,使细胞的分解代谢增加,反之则细胞合成代谢增加。在哺乳动物中,AMPK的组成包括α、β、γ三个亚单位,是一个三聚体结构。其中α亚单位起催化作用,而β和γ亚单位起调节作用。α亚单位的数个位点均可被磷酸化,其中苏氨酸172位点及其磷酸化对AMPK活性的调节起重要作用[14]。研究中所检测的总AMPK及活性AMPK蛋白通常是指其α亚单位。实验结果显示,与正常对照组比较,模型组肝组织P-AMPK-α蛋白表达水平明显下降;与模型组比较,越鞠丸大、小剂量组P-AMPK-α表达水平均明显升高,表明越鞠丸对P-AMPK-α蛋白表达水平具有一定的干预作用。
近年来,诸多医者虽有使用越鞠丸治疗MS并取得比较满意的临床效果,然而至今尚未有学者能够阐明越鞠丸治疗MS的作用机制。此次实验结果表明,越鞠丸各剂量组可不同程度降低MS大鼠血压、空腹血糖、血脂水平,增加MS大鼠肝脏组织P-AMPK-α蛋白表达,故初步推测越鞠丸通过激活AMPK防治MS的发生发展。课题组下一步将围绕AMPK及其信号通路深入研究越鞠丸治疗MS的作用机理,从而为临床防治MS提供药效显著、作用机理明确的有效中药。
[1] 解雪芬,朱毅.AMPK与代谢综合征.基础医学与临床,2006,26(1):27
[2] 刘金凤,彭红丽.黄芩苷对链脲佐菌素诱导的糖尿病模型大鼠血糖和血脂及腺苷酸活化蛋白激酶的影响.中国药理学与毒理学杂志,2011,25(2):145
[3] Sakamoto K,Goransson O,Hardie DG,et al.Activity of LKB1 andAMPK-related kinases in skeletal muscle:effectsofcontraction,phenformin,and AICAR.Am J Physiol Endocrinol Metab,2004,287:E310
[4] Woods A,Johnstone SR,Dickerson K,et al.LKB1 is the upstream kinase in the AMP-activated protein kinase cascade.Curr Bi-ol,2003,13:2004
[5] Fryer LG,Carling D.AMP-activated protein kinase and the metabolic syndrome.Biochem Soc Trans,2005,33:362
[6] 卢惠琴,董学芳.越鞠丸合二陈汤治疗肥胖型糖耐量异常58例.陕西中医,2008,29(6):682
[7] 李素琴.越鞠丸加减治疗2型糖尿病68例疗效观察.山西中医学院学报,2009,10(6):54
[8] 孙素芹.越鞠丸加减治疗高脂血症44例临床观察.上海中医药杂志,2008,42(1):35
[9] 任昌伟.越鞠丸化裁治疗痰浊内盛型高血压病疗效观察.河南中医,2005,25(9):67
[10] 杨萍土.简明实验动物学.上海:复旦大学出版社,2003:143
[11] 李建生,赵敏,余海滨,等.代谢综合征大鼠模型的建立与评价及增龄因素的影响.中国老年学杂志,2005,25(12):1490
[12] Hawley SA,Gadalla AE,Olsen GS.The antidiabetie drug metform inactivates the AMP-activated Protein kinase case edevia an adeninenue leotide -independent mechanism.Diabetes,2002,51:2420
[13] ZhengDH,MacLean PS,PohnertSC.Regnlation of muscle GLUT-4 transcription by AMP-activated Protein kinase.JAPPI Physiol,2001,91:1073
[14] Xue B,Kahn B.AMPK integrates nutrient and hormonal signals to regulate food intake and energy balance through effects in the hypothalamus and PeriPheral tissues.JPhysiol,2006,574:73
R589.905
A
1672-397X(2015)05-0077-03
杨红莲(1980—),女,药学博士,副主任药师,研究方向:防治代谢性疾病的中药研究。465134440@qq.com
2014-12-12
编辑:吴 宁

陕西省教育厅科学研究项目计划(12JK1030)

