聚磷菌—JN459的分离和聚磷特性研究
钟传青,姜天翼,王静,张春明
(山东建筑大学市政与环境工程学院,山东 济南250101)
0 引言
增强型生物除磷工艺EBPR(enhanced biological phosphorus removal)是目前普遍使用的生物除磷技术,除磷效率是普通生物除磷工艺的3~7倍[1-3]。EBPR工艺的基本原理为聚磷菌 PAOs(phosphate accumulation organisms)在厌氧/好氧交替环境中进行放磷和过量吸磷过程,然后通过排放污泥进行除磷。在厌氧阶段 PAOs吸收挥发性脂肪酸 VFAs(volatile fatty acids)转化为细胞内碳源 PHA(poly-βhydroxyalkanoates)并储存起来;在好氧阶段PAOs分解PHA,获得的能量用于细胞生长和过量摄取磷元素,并以多聚磷酸盐 Poly-P(Polyphosphate)的形式蓄积,最终活性污泥的含磷量可大于10%[4-7]。
PAOs是一类微生物的总称,主要包括不动杆菌属、红环菌属、气单胞菌属、棒杆菌属、肠球菌属、葡萄球菌属和放线菌纲等,还没有证据证明哪类PAOs在 EBPR系统中占主导地位[8-10]。传统定义的PAOs要求微生物具有两个特征:(1)厌氧阶段合成聚羟基烷PHAs(Poly-hydroxy-alkanoates)和好氧阶段合成Poly-P;(2)厌氧和好氧阶段交替过程中有Poly-P和PHAs相互的转换。已有研究表明并不是所有聚磷微生物都有Poly-P和PHAs循环,目前对PAOs的定义更倾向于“一切能够超过自身生长所需过量吸收磷的微生物”[11]。因此,阐明 PAOs种类、聚磷特性及各菌株在EBPR系统中的地位一直是生物除磷研究的重要方向。
文章从高新区污水处理厂活性污泥中分离到一株聚磷菌JN459,对其微生物学分类地位进行了鉴定,同时研究了该菌株在纯培养条件下的聚磷特性,研究结果可为深入研究Microlunatus phosphovorus(M.phosphovous)聚磷代谢的分子调控机制提供研究基础。
1 材料与方法
1.1 样品来源
活性污泥来自济南市高新区污水处理厂。
1.2 污水水质
市政污水来自济南市高新区污水处理厂的进水,水质参数有:化学需氧量(COD)为 247 mg/L,氨态氮(NH4+-N)为 63.3 mg/L,磷酸根(PO34-P)为13.5 mg/L。
人工合成污水成分为:葡萄糖为0.3 g、蛋白胨为 0.1 g、酵母粉为0.01 g、醋酸钠为 0.15 g、氯化铵为 0.2 g、氯化钠为 0.05 g、磷酸氢二钾为 0.1 g、硫酸镁为0.12 g、纯化水为1 L。实测NH+4-N为65.1 mg/L,PO3-4-P为14.2 mg/L。
1.3 SBR反应器
10 L体积的实验室序列间歇式SBR(sequencing batch reactor)反应器(由小型发酵罐改装),具备在线灭菌、在线温度控制、在线pH检测与溶解氧DO(Dissolved oxygen)检测、空气与氮气流量控制等功能。
1.4 菌株的分离与筛选
取10 mL的活性污泥样品,用40 mL的磷酸盐溶液(5 mg/L的三聚磷酸钠和8.5 g/L的氯化钠)稀释后均质,梯度稀释后涂布到 R2YA培养基(0.5 g的酵母粉、0.5 g的蛋白胨、0.5 g的酪蛋白氨基酸、0.5 g的葡萄糖、0.5 g的可溶性淀粉、0.3 g的丙酸钠、0.3 g的磷酸氢二钾、0.03 g的硫酸镁、20 g的琼脂粉和1 L的纯化水),在25℃温度下培养,挑取单菌落。菌株形态、异染颗粒染色和生理生化特征测定根据文献进行[12-13]。
1.5 16SrDNA分析
用LB液体培养基培养JN459菌株,提取该菌株总DNA,用高保真DNA聚合酶链式反应PCR(polymerase chain reaction)扩增其16SrDNA。将PCR产物连接到中间载体进行DNA测序,并将测序结果在GenBank中进行Blast比对,并与GenBank/EMBL/DDBJ中已知序列进行同源性分析。
1.6 菌株纯培养和磷吸收试验
将JN459株液体培养至对数生长期,离心收集菌体,并用无菌水洗涤,然后接种到SBR反应器中。吸磷和放磷试验采用好氧-缺氧工艺,pH值控制为7.0,每个循环过程中好氧时间为2 h,溶解氧浓度约为4 mg/L;缺氧时间为2 h,用N2置换体系中O2,维持溶解氧浓度低于0.2 mg/L;最后,静置时间为2 h,整个工艺维持约2 d,无菌体沉降和出水过程。每30 min取样检测水相中磷含量,每个试验方案重复三次,结果取平均值。
2 结果与分析
2.1 JN459菌株的生理生化特征
通过单菌分离和纯培养技术从活性污泥中分离得到一株球菌,编号为JN459。该菌最适生长温度为25~30℃,最高耐受温度40℃,最低生长温度5℃;最适生长的pH值为7,最低的生长pH值为4,最高生长的 pH值为 9。JN459菌体直径约1.5μm,显微镜观察可见单个或2~4个菌体聚集,无运动性,革兰氏染色阳性,亚甲基蓝染色可见由Poly-P构成的异染颗粒。JN459为兼性好氧菌,过氧化氢酶呈阳性,但氧化酶活性较弱,在无氧条件下可以将硝酸盐还原为亚硝酸盐,不能利用亚硝酸盐。JN459可以利用的碳源包括淀粉、L—山梨糖、D—阿拉伯糖、甘油、甘露醇、乙酸和丝氨酸,不能利用乳糖、丙酸、苹果酸、丙氨酸、谷氨酰胺和天冬酰胺,结果见表1。

表1 JN459的生理生化特征
2.2 菌株JN459的16 S rDNA鉴定
16 S rDNA序列测序结果显示,JN459菌株16 S rDNA的 PCR扩增片段长度为 1444 bp,与M.phosphovorus NM-1菌株的16 S rDNA仅有2个碱基不同,相似度达到 99.8%。JN459菌株 16 S rDNA的同源性分析如图1所示。综合其形态特征和生理生化鉴定试验结果,确定JN459菌株为M.phosphovorus。M.phosphovorus是 1995年从EBPR系统分离得到的聚磷菌,具有显著的聚磷效果,Poly-P可以达到其菌体干重的10%,荧光标记原位杂交技术 FISH(fluorescence in situ hybridization)分析结果显示 M.phosphovorus占EBPR总 菌 群 2.7%,占 PAOs 9%[14-15]。但 是M.phosphovorus在厌氧阶段无明显释磷现象,与其它PAOs好氧吸磷和厌氧释磷的特点有显著差异,提示M.phosphovorus在磷代谢途径上存在独特的调控机制。

图1 基于JN459 16 S rDNA序列同源性的系统发育树图
2.3 JN459的聚磷特性
用SBR检测好氧-缺氧工艺条件下JN459的吸磷和放磷曲线如图2所示。由图2可以看出,以人工合成污水为进水时,JN459在好氧阶段摄取体系中大部分可溶性磷,除磷率可达93.7%,该结果与文献中 M.phosphovorus的除磷效果相近[8]。在市政污水体系中JN459的除磷率为84.4%,这可能与市政污水中碳源成分比较复杂,不适合JN459菌株生长代谢有关。在缺氧阶段初期,体系中溶解磷没有明显回升趋势,说明JN459不具有PAOs可以大量分解PHA并释放可溶性磷以维持菌株生长的显著特征。当维持缺氧状态至180 min时,人工污水和市政污水体系中溶解磷都小幅上升,在240 min时可溶性磷分别是缺氧阶段初始值(120 min)的1.6和2.0倍。,说明 JN459可以分解 Poly-P并获取能量,但相关酶系与转运体系可能需要诱导并且表达水平较低[15-16]。
3 结论
通过本研究可知:
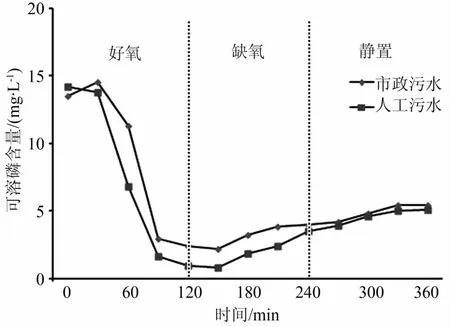
图2 SBR工艺中JN459磷的吸收与释放图
(1)从市政污水处理厂活性污泥中分离到一株聚磷菌JN459,该菌株在好氧条件下可生成Poly-P的异染颗粒,经生理生化实验及16 S rDNA分析,将JN459菌株鉴定为M.phosphovorus。M.phosphovorus是一种革兰氏阳性球菌,在好氧条件下能够积累Poly-P,而在厌氧阶段通过分解Poly-P提供能量帮助细菌吸收有机物,M.phosphovorus不能合成糖原,因此Poly-P是厌氧阶段能量的唯一来源,这与典型的PAOs不同。
(2)好氧条件下M.phosphovorus JN459菌株的除磷率达到93.7%,在缺氧条件下初期无明显的Poly-P分解现象,经过较长时间的诱导后溶解磷含量会上升,说明磷代谢的酶系与转运体系是可诱导的,该结果有助于深入研究M.phosphovorus JN459聚磷代谢的分子调控机制,为将其更好地应用到EBPR系统提供理论基础。
[1]Gebremariam S.Y.,Beutel M.W.,Christian D.,et al.Research advances and challenges in themicrobiology of enhanced biological phosphorus removal-a critical review[J].Water Environmental Research,2011,83(3):195-219.
[2]Zheng X.L.,Sun P.,Han J.,et al.Inhibitory factors affecting the process of enhanced biological phosphorus removal(EBPR)-A mini-review[J].Process Biochemistry,2014,49(12):2207-2213.
[3]Ehab M.R.,Maha M.E.,Mohamed A.H.,et al.Application of contact stabilization activated sludge for enhancing biological phosphorus removal(EBPR)in domestic wastewater[J].HBRC Journal,2014,10(1):92-99.
[4]Oehmen A.,Lemos P.C.,Carvalho G.,etal.Advances in enhanced biological phosphorus removal:from micro tomacro scale[J].Water Research,2007,41(11):2271-2300.
[5]Ong Y.H.,May Chua A.S.,Fukushima T.,et al.Hightemperature EBPR process:The performance,analysis of PAOs and GAOs and the fine-scale population study of Candidatus“Accumulibacter phosphatis”[J].Water Research,2014,64(1):102-112.
[6]Tian W.D.,Lopez-Vazquez C.M.,LiW.G.,et al.Occurrence of PAOI in a low temperature EBPR system[J].Chemosphere,2013,92(10):1314-1320.
[7]张志斌,张晓全,陶俊杰,等。我国城市污水处理中存在的问题及对策[J].山东建筑大学学报,2007,22(2)174-176.
[8]He S.,McMahon K.D..Microbiology of“Candidatus Accumulibacter”in activated sludge[J].Microbial Biotechnology,2011,4(5):603-619.
[9]孙雪,朱为静,王亮,等.强化生物除磷系统主要微生物及其代谢机理研究进展 [J].应用生态学报,2014,25(3):892-902.
[10]徐立杰,郭春艳,彭永臻,等.强化生物除磷系统的微生物学及生化特性研究进展[J].应用与环境科学学报,2011,17(3):427-434.
[11]东秀珠,蔡妙应.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12]Lul′sa S.,Serafim P.C.,Lemos C.L.,et al.Methods for detection and visualization of intracellular polymers stored by polyphosphate accumulating microorganisms[J]. Journal of Microbiological Methods,2002,51(1):1-18.
[13]Nakamura K.,Hiraishi A.,Yoshimi Y.,et al.Microlunatus phosphovorus gen. nov., sp. nov., a new gram-positive polyphosphate-accumulating bacterium isolated from activated sludge[J].International Journal of Systematic Bacteriology,1995,45(1):17-22.
[14]Mino T..Microbial selection of polyphosphate-accumulating bacteria in activated sludge wastewater treatment processes for enhanced biological phosphate removal[J].Biochemistry(Mosc),2000,65(3):341-348.
[15]Kawakoshi A.,Nakazawa H.,Fukada J.,et al.Deciphering the genome of polyphosphate accumulating Actinobacterium Microlunatus phosphovorus[J].DNA Research,2012,19:383-394.
[16]Santos M.M.,Lemos P.C.,Reis M.A.,et al.Glucose metabolism and kinetics of phosphorus removal by the fermentative bacterium Microlunatus phosphovorus[J]. Applied and Environmental Microbiology,1999,65(9):3920-3928.

