青岛市兔源产ESBL大肠杆菌的耐药性及多重耐药调控基因SoxS序列的分析
李明勇,宋大伟,王志全
(1.青岛康大生物科技有限公司,山东青岛 266400;2.青岛市黄岛畜牧局海青动检站,山东青岛 266415)
青岛市兔源产ESBL大肠杆菌的耐药性及多重耐药调控基因SoxS序列的分析
李明勇1,宋大伟1,王志全2
(1.青岛康大生物科技有限公司,山东青岛 266400;2.青岛市黄岛畜牧局海青动检站,山东青岛 266415)
[目的]了解兔源产ESBL大肠杆菌耐药特点,为掌握其造成的耐药性危害提供数据参考。[方法]2015年3-4月从青岛4个养兔场采集118份兔粪便棉拭子,进行大肠杆菌分离,并检测对16种抗生素的耐药谱,及对多重耐药调控基因SoxS携带率。[结果]从118份兔粪便棉拭子分离获得68株大肠杆菌,确证筛选出47株产ESBL大肠杆菌,占兔源大肠杆菌的69.1%。药敏结果显示所有产ESBL大肠杆菌菌株耐药性较强且呈现多重耐药,仅对碳青霉烯类药物敏感率100%。兔源产ESBL大肠杆菌多重耐药调控基SoxS携带率为100%,且不同动物源性产ESBL大肠杆菌的多重耐药调控基因同源关系较近。[结论]青岛地区兔源产ESBL 大肠杆菌分离率高且耐药谱广,多重耐药调控基因SoxS携带率高,主要涉及到细菌主动外排泵出机制,使得大肠杆菌对抗生素的敏感性中起到了至关重要的作用,本研究对抗生素在临床中的应用起指导意义。
兔源;大肠杆菌;超广谱β-内酰胺酶(ESBL);SoxS基因;多重耐药性
1 引言
随着临床上大量抗生素的使用和滥用,造成越来越多的大肠杆菌开始出现多重耐药现象,使临床上抗感染治疗更加困难。而产超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs) 是 其多重耐药的主要机制之一[1]。超广谱β-内酰胺酶能水解第一、第二、第三代头孢菌素(如头孢他啶、头孢噻肟、头孢曲松)及单氨类抗生素(如氨曲南)[2]。产ESBL大肠杆菌呈现多重耐药的耐药机制多涉及到主动外排泵出机制,可引起细菌对多种抗生素高频率、高水平耐药[3]。AcrAB-TolC外排系统是大肠杆菌最主要的主动外排系统,是细菌增加抗生物外排的一种主要途径,可排除多种抗生素[4-7]。外排系统表达水平受多种调控因子的调节,如AcrR、MarA、MppA、RobA和SoxS等,其中SoxS引起的TolC、AcrAB、micF和rimK基因的激活改变了大肠杆菌对一系列抗生素的敏感性,从而使得耐药菌株的出现率增加[8-10]。
大肠杆菌病对兔的危害表现在造成1月龄内仔兔腹泻,采食量降低。因此,了解兔源产ESBL大肠杆菌株的耐药谱,及多重耐药调控基因SoxS的序列携带情况,对临床上合理利用抗菌药物、增强抗感染治疗效果意义重大。
2 材料
2.1 病料
2015年3月- 4月从山东青岛某四个兔场采集仔兔的肛门棉拭子118份。
2.2 主要试剂
伊红美蓝琼脂、麦康凯琼脂、Mueller-Hintion琼脂培养基均购自青岛高科园海博生物技术有限公司。
2.3 药敏片
头孢他啶(30µg/片)、头孢他啶/棒酸(10µg/片)、头孢噻肟(30µg/片)、头孢噻肟/棒酸(10µg/片)、复方新诺明(25µg/片)、氨苄西林(10µg/片)、氯霉素(30µg/片)、链霉素(10µg/片)、卡那霉素(30µg/片)、庆大霉素(10µg/片)、氟苯尼考(30µg/片)、萘啶酸(30µg/片)、阿莫西林(20µg/片)、头孢噻吩(30µg/片)、诺氟沙星(10µg/片)、氨曲南(30µg/片)、环丙沙星(5µg/片)、四环素(30µg/片)均购自杭州微生物试剂有限公司,使用时所有药敏纸片均在有效期内。
3 方法
3.1 样品稀释与大肠杆菌分离
500µL的生理盐水稀释兔粪便棉拭子,混匀后,用接种于含有头孢噻肟的伊红美蓝培养基,37℃培养18~24h。挑取伊红美蓝培养基上具黑色中心有金属光泽或无光泽的典型单个菌落,接种于麦康凯培养基,37℃培养18~24h。挑取麦康凯培养基上的粉红色单个菌落,LB液体增菌培养37℃ 12~16h。-20℃保存备用。
3.2 16S rRNA PCR鉴定大肠杆菌
通用大肠杆菌16S rRNA引物,上游F:5'-AGAGTTTGATCCTGGCTCAG-3', 下 游 R:5'-GGCTACCTTGTTACGACTT-3'[11]。按细菌基因组DNA提取试剂盒操作说明提取DNA。PCR扩增程序:94℃预变性5min;94℃变性45s,55℃退火45s,72℃延伸90s,30个循环;72℃延伸10min。PCR产物经琼脂糖凝胶电泳鉴定。PCR产物送至上海生工生物工程股份有限公司测序。
3.3 产ESBL大肠杆菌的确证及药敏实验
菌液调至0.5McFarland浊度,用灭菌的棉拭子均匀涂布于M-H培养基上。平板上同时贴放头孢他啶、头孢他啶/棒酸、头孢噻肟、头孢噻肟/棒酸,37℃,18~24h。根据CLSI2009标准,对产ESBL菌株表型确证判定。检测产ESBL阳性菌株对其余14种抗生素的敏感性。
3.4 重耐药调控基因SoxS的检测与克隆
根据已发表文章中大肠杆菌的 SoxS 基因序列的上游引物 F为:5'-CGGGGTACCATGTCCCATCAGAAAAT-3';下游引物R为:5'-GCATCTAGATTACAGGCGGTGGC-3',上、下游引物分别含有KpnⅠ和XbaⅠ酶切位点[12]。PCR反应条件:预变性:95℃ 5min;变性:95℃ 30s,退火:38℃ 45s,延伸:72℃ 60s,30 Cycles;延伸:72℃ 10min。PCR产物经琼脂糖凝胶电泳鉴定。回收目的DNA基因,将目的片段与pMDl8-T载体连接 16℃ 30min,转化DH5α感受态细胞。质粒PCR鉴定为阳性测序。
3.5 多重耐药调控基因Soxs序列测定及进化分析
通过将序列在NCBI上对比找出四株同源性较高的菌株SoxS序列和本实验室保存的鸡源序列,利用MEGA5.1软件进行分析。
4 结果
4.1 大肠杆菌的分离鉴定
对118份兔粪便棉拭子初分离的大肠杆菌进行16S rRNA保守区域基因的扩增,获得68株大肠杆菌。目的条带大约在1524bp,并且测序结果与NCBI中大肠杆菌16S rRNA的保守区域一致(图1)。
图1 产ESBL大肠杆菌16S rRNA PCR扩增
4.2 产ESBL大肠杆菌的耐药谱
经产ESBL确证实验确定,获得47株产ESBL大肠杆菌,分离率为69.1%。由药物敏感实验结果(图2)可知,所有产ESBL的大肠杆菌呈现多重耐药性,对大多数抗生素耐药。特别是对青霉素类和第一、三代头孢菌素类抗生素,如对氨苄西林、头孢噻吩、头孢噻肟的耐药率达100%。所有菌株对其他种类抗生素的耐药性同样非常高,耐药率在68.1%~97.8%之间。仅对碳青霉烯类抗菌药物(亚胺培南、美罗培南)均表现100%敏感。

图2 产ESBL大肠杆菌耐药率柱状图
4.3 多重耐药调控基因SoxS的携带情况
在47株产ESBL大肠杆菌中均携带SoxS基因,携带率为100%(图3)。
图3 部分菌株多重耐药调控基因SoxS扩增产物电泳图
4.4 多重耐药调控基因SoxS基因序列分析
同一兔场(ZC2)中产ESBL大肠杆菌菌株SoxS基因序列同源性均为100%,仅选择一株进行序列分析。由图4与表1可知,兔场1和兔场3分离产ESBL大肠杆菌菌株(ZC1和ZC3)的多重耐药调控基因SoxS的序列亲缘关系为100%。兔场2分离的产ESBL大肠杆菌菌株(ZC2)的SoxS序列亲缘关系和实验室保存的兔源产ESBL大肠杆菌菌株(JC)的也较近,为99.1%。同时,ZC1菌株和JC菌株的SoxS基因亲缘关系为98.8%。SoxS基因核苷酸序列比较可以看出核苷酸位点变化率低,其中ZC2和JC菌株的52位氨基酸发生相同突变(Ala-Thr)。
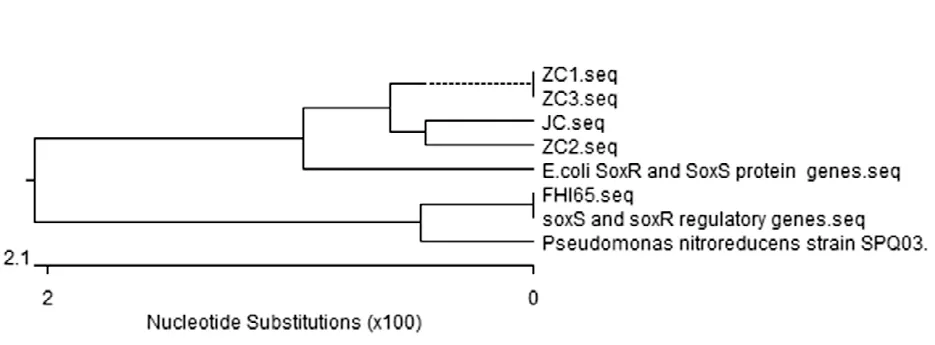
图4 不同菌株SoxS序列系统发育树

表1 大肠杆菌SoxS基因核苷酸序列比较分析
5 讨论
产超广谱β-内酰胺酶的菌株1983年被Klieb C首次报道后,在患者、畜牧和环境中不断检出,且这类菌株的耐药谱广,其造成的感染会给临床治疗带来极大的困难。本次实验在118份兔粪便棉拭子中,分离筛选47株产ESBL大肠杆菌,分离率高。由此可见,产ESBL大肠杆菌在兔场中已普遍存在。兔源产ESBL大肠杆菌对多种抗生素耐药率都非常高。青霉素类和头孢菌素类都属于β-内酰胺类,这些药物均是超广谱β-内酰胺酶所能作用水解的。同时,对磺胺类和四环素类也表现出高耐药性,耐药率高达95% 。氨基糖苷类、喹诺酮类和氟喹诺酮类耐药率都在75%以上,所以这三类药物用于治疗大肠杆菌病的效果不佳。但所有菌株都对碳青霉烯类抗菌药物表现敏感,这是因为我国禁止兽医临床应用碳青霉烯类抗菌药物。
兔源产ESBL大肠杆菌对多重耐药调控基因SoxS携带率高,其主要与耐药机制的外排系统有关,可调控相关耐药基因的激活,改变大肠杆菌对抗生素的敏感性,使耐药菌株增加。从不同菌株SoxS序列分析来看,兔场内部和兔场之间的产ESBL大肠杆菌多重耐药调控基因SoxS序列亲缘关系都非常近,核苷酸和氨基酸的位点变化率低。与实验室保存鸡源、人源大肠杆菌中SoxS基因序列的同源性高,核苷酸变化位点相同,因此SoxS基因的核苷酸与氨基酸序列变化可能与动物源性无关[12-13]。不同物种来源的SoxS序列关系相似,这说明不同动物源性该调控基因的可能存在互相传播,这种机制还有待于进一步研究。
总之,青岛地区兔源产ESBL大肠杆菌存在率非常高,且对多种抗生素具有耐药性,多重耐药调控基因SoxS携带率高。这是由于抗菌药物的滥用,已造成此类菌株形成临床感染治疗上、抗生素的选择将受到更大的限制[15]。所以严肃用药原则,是控制或延缓细菌产生耐药性的重要环节;同时需要严格控制兔场的养殖环境卫生,加强对兔场养殖环境的监控,净化兔场水源和空气,为防止耐药菌株通过水源和空气传播提供强有力的保障。
Analysis of Antibiotic Susceptibility and Multidrug Resistant SoxS Gene of ESBL-producing Escherichia coli strains from Rabbit
Li Mingyong1,Song Dawei1,Wang Zhiquan2
(1.Qingdao Kangda Bioscience Company Ltd,Huangdao,Qingdao,Shandong 266400;
2. Haiqing Animal Quarantine Station,Huangdao Animal Husbandry Bureau,Qingdao,Shandong 266415)
[Objective]To understand the antimicrobial characteristics of ESBL-producingE. colistrains from rabbits and provide important data for reference to know their antimicrobial hazard.[Methods]118 rabbit fecal samples were taken from 4 rabbit farms in Qingdao region forE. coliisolation and anti-microbial identification.[Results]68E. colistrains were isolated from the 118 rabbit fecal samples with 47 ESBL-producingE. colistrains,all of which were multi-drug resistant but sensitive to carbapenems. Polymerase chain reaction and cloning of the SoxS gene demonstrated that the multi-drug resistant SoxS gene carrying rate of ESBL-producingE. colistrains from rabbit was 100%.[Conclusion]The isolation rate of ESBL-producingE. colistrains from Qingdao region was high with wide drug resistance spectrum. High rate of multi-drug resistant SoxS gene was mainly involved in the bacterial ef fl ux pump mechanism,playing key role in sensitivity ofE. colito antibiotics. The study provided guidance for clinical application of antibiotics.
rabbit;Escherichia coli;extended-spectrum β-lactamase(ESBL);SoxS gene;multiple antibiotic resistance
S852.61+2
A
1005-944X(2015)10-0028-04
[1]段玉平,徐兴然,曾忠良,等. 猪源大肠杆菌整合子与耐药性的相关性研究 [J]. 中国兽药杂志,2009,43(5):24-26.
[2]Amyes S G B,Gemmell C G. Antibiotic Resistance [J].J Med Microbiol,1997,46(6):436-470.
[3]何敏,易本驰,陈敏. 猪大肠杆菌对抗生素耐药性的研究进展[J]. 黑龙江畜牧兽医,2011(2):27-29.
[4]Ma D, Cook D N, Hearst J E, et al. Efflux pumps and drug resistance in Gram-negative bacteria[J].Trends Microbiol,1994,2(12):489-493.
[5]Nikaido H.Multidrug effiux pump of Gram-negative bacteria[J].J Bacteriol,1996,178(5):5853-5859.
[6]Sulavik M C, Houseweart C, Cramer C,et a1.Antibiotic susceptibility profiles ofEscherichia colistrains lacking multidrug efflux pump genes[J].Antimicrlb Agents Chemother,2001,45(4):1126-1136.
[7]Paulsen I T,Brown M H,Skurray R A.Proton dependent multidrug ef fl ux systems[J].Microbiol Rev,1996,60(4):575-608.
[8]Grkovic S,Brown M H,Skurray RA.Regulation of bacterial drug export systems[J].Microbiol Mol Biol Rev,2002,66(4):671-701.
[9]Barbosa T M,Levy S B.Differential expression of over 60 chromosomal genes inEscherichia coliby constitutive expression of MarA[J].J Bacheriol,2000,182(12):3467-3474.
[10]Warner D M,Levy B.Different effects of transcriptional regulators MarA,SoxS and Rob on susceptibility ofEscherichia colito cationic antimicrobial peptides(CAMPs):Robdependent CAMP induction of the marRAB operon[J].Microbiology,2010,156(2):570-578.
[11]杨滴,王耀兵,李冬梅,等.粪便中大肠埃希菌的分离鉴定[J]. 微生物学杂志,2007,27(3):1-5.
[12]马红霞,于晓颖,刘玉堂,等.不同动物源性大肠杆菌多重耐药调控基因SoxS的同源性分析[J]. 中国兽医杂志,2008,44(8):33-34.
[13]于晓颖,刘玉堂,丛薇,等.大肠杆菌多重耐药调控基因SoxS的克隆及其原核表达[J]. 中国兽医学报,2010,30(10):1318-132.
胡藕祥)

