羊蹄叶过氧化物酶的纯化和酶学性质研究
黄国文
湖南科技学院生命科学和化学工程学院,永州 425199
羊蹄(Rumex japonicusHoutt)生于山野、路旁、湿地,在我国分布广泛,是多年生蓼科酸膜属野生草本植物,生长茂盛,花期3~4月,果期5~6月,可作野菜食用和药用。过氧化物酶(POD)存在于动物、植物和微生物体内,是一类以血红素为辅基的氧化还原酶,一般含有Fe 和Cu 等金属离子,催化由过氧化氢参与的多种物质的氧化还原反应。在植物中参与生长素代谢,调节细胞壁的生物合成,调节植物的生长和发育[1];参与植物的抗性,包括抗干旱、抗盐碱、抗病等机能,是植物的重要保护酶之一。在植物抗病过程中,过氧化物酶积极作用,产生大量活性氧来抑制和杀死入侵的病菌。同时,它可使O2、H2O2等转变为活性较低的物质,消除植物体内生物氧化产生的有毒物质,使植物组织及细胞得到保护[2];也参与果实的褐变过程,催化酚类物质、谷胱甘肽、抗坏血酸的氧化,使果皮变色。在生产实践上,外源过氧化物酶能够促进植物的生长[3],用于酚类废水的处理[4]和酶联免疫检测[5]。本文采用磷酸缓冲液浸提法研究羊蹄叶中过氧化物酶的提取工艺条件及其酶学性质,为理解羊蹄植物的生长特性和酶学应用提供依据。
1 材料与方法
1.1 材料
1.1.1 原料
湖南科技学院周围田间生长茂盛的羊蹄叶片。本材料对照中国高等植物图鉴[6]和中国植物志[7]中种的描述进行识别认定。
1.1.2 主要仪器
电子天平(津岛仪器),722B 型分光光度计(上海析谱仪器有限公司),恒温水浴锅(天津比朗实验仪器制造有限公司)。
1.1.3 主要试剂
愈创木酚、H2O2、Na2HPO4、Na2HPO4、NaOH、HCl 等为国产分析纯。
1.2 方法
1.2.1 羊蹄叶POD 浸提条件研究
1.2.1.1 提取羊蹄叶POD 的单因素实验
以0.02 mol/L 磷酸缓冲液pH 9 为提取液,浸提时间为30 min,浸提温度为35 ℃,料液比为1∶10为提取酶一次的条件,变动其中的因素:料液比为1∶5、1∶10、1∶20、1∶30、1∶40、1∶50,0.02mol/L 磷酸缓冲液pH 为8、9、10、11、12,温度为20、25、30、35、40℃,浸提时间为15、30、45、60 和75 min 来提取和测定浸出酶活性,确定适合浸提因素。
1.2.1.2 正交实验
根据单因素实验确定的条件,通过L9(34)正交实验得出最佳浸提条件。
1.2.2 酶活性和蛋白质含量测定方法
用愈创木酚作为底物的比色法[8]测定提取液的POD 活性。以每克材料提取的POD 在每分钟内A470 增加0.01 为1 个酶活性单位(U)。用双缩脲法[9]测定提取液的蛋白质含量,以小牛血清蛋白制作蛋白标准曲线为Y=0.2282X-0.0008,R2=0.9993。
1.2.3 酶的纯化
1.2.3.1 pH 沉淀
在最佳条件下提取羊蹄叶片的蛋白质溶液,用稀盐酸调pH 成2、3、4、5、6,在冰水中放置半小时,4000 rpm 离心20 min,收集沉淀,用等量的pH9 的磷酸缓冲液溶解后测定酶活性和蛋白质含量,计算比活力。比活力等于酶活性除以蛋白质重量(mg)。
1.2.3.2 丙酮沉淀
取最佳pH 沉淀的蛋白经过透析后加入0.8、1.0、1.2、1.4、1.6、1.8 体积预冷(-20 ℃)的丙酮,-20 ℃冰箱中静置90 min,低温离心去沉淀,通过冷冻干燥去除丙酮,沉淀用等体积磷酸缓冲液溶解,测定蛋白含量和酶活性,计算比活力。另外,测定各阶段酶的纯度、纯化倍数和酶活性回收率。其中过氧化物酶纯度用Rz 值表示[10],Rz 值=A403/A280,A403代表血红素辅基的吸收,A280代表蛋白质的吸收;纯化倍数是酶纯化过程中每个步骤获得酶的比活力与粗酶液中酶比活力的比值;酶活回收率是每个纯化步骤中的酶活性与粗酶液的酶活性的比值百分数。
1.2.4 一些化合物对酶活性的影响
在测定酶活性的反应体系中分别添加CuSO4、ZnSO4、MgSO4、CaCl2、KCl、NaCl 至终浓 度6.26、12.5、25、50、100、200、400、800 mmol/L,以煮沸的酶作为对照,测定酶活性,考察其对POD 活性的影响。
1.2.5 POD 米氏常数的测定
取0.04%过氧化氢0.25、0.5、1、1.5、2 mL,分别放入5 个干净的试管中,配制测定酶活性方法反应体系,体系中过氧化氢浓度分别为0.59、1.18、2.35、3.53、4.71、5.88(×10-3)mmol/L,测定酶的反应速度。取0.25、0.5、1、1.5、2.0 mL 浓度为0.05 mol/L 愈创木酚放入5 个干净的试管中,用磷酸缓冲液补足到3.9 mL,分别加入1.0 mL 2% H2O2和0.1 mL 酶液,配制的愈创木酚浓度分别为2.5、5、10、15、20 mmol/L,然后测定POD 的反应速度,用双倒数作图法(Lineweaver-Burk 法),计算Km。
2 结果与分析
2.1 羊蹄叶POD 提取条件的研究
2.1.1 料液比对POD 活性的影响
料液比是影响酶浸出的一个重要因素(图1A),料液比为1∶30 时POD 的活性最大,过高或者过低酶的活性较小,这可能是料液比影响酶成分的浸出和稳定。因此选择1∶30、1∶40 和1∶50 作为料液比作为优化条件。
2.1.2 提取液pH 对POD 活性的影响
提取液pH 对POD 浸出有较大影响(图1B)。在提取液pH9 时POD 活性最大,说明溶液pH 影响酶的溶出和活性,因此选择选择提取液pH 为8、9和10。
2.1.3 浸提温度对POD 活性的影响
浸提温度对酶活性有较大影响(图1C),35 ℃时POD 活性最高,温度过低和过高酶活性较小,说明温度过低会影响酶的浸出,温度过高会引起酶的变性而失活。因此浸提温度可以选择30、35 和40℃作为优化条件。
2.1.4 浸提时间对POD 活性的影响
材料浸泡时间的长短会影响酶的浸出和活性。浸提时间在30 min 时POD 活性最大(图1D),浸泡材料超过30 min 以后POD 活性减小,说明在35 ℃保温较长时间酶的稳定性降低,要么变性要么降解,因此选择15、30、45min 作为优化条件。

图1 料液比(A)、提取液pH(B)、提取温度(C)及提取时间(D)对羊蹄叶POD 活性的影响Fig.1 Effects of ratio of material to buffer (A),buffer pH (B),extraction temperature (C)and extraction duration (D)on the activity of PODs from R.japonicas leaves
2.1.5 正交实验
根据料液比、提取液pH、浸提温度、浸提时间这四个单因素实验结果,设计正交试验L9(34),以浸出的POD 活性为指标,结果和分析见表1。由极差分析可知,这四个因素对POD 活性影响的程度依次是浸提时间>浸提温度>提取液pH >料液比,最优水平组合为料液比为1∶40,提取液pH 为9,浸提温度是35 ℃,浸提时间为30 min。
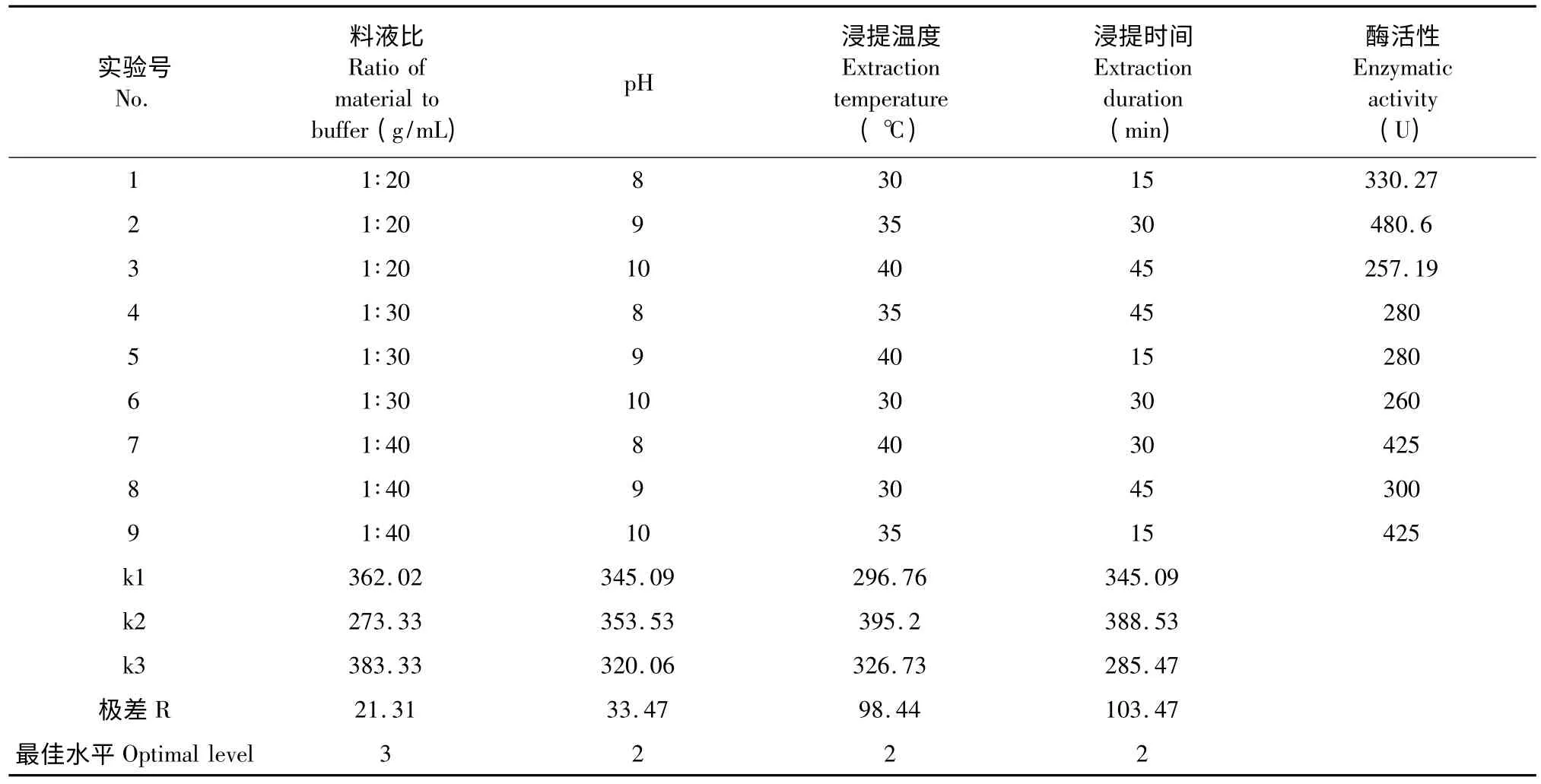
表1 羊蹄叶POD 提取的正交实验结果和分析Table 1 L9(34)experimental results and analysis of extracting PODs from R.japonicus leaves
2.2 pH 沉淀对羊蹄叶POD 的影响
在最佳条件下提取1 g 羊蹄叶片POD 的溶液。用1 mol/L HCl 调节其溶液为酸性pH 值,经过离心,收集沉淀测定了蛋白沉淀量,用等体积pH 9 缓冲液溶解沉淀后测定酶的活性(图2)以及比活力(图3),结果显示,在pH 为4、5、6 时蛋白沉淀量较高,在pH5 时酶活性最大;酶的比活力可以作为酶纯度的度量指标,POD 酶的比活力在pH2、pH3 和pH5 时较大,说明这三种提取液中酶的纯度较高,但由于沉淀蛋白质的数量pH5 时较多,重量为1.69 mg,所以调节提取液pH 为5 时的沉淀蛋白质可以用于进一步纯化POD 酶。

图2 不同pH 影响蛋白沉淀量和酶活性Fig.2 Effects of pH values on protein precipitation amount and enzymatic activity

图3 不同pH 沉淀的酶比活力Fig.3 The specific activity of POD precipitated by different pHs
2.3 丙酮沉淀对羊蹄叶POD 酶的影响
羊蹄叶1 g 的提取液经过pH5 沉淀获得的蛋白质,用pH9 的磷酸缓冲液溶解,-4 ℃透析一夜,透析液中加入不同体积的-20 ℃预冷的丙酮,放入-20 ℃冰箱中沉淀1.5 h,4500 rpm 离心15 min,收集沉淀,测定蛋白质重量,溶解沉淀经过透析后测定吸光度的变化,计算酶的活性(图4)和比活力(图5)。结果表明,随着丙酮体积的增加蛋白质沉淀量逐渐增高,POD 活性在1 倍体积的丙酮沉淀后最高,酶的比活性在0.8 和1 倍体积的丙酮沉淀后较高,说明用1 倍和0.8 体积的丙酮分级沉淀的POD 比活力较高,纯度较好。
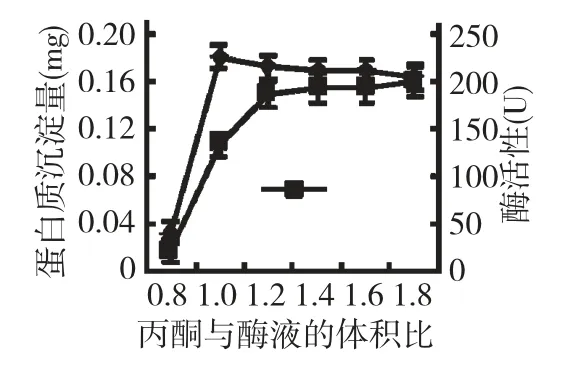
图4 丙酮调节蛋白沉淀量和酶活性Fig.4 Acetone adjusting protein precipitation amount and enzymatic activity

图5 不同体积的丙酮沉淀的酶比活力Fig.5 The specific activity of POD precipitated by different volumes of acetone
为了研究羊蹄叶POD 酶学性质,大量提取和纯化了POD。称取材料50 g,用200 mL pH9.0 的磷酸缓冲液提取了过氧化物酶的粗酶液。粗酶液依次经过pH5.0 沉淀和1 倍体积的丙酮沉淀纯化了该酶,纯化结果分析见表2。可知,50 克羊蹄叶经过pH沉淀和丙酮沉淀后获得5.3 mg 的过氧化物酶,纯化倍数为4.8,回收率为40.8%;丙酮沉淀比pH 沉淀的酶的纯度更高。把丙酮沉淀的过氧化物酶溶解于100 mL pH9.0 的磷酸缓冲液中经过透析后用于其酶学性质研究。

表2 羊蹄叶POD 纯化过程和结果分析Table 2 Purification processes and results of PODs from R.japonicus
2.4 一些化合物对酶活性的影响
测定一些化合物对已经纯化的羊蹄叶POD 活性影响(图6)。结果表明:随着CuSO4浓度的增加,过氧化物相对活性增加,说明CuSO4对羊蹄叶POD活性有激活作用;ZnSO4、MgSO4、CaCl2、KCl、NaCl 等化合物在各种浓度条件下POD 酶活性(小于250U)都低于正常提取条件下的酶活性,说明这些化合物对酶活性有抑制作用。
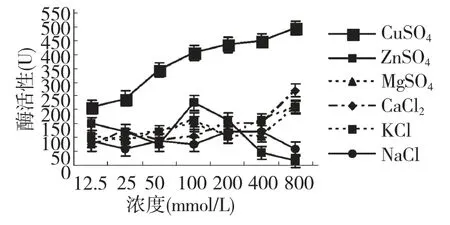
图6 一些无机盐对羊蹄叶POD 活性的影响Fig.6 Effects of inorganic salts on the POD activity in R.japonicas leaves
2.5 POD 米氏常数的测定
在测定POD 的反应体系中,研究H2O2和愈创木酚对POD 的影响。随着愈创木酚浓度的增加,酶活性增加呈现先上升较快后上升缓慢的曲线(图7)。以酶活性快速增加的愈闯木酚浓度(2.5~10 mmol/L),单位时间内A470 的变化值作为反应速度,用双倒数作图,计算其Km 为0.12 mmol/L。随着H2O2浓度的增加,酶活性先逐渐增加后逐渐减少(图8),说明高浓度H2O2能够氧化和破坏POD从而抑制酶的活性。以POD 酶活性增加的H2O2浓度(0.59 ×10-3~5.88 ×10-3mmol/L)的倒数和反应速度的倒数作图,计算其Km 为0.62 ×10-3mmol/L。POD 以过氧化氢为底物的米氏常数远远小于以愈创木酚为低物的米氏常数,所以POD 对过氧化氢的亲和力远远大于对愈创木酚的亲和力。
3 讨论
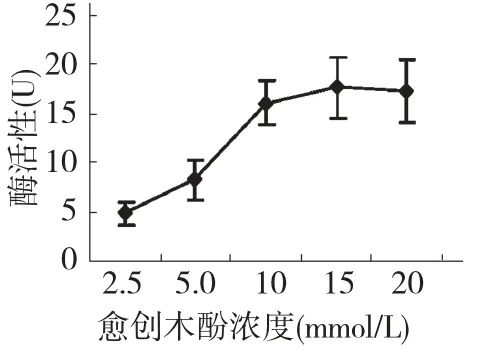
图7 愈创木酚浓度对POD 活性的影响Fig.7 Effects of guaiacol on the POD activity

图8 H2O2浓度对羊蹄叶POD 活性的影响Fig.8 Effects of H2O2on the POD activity
本文研究了用碱性缓冲溶液提取羊蹄叶中POD 的过程,确定了最佳提取工艺条件。研究了酸性pH 和丙酮沉淀POD 的作用,确定了纯化方案,并研究了其酶学性质。目前,已报道的提取植物POD的方法中,采用酸性磷酸缓冲液[11,12]或中性偏碱性磷酸缓冲液[13,14]来抽提POD。根据自然界中POD的等电点有酸性、中性和碱性[13],本文用碱性缓冲液提取羊蹄叶POD。通过单因素实验和正交实验表明,羊蹄叶POD 的最佳提取条件为料液比为1∶40,提取液pH 为9,浸提温度是35 ℃,浸提时间为30 min。这些因素对提取POD 的影响程度依次是浸提时间>浸提温度>提取液pH >料液比。通过对提取液POD 的纯化表明,在调节提取液pH5时,沉淀的蛋白质量多和酶的比活力大;用丙酮沉淀时,以1 倍体积的丙酮沉淀的POD 的量较多,酶的比活力较大,所以可以用pH5 和1 倍体积的丙酮来纯化提取液的POD,用0.8 倍体积丙酮可以进一步纯化提取的POD。POD 能催化过氧化氢氧化多种酚类物质并形成褐色产物[12]。用不同浓度的愈创木酚与羊蹄叶POD 在常温、pH9 的条件下反应,测得羊蹄叶POD 的Km 值为0.12mmol/L;它比富士苹果POD 的Km(129.09 mmol/L)[11]数值小,比冬枣果实POD 的Km(0.2516 mol/L)[15]小很多,说明羊蹄叶POD 氧化酚类物质的能力比富士苹果POD的氧化能力强,比冬枣果实POD 氧化能力更强;用不同浓度的过氧化氢与羊蹄叶POD 在同样条件下反应,测得羊蹄叶POD 的Km 值为0.62 ×10-3mmol/L;它比甘蔗苗POD 的Km(0.038 mol/L)[12]和莲藕POD 的Km(9 mmol/L)[14]以及芦荟POD 的Km(34 mmol/L)[16]要小很多,说明羊蹄叶POD 氧化H2O2的能力比芦荟POD 和甘蔗苗POD 以及莲藕POD 的氧化能力要大得多。不同化合物对羊蹄叶片POD的活性有影响.其中,CuSO4对羊蹄叶片POD 活性有激活作用;ZnSO4、MgSO4、CaCl2、KCl 和NaCl 对POD 活性有抑制作用。
由于羊蹄叶POD 对H2O2非常敏感,可以防止H2O2对植物的损伤,并且它的活性受到多种无机盐的抑制,所以可以用于植物的水培生根和幼苗生长。羊蹄叶中POD 能催化H2O2氧化一些多酚类物质合成木质素促进植物生长,同时羊蹄叶中POD 对H2O2的亲和力远远大于对愈创木酚的亲和力,说明这种酶可以用于在逆境中植物或者组织块的生长来保护植物组织。本文研究羊蹄叶片POD 的分离纯化和其酶学性质,对理解羊蹄植物的在冬天能够正常生长的习性具有重要的意义并进一步运用其酶学性质奠定了基础。
1 Yuan MD (原牡丹),Su Y (苏艳),Hou ZX (侯智霞),et al.Changing characteristics of auxin and the relative enzymes during the process of strawberry fruit development.J Beijing For Univ(北京林业大学学报),2009,31:169-175.
2 Jiang XL (蒋选利),Li ZQ (李振岐),Kang ZS (康振生).The recent progress of research on peroxidase in plant disease resistance.J Southwest A&F Univ,Nat Sci(西北农林科技大学学报,自科版),2001,29:124-129.
3 Li JJ (李建军),Wang L (王琳),Li XJ (李小娟),et al.Effects of the Radish peroxidase on the growth in tomato seedling.J Henan Norm Univ,Nat Sci(河南师范大学学报,自科学),2006,34:132-135.
4 Zhang LH (张丽华),Xue WH (薛万华),Bai PY (白培万),et al.Application of peroxidase in phenolic wastewater pollution control.J Shanxi Datong Univ,Nat Sci(山西大同大学学报),2009,25(6):44-47.
5 Gong FC,Liu P,Lin YY,et al.An enzyme-catalyzed reaction system using puerarin as substrates for Horseradish peroxidase and its application in immunoassays.Acta Chim Sin,2012,70:859-863.
6 Institute of Botany of the Chinese Academy of Sciences (中国科学院植物研究所).Iconographia Cormophytorum Sinicorum Tomus I (中国高等植物图鉴I).Beijing:Science Press,1972.571.
7 Flora of China Editorial Committee (中国科学院中国植物志编辑委员会).Flora of China (中国植物志).Beijing:Science Press,1998,25:156.
8 Xiao LT (萧浪涛),Wang SG (王三根).Technique of Plant Physiology Experiments (植物生理学实验技术).Beijing:China Agricultural Press,2005.103-104.
9 Chen JH (陈钧辉),Li J (李俊),Zhang TP (张太平),et al.Biochemistry Experiments,the Fourth Edition(生物化学实验,第四版).Beijing:Science Press,2008.18-21.
10 Xu ZY(徐芝勇),Yan Q(严群),Qiang Y(强毅),et al.Purification and enzymology property investigation on soybean peroxidase.J Chin Cereals Oils Assoc(中国粮油学报),2006,21(2):82-85.
11 Wang Q (王倩),Liu W (刘伟),Liu CM (刘成梅),et al.Characterization and effect of dynamic high-pressure microfluidization on peroxidase from fuji apple.Food Machine(食品与机械),2011,2:4-7.
12 He P (何平),Shi WP(施伟平),Fu XL(傅雪琳),et al.The purification of peroxidase from sugarcane seeding and its characteristic.J Shanghai Jiaotong Univ,Agric Sci(上海交通大学学报,农科版),2003,21(2):131-134.
13 Ding XY (丁薪源),Cao JK (曹建康).Characteristics of peroxidase from fruit and vegetable research progress.Food Sci Tech(食品科技),2012,37(10):62-66.
14 Que RQ(阙瑞琦),Zhang LL(张丽丽),Guo XL(郭小路),et al.Isolation,purification and properties of peroxidase from lotus (Nelumbo nuciferaGaertnl)root.J Southwest Univ,Nat Sci(西南大学学报,自科版),2007,29(12):63-67.
15 Ding XY (丁薪源),Zhou NN (周娜娜),Zhao YM (赵玉梅),et al.Characteristics of peroxidase from Zizyphus jujuba Mil.Food Sci Tech(食品科技),2012,4:31-34,39.
16 Zhu H (朱鸿),Li XY (李想韵),Deng Y (邓玉),et al.Isolation,purification and enzymological characterization of catalase from Aloe.Food Sci(食品科学),2010,31):206-210.

