近红外漫反射光谱法快速测定当归中阿魏酸及亚油酸
顾志荣,张亚亚,丁军霞,王亚丽*,孙宇靖
1甘肃中医学院科研实验中心;2 甘肃中医学院当归研究所,兰州 730000
当归[Angelica sinensis (Oliv.)Diels]为伞形科多年生草本植物,主产于甘肃定西及陇南一带,云南、湖北亦有栽培[1]。现代研究表明,挥发油、有机酸及多糖[2]是其最主要的药效组分。当归中有机酸主要有阿魏酸、亚油酸、烟酸等[3]。阿魏酸具有抗氧化、清除自由基以及抗紫外线等作用,其含量是2010 年版中国药典中当归质量控制的特征性指标[4],多用HPLC 进行测定。但该法前处理复杂、仪器操作繁琐、分析时间较长,且阿魏酸在水中稳定性差,见光、受热极易分解,易与当归中阿魏酸松柏酯相互转化[5]。亚油酸是人体无法合成的必须脂肪酸,其功能性多不饱和键具有降低血清胆固醇的作用[6],但其在空气中易发生自氧化。
NIR 是正在迅速发展的一种绿色分析技术,已广泛应用于农业、化工、烟草、制药和食品工程等领域[7]。NIR 兼备了可见区光谱分析信号容易获取与红外区光谱分析信息量丰富两方面的优点,但也有谱带重叠多、吸收强度低等缺点,在定量分析中必需在一定波段内利用化学计量学方法建立数学模型,才能确定成分含量与光谱间的关系[8]。本研究首先采用RP-HPLC 测得当归药材中阿魏酸与亚油酸的含量值,然后采用NIR 对当归药材在近红外光谱区域的特征吸收进行实验研究,并在此基础上优化定量校正模型,实现当归药材中阿魏酸与亚油酸含量的快速、准确测定。
1 材料与方法
1.1 原料、试剂及主要仪器
145 批当归药材,采集于甘肃及云南14 个县级主产区,经甘肃中医学院药学院晋玲教授鉴定为Angelica sinensis (Oliv.)Diels。
阿魏酸对照品(中国药品生物制品检定所,批号:131187-100504);亚油酸对照品(美国迪玛公司,批号:245-12-06);甲醇(色谱纯,山东禹王实业有限公司化工分公司),超纯水(自制,电阻率≥18.2 MΩ)。
Nicolet-6700 型傅立叶变换近红外光谱仪(配有积分球模块、RESULT 3.0 光谱采集软件和TQ Analyst 8.0 化学计量学软件,美国Thermo 公司);Agilent 1100 LC/DAD 系统(包括G1312A 二元梯度洗脱泵,G1316A柱温箱,G1315B DAD检测器,G1313A 进样器和Agilent 化学工作站,美国Agilent公司)。
1.2 实验方法
1.2.1 样品NIR 光谱的采集
将当归样品粉碎,过50 目筛,预先置于红外灯下干燥至恒重。采集条件:积分球漫反射方式,扫描范围10000~4000 cm-1,扫描32 次,分辨率8 cm-1,温度20 ℃,空气相对湿度70%,以空气为参比,每批样品重复采集3 次,取平均光谱。
1.2.2 异常光谱的剔除
利用TQ Analyst 8.0 化学计量学软件中的Dixon 检验剔除异常光谱。
1.2.3 阿魏酸及亚油酸含量的测定
采用RP-HPLC 测定当归中阿魏酸及亚油酸的含量,作为建立模型的化学参考值。精密称取样品粉末约0.5 g,加70%甲醇20 mL,超声(15 ℃,800 W,50 kHz)提取45 min,滤过,上清液定容至25 mL容量瓶中,进样前用0.45 μm 微孔滤膜过滤。色谱条件:Waters X-Bridge C18(250 mm × 4.6 mm,5 μm)色谱柱,以水(A)-甲醇(B)为流动相进行梯度洗脱(0~5 min,10%~20% B;5~15 min,20%~50% B;15~35 min,50%~80% B;35~55 min,80%~90% B),体积流量0.8 mL/min,进样体积10 μL,柱温30 ℃,阿魏酸及亚油酸的检测波长分别为280 nm 及206 nm。方法学考察显示所采用的仪器及方法误差符合要求。每份样品平行测定3 次,取平均值。以外标法计算2 种成分的含量。
1.2.4 近红外光谱模型的建立
利用PLS(偏最小二乘法)建立当归中阿魏酸及亚油酸的定量校正模型。以随机选择的30%的样品作为验证集,其余70%作为校正集。以相关系数(R)、校正均方差(RMSEC)、预测均方差(RMSEP)和交叉验证均方差(RMSECV)作为评价校正模型优劣的指标[7]。采用交叉验证法验证所建模型的稳健性,采用独立的验证集对所建模型的预测能力进行检验。通过TQ Analyst 8.0 化学计量学软件的自动优化功能结合样品近红外光谱图筛选建模波段。采用内部交互验证法(internal cross-validation)筛选潜变量个数。
2 结果与分析
2.1 当归样本的近红外光谱特征分析
145 批当归样本的近红外原始光谱见图1。一阶导数光谱和二阶导数光谱见图2、图3。由图可见,一阶导数光谱能够清楚地反映出样品中的主要吸收峰位,而二阶导数光谱反而将噪声放大。一阶导数光谱中的主要特征峰:6896 cm-1为O-H 的一级倍频吸收峰,6079 cm-1为C-H 的一级倍频吸收峰,5352 cm-1为C=O 的二级倍频吸收带,5000 cm-1为O-H 的合频吸收峰,4545 cm-1为N-H 的合频吸收峰,4347 cm-1为C-H 的合频吸收带[9,10]。

图1 145 批当归样本近红外原始光谱图Fig.1 Original NIR spectra of 145 batches of samples

图2 经一阶导数处理后的光谱图Fig.2 The spectra processed by first derivation

图3 经二阶导数处理后的光谱图Fig.3 The spectra processed by second derivation
2.2 样品集的划分及化学参考值测定结果
Dixon 检验剔除了4 个异常光谱,从剩余的141批样品中随机抽取42 批作为验证集,用于检验模型的预测能力,其余99 批作为校正集,用于建立模型。对照品及当归样品的HPLC 色谱图见图4,样品集中阿魏酸及亚油酸的含量分布见表1。由表1 可知,阿魏酸和亚油酸的含量分布范围较广,具有很好的代表性,能够满足建模的要求。

图4 混合对照品(A)与当归样品(B)的HPLC 色谱图Fig.4 HPLC chromatograms of mix standards (A)and sample (B)
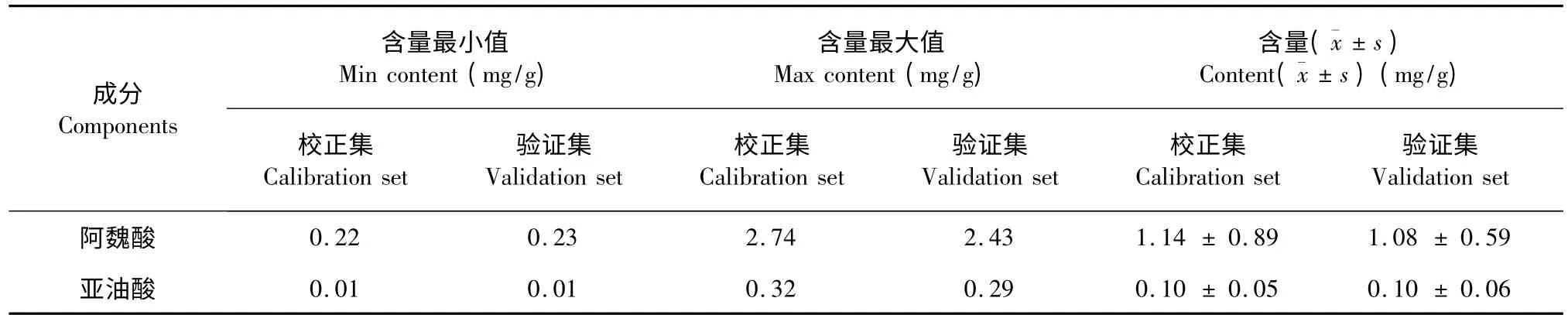
表1 样品中阿魏酸及亚油酸的含量分布Table 1 Content distribution of ferulic acid and linolic acid of samples
2.3 光谱波段的筛选
由图1 可见,不同当归样本的NIR 谱图十分接近,无法直接判定各成分含量与个别波长点的吸光度之间的相关性,必须在一定的区间内建立数学模型来确定近红外光谱和成分含量之间的关系[11,12]。结合TQ Analyst 8.0 定量分析软件的自动优化结果和样品红外光谱图,选定阿魏酸的建模区间为7502.4~6799.9 及4456.85~4246.32 cm-1波段,亚油酸的建模区间为8724.7~5000 及4427.9~4246.7 cm-1波段。此区间信息量丰富,能充分反映出样品的性质和组成,避免了采用全谱建模的大量计算。
2.4 光谱预处理方法的选择
为减少噪声、信号本底、基线漂移、样品颗粒不均匀以及光散射等对光谱的干扰,保证模型的可靠性和准确性,本实验在阿魏酸及亚油酸的分析谱区间内,分别考察了未处理光谱(None)、一阶导数光谱(FD)、二阶导数光谱(SD),以及一阶导数光谱、二阶导数光谱与多元散射校正(MSC)、标准正态变量校正(SNV)、Savitsky-Golay(SG)平滑和Norris 导数滤波平滑相结合的方法。结果见表2。可知,选用一阶导数和Savitzky-Golay 平滑以及多元散射校正和对光谱进行预处理所得模型的预测效果最佳。
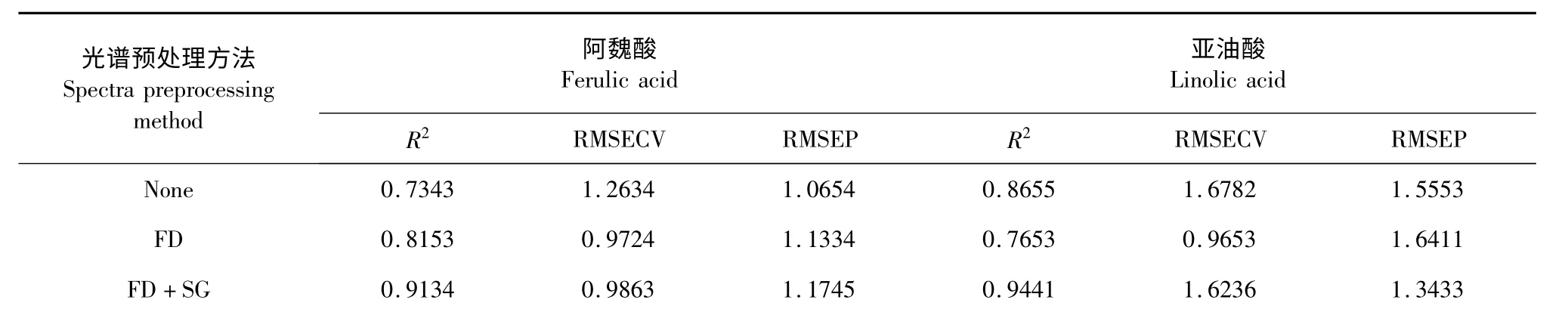
表2 不同光谱预处理方法的建模结果Table 2 The results of different spectra preprocessing methods

2.5 潜变量个数的确定
采用PLS 建立定量模型,潜变量个数(factor)的选择对模型预测能力的影响较大。潜变量个数太多,所建模型包含太多的测量噪音,出现过拟合现象;潜变量个数太少,导致建模信息不全,模型预测能力差[13]。由图5 及图6 可知,随着潜变量个数的增加,R2(%)不断增加,RMSECV 不断减小,当阿魏酸及亚油酸的潜变量个数分别达到5 和4 后都趋于稳定。

图5 阿魏酸模型的潜变量个数与RMSECV 及R2 的关系Fig.5 Factor relationship with RMSECV and R2 of ferulic acid model

图6 亚油酸模型的潜变量个数与RMSECV 及R2 的关系Fig.6 Factor relationship with RMSECV and R2 of linolic acid model
2.6 定量模型的建立及评价
综合上述分析,本实验选定阿魏酸的建模区间为7502.4~6799.9 及4456.85~4246.32 cm-1波段,亚油酸的建模区间为8724.7~5000 及4427.9~4246.7 cm-1波段,采用Savitzky-Golay 平滑、多元散射校正和一阶导数相结合对光谱进行预处理,阿魏酸及亚油酸的潜变量个数分别取5 和4,由此建立PLS 定量模型。由相关图(图7)可见,模型预测值与参考方法测得的真实值之间具有较好的相关性。所建阿魏酸模型的R 为0.9721,RMSEC 为0.5942,RMSEP 为0.6747;采用交叉验证法判断阿魏酸模型的稳健性,交叉验证R 为0.9364,RMSECV 为1.0244。所建亚油酸模型的R 为0.9673,RMSEC为0.4573,RMSEP 为1.0682;采用交叉验证法判断亚油酸模型的稳健性,交叉验证R 为0.8925,RMSECV 为1.2236。由此可见,所建模型比较理想。
以验证集样品的近红外光谱预测值与HPLC 测定值的比值作为预测回收率[14]。通过定量校正模型,验证集样品中阿魏酸含量的预测值在0.23~2.54 mg/g 之间,百分偏差在-7.69%~9.88%之间,平均百分偏差1.98%,预测回收率在92.31%~109.88%之间,平均预测回收率101.98%;验证集样品中亚油酸含量的预测值在0.013~0.297 mg/g之间,百分偏差在-5.00%~11.67%之间,平均百分偏差1.34%,预测回收率在95.00%~111.67%之间,平均预测回收率102.03%。上述结果表明,验证集样品中阿魏酸与亚油酸含量的预测值分布范围与真实值基本相符,平均百分偏差均较小,平均预测回收率均在100%附近,因此利用近红外漫反射光谱技术快速测定当归中阿魏酸与亚油酸的含量是可行的。
3 结论与展望

图7 阿魏酸及亚油酸的定量校正模型所得预测值与真实值之间的相关图Fig.7 Correlation between actual content and predicted content of ferulic acid and linolic acid
本研究采集全国14 个当归主产县共145 批当归药材进行NIR 光谱采集,建立PLS 数学模型对阿魏酸和亚油酸行含量测定,结果令人满意。与常规HPLC、GC 等含量测定方法相比,本法样品预处理简单、操作简便、快速无损、准确可靠,可以节省大量的分析时间,特别适合大量样品及在某些条件下不稳定样品的快速测定,在中药及复方制剂中质量控制成分的快速检测和质量评价中具有广阔的发展前景[15]。同时,本法作为一种间接测定含量的方法,其准确性受化学参考值、样本量及其代表性、仪器因素以及人为因素等的影响。首先,建模样本的收集和准备非常重要,样本集各种化学成分的含量范围必须涵盖所有可能遇到的样本中相应组分的含量范围,且含量要尽可能分布均匀。中药化学成分极其复杂,只能通过收集足够多的样本来尽量涵盖实际分析中可能遇到的各种样品[16]。其次,化学参考值尽量要选取准确度与灵敏度较高的经典方法进行测定,增加所建模型的可靠性。只有这样,才可通过直接扫描待测样品的近红外光谱图并立刻获得样本中相应成分的含量。
1 Qian YY,Wang YL,Sa RN,et al.Metabolic fingerprinting of Angelica sinensis during growth using UPLC-TOFMS and chemometrics data analysis.Chem Centr,2013,7:42-47.
2 Sun HG(孙红国),Zhang M(张蔓),Ji P(纪鹏),et al.Isolation and purification of Angelica polysaccharide and analysis of its monosaccharide composition.Nat Prod Res Dev(天然产物研究与开发),2014,26:480-485.
3 Hook IL.Danggui to Angelica sinensis root:are potential benefits to European women lost in translation?A review.J Ethnopharmacol,2014,152:1-13.
4 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol Ⅰ,124.
5 Li SQ(李韶菁),Zhang YC(张迎春),Su PY(苏培瑜),et al.Advances in research of on coniferyl ferulate.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17:229-231.
6 Zhang CE(张春娥),Zhang H(张惠),Liu CY(刘楚怡),et al.Research progress of linoleic acid.Cere Oils Proc (粮油加工),2010,5:18-21.
7 Wang Y(王远),Qin MJ(秦民坚),Qi J(戚近),et al.Analysis of polysaccharides contents in Ophiopogon japonicus by NIR.Spectrosc Spectral Anal(光谱学与光谱分析),2009,29:2677.
8 Yang Y(杨阳),Dai T(代涛),Wang XK(汪学楷),et al.Near infrared spectroscopy mathematical models of cholic acid.Chem Res Appl(化学研究与应用),2011,23:204-207.
9 Li BX(李波霞).The application of infrared Spectroscopy and chemometrics to qualitation and quantitative study models of Codonopsis pilosulae and Angelicae sinensis.Lanzhou:Lanzhou University(兰州大学),MSc.2007,23-24.
10 Lu WZ(陆婉珍).Modern Near-Infrared Spectroscopic Techniques(现代近红外光谱分析技术)(Ⅱ).Beijing:China Petrochemical Press(中国石化出版社),2006.30-32.
11 Zhou Y(周芸),Zhang XL(张晓玲),Wu YJ(吴永江),et al.Determination of proanthocyanidins and total phenolics in the seedpod of Nelumbo nucifera Gaertn by near infrared diffuse reflectance spectroscopy.Chin J Pharm(中国药学杂志),2013,48:221-224.
12 Zhou M(周旻),Wang TZ(王天志),Ye LM(叶利明),et al.Determination of berberine in Phellodendron Chinese Schneid from Sichuan using near infrared diffuse reflectance spectroscopy.Spectrosc Spectral Anal(光谱学与光谱分析),2007,27:1527-1530.
13 Zhang W(张威),Bai Y(白雁),Wang X(王星),et al.Determination of phillyrin in the extractum of Forsythiae suspensa by near-infrared diffuse reflectance spectroscopy.Chin J Hosp Pharm(中国医院药学杂志),2010,30:1020.
14 Yuan MY(袁明洋),Huang BS(黄必胜),Yu C(余驰),et al.A NIR qualitative and quantitative model of 8 kinds of carbonate-containing mineral Chinese medicines.China J Chin Mater Med(中国中药杂志),2014,39:271.
15 Bai Y(白雁),Gong HY(龚海燕),Song RL(宋瑞丽),et al.Quantitative analysis on extracts by water and ethanol in Rhizoma Dioscoreae by near-infrared diffuse reflection spectroscopy.Chin J Mod Appl Pharm(中国现代应用药学),2010,27:166.
16 Gong HY(龚海燕),Hu YN(胡亚楠),Xei CX(谢彩侠),et al.Rapid determination of moisture in Fructus Corni by near infrared spectroscopy.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2013,19:118.

