CDX2基因在成人急性髓细胞白血病中的表达及临床意义*
申淑珍,刘 娟,马 云,杨 瑞,许 飞,李 玲,白晓川
(宁夏医科大学总医院血液科,银川 750004)
论著·临床研究
CDX2基因在成人急性髓细胞白血病中的表达及临床意义*
申淑珍,刘 娟,马 云,杨 瑞,许 飞,李 玲,白晓川
(宁夏医科大学总医院血液科,银川 750004)
目的研究尾型同源盒基因2(CDX2)在急性髓细胞白血病(AML)患者中的表达及临床意义。方法通过RT-PCR方法检测114例初发AML患者及56例诱导化疗后患者骨髓和(或)外周静脉血单个核细胞CDX2基因表达,19例随访患者每3个月定期检测CDX2基因表达。8名健康者外周静脉血和5名缺铁性贫血患者骨髓作为对照。结果114例AML患者和13名对照的骨髓和(或)外周血单个核细胞均检测到CDX2基因表达。以第一个四分位数为界划分低表达组和高表达组,对照组CDX2基因表达水平均在低表达组,114例AML患者高表达组90例(78.9%),对照组与AML患者CDX2基因表达差异有统计学意义(P<0.01)。初发患者骨髓和外周静脉血CDX2基因表达呈正相关(r=0.656,P<0.01)。CDX2高低表达组诱导化疗完全缓解(CR)率差异无统计学意义(P>0.05)。本组AML病例CDX2高表达78.9%。CR患者CDX2表达量为化疗前的10.3%~86.2%,且随着疗程增加逐步降低,复发时显著升高。随访6个月以上病例19例,两组早期复发率差异无统计学意义(P>0.05)。结论CDX2表达量变化反映患者体内白血病细胞负荷,持续高表达可能是预后不良指标之一,可作为染色体核型正常AML微小残留病监测指标。
CDX2;白血病,髓细胞,急性;预后;微小残留白血病
尾型同源盒基因2(CDX2)在急性髓细胞白血病(AML)中表达最早是Chase等[1]1999年报道的,同时提示CDX2基因在白血病中的表达可能参与了白血病的发生。Scholl等[2]研究提示成人白血病中存在胚胎通路的激活,CDX2是同源盒基因(HOX)家族成员,是促进胚胎发育和早期造血发育的主控基因,通过胚胎通路的激活,导致成人急性白血病。在AML发病中起的是原癌基因的作用,CDX2基因表达上调后通过增强造血祖细胞的自我更新能力而使细胞获得了潜在的致白血病性。本文通过检测初发及诱导化疗后AML患者骨髓及(或)外周静脉血中CDX2表达,19例AML(非急性早幼粒细胞白血病)随访超过6个月,每3个月检测骨髓和(或)外周静脉血单个核细胞CDX2基因表达。探讨其与AML患者临床及预后、微小残留白血病(MRD)的关系。
1 资料与方法
1.1 一般资料 收集2011年8月至2014年8月宁夏医科大学总医院血液科住院患者,经骨髓形态学及组织化学、免疫表型检查确诊初治 AML 患者 114例,诊断及疗效标准依据张之南等[3]的《血液病诊断及疗效标准》。男76 例,女38 例,年龄16~78岁,就诊平均年龄43.9岁。完成常规标准方案(TA或IA)化疗1个周期可供疗效评估。对照为8名身体健康血液科工作人员外周静脉血和5名缺铁性贫血(IDA)患者骨髓。随访截止2014年12月。
1.2 主要试剂和仪器 TRIzol、PrimeScript RT-PCR Kit(Perfect Real Time)和Premix EX Taq(Perfect Real Time) (大连TaKaRa生物工程公司),ABI7300荧光定量PCR仪(ABI公司)。
1.3 方法
1.3.1 引物设计和合成 基因序列从GenBank中获取,引物用Primer5.0软件进行设计。由上海闪晶生物技术有限公司合成。CDX2基因上游引物5′-TTC AGA ACC GCA GAG CAA AG-3′,下游引物5′-CCC AGG GAC AGA GCC AGA C-3′;内参基因GAPDH上游引物5′-CCA TGT TCG TCA TGG GTG TGA ACC A-3′,下游引物5′-GCC AGT AGA GGC AGG GAT GAT GTT C-3′。
1.3.2 单个核细胞提取 采集患者和对照者骨髓、静脉血,EDTA抗凝,加入淋巴细胞分离液,按说明书分离并收集单个核细胞。
1.3.3 RNA提取和cDNA合成 提取患者和对照骨髓及全血的单个核细胞用Trizol试剂,按说明书所附提取步骤提取mRNA,用微量分光光度计(NanoDrop,Thermo)定量,OD260/280比值在1.8~2.0,于-80 ℃保存。按照逆转录试剂盒说明书进行反转录反应。总体系20 μL:2×RTmix液10 μL,模板RNA 100~500 ng,加RNase free水至总体积20 μL;反应条件:37 ℃ 16 min,85 ℃ 5 s。
1.3.4 RT-PCR 所有基因RT-PCR按照试剂盒配制定量PCR反应体系。在20 μL反应体系中含2×PCR Mix 10 μL,上、下游引物各1 μL(2.5 μmol/L),RoxⅡ 0.4 μL,cDNA反应产物2 μL,加入RNasefree水补足至20 μL。在ABI 7500 Fast上进行定量反应,反应条件为95 ℃ 30 s变性,95 ℃ 30 s,60 ℃ 30 s,50个循环。每个样本均设3个复孔,取平均值用于结果统计。
1.3.5 基因mRNA表达水平相对定量与分析 反应结束后,ABI7300 SDS Software自动分析荧光信号并将其转换Ct值。Ct值取3个复管的平均值。△Ct为目的基因Ct值与内参Ct值的差值。
1.3.6 CDX2基因表达水平的计算方法 CDX2基因表达量=2-△△Ct(△△Ct=△Ct患者-△Ct健康对照)×107。
1.3.7 CDX2基因表达四分位数划分 CDX2基因表达量根据统计学中四分位数Q1,Q2和Q3结合健康人表达水平来划分高低表达组,低于Q1的为低表达组,>Q1的为高表达组。
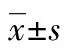
2 结 果
2.1 CDX2基因表达情况 114例AML患者血和骨髓及对照组骨髓或静脉血均检测到CDX2基因表达,114例AML患者骨髓中位表达水平为620.02(1.17~5 672 670.61),血中位表达水平为647.33(3.22~8 213 486.54),骨髓和血CDX2基因表达具有正相关(r=0.656,P<0.01)。对照组CDX2基因mRNA表达水平相对定量与AML CDX2基因mRNA表达水平相对定量差异有统计学意义(P<0.01)。
2.2 CDX2基因表达与临床特征相关性 114例AML患者骨髓低表达组24例(表达范围1.17~175.19),高表达组90例(175.19~5 672 670.61),占AML病例78.9%。男性患者高表达81.6%,女性患者高表达73.7%,年龄大于或等于60岁组高表达87.0%,<60岁组高表达76.9%,白细胞数大于或等于30×109/L组高表达85.0%,白细胞数小于30×109/L组高表达75.7%,乳酸脱氢酶大于或等于1 000 U/L组高表达82.2%,乳酸脱氢酶小于1 000 U/L组高表达76.8%,免疫表型CD34+的病例组高表达72.0%,CD34-的病例组高表达92.3%,CD7+病例组高表达83.0%,CD7-病例组高表达70.2%,差异均无统计学意义(P>0.05)。在FAB分型中高表达分别为AML-M0 100%,AML-M1 89.3%,AML-M2 65.5%,AML-M3 25.0%,AML-M4 78.6%,AML-M5 84.6%,AML-M6 100%,淋髓混合病例高表达100%,差异无统计学意义(P>0.05)。染色体正常核型组高表达78.3%,预后良好核型组高表达55.0%,预后不良核型组高表达90.9%,其他核型组高表达81.8%,差异无统计学意义(P>0.05),见表1。
2.3 CDX2表达与诱导缓解率的关系 114例AML患者中有56例(非急性早幼粒细胞白血病)完成诱导化疗,骨髓细胞形态学完全缓解(CR)37例,其中CDX2低表达11例(29.7%),CDX2高表达26例(70.3%);骨髓细胞形态学未缓解(NR) 19例,其中CDX2低表达3例(15.8%),CDX2高表达16例(84.2%),差异无统计学意义(P>0.05),见表1。

表1 AML患者CDX2基因表达与临床特征、治疗反应相关性[n(%)]
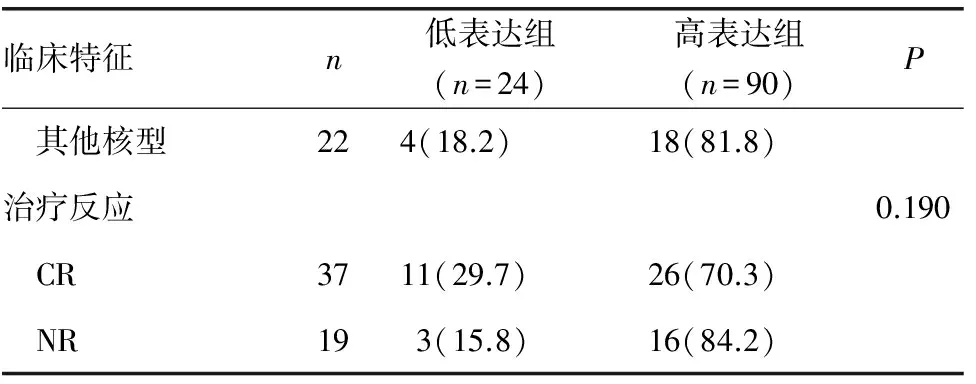
续表1 AML患者CDX2基因表达与临床特征、治疗反应相关性[n(%)]
2.4 诱导化疗前后CDX2表达变化 37例诱导化疗达CR病例CDX2表达较化疗前均有不同程度降低,化疗后CDX2表达量为化疗前的10.3%~86.2%;19例诱导化疗NR病例中,CDX2表达量较化疗前有不同程度升高6例,余13例CDX2表达较化疗前不同程度降低。
2.5 随访病例治疗过程中CDX2表达变化 随访6个月以上病例19例,其中CDX2高表达15例,诱导化疗1个疗程达CR 12例,诱导化疗2个疗程达CR 3例。CDX2低表达2例诱导化疗1个疗程达CR。CR后CDX2表达量随化疗疗程次数增加逐步下降,复发时再次显著升高,且有2例随访超过2年复发病例,CDX2升高早于FCM检测MRD及骨髓细胞形态学。持续不缓解2例,CDX2表达量逐步升高,死亡前CDX2表达量分别是初发时的60倍及100余倍。
3 讨 论
AML是高度异质性的血液系统肿瘤,影响预后的因素包括临床特点、白血病类型、免疫学、遗传学、分子生物学及治疗反应、微小残留等。MRD的检测对患者的再评估及危险度再分层至关重要[4]。监测MRD的方法主要有PCR、流式细胞免疫分析(FCM)及FISH。其中定量PCR通过检测白血病细胞中标志性基因实时观测MRD,灵敏度可达10-6,且费用显著低于FCM及FISH的检测费用,但基因定量需要患者有特异性基因标记。约60%的AML患者有核型异常,预后良好的核型t(15;17)形成的PML/RARa融合基因、t(8;21)形成的AML1/ETO融合基因、inv(16)、t(16;16)形成的CBFB/MYH11融合基因,占成人AML患者25%;而对于t(8;21)合并del(9q)、-Y及复杂核型、MLLT4、MLLT10等均提示预后不良;约40%的AML患者为正常核型,近些年新发现的与AML预后相关分子生物学指标如FLT3、NPM1、CEBPA、IDH等在正常核型AML患者中阳性率分别为23%、50%、10%、15%[4]。新近研究发现,在大多数的急性白血病(AL)患者CDX2广泛高表达,CDX2表达与AL患者白血病细胞负荷,MRD成正相关[5]。
本文通过RT-PCR方法检测了初发成人AML患者(静脉血和骨髓)及健康者静脉血、IDA患者骨髓CDX2基因mRNA表达水平,均有表达,但健康者及IDA患者表达水平均低,与AML患者的差异有统计学意义(P<0.01)。本组AML病例CDX2基因高表达78.9%。在以性别、年龄、FAB分型、白细胞、乳酸脱氢酶分组的CDX2高表达、低表达之间差异无统计学意义(P>0.05),与陆滢等[6]研究相符。但CDX2基因在高白细胞数组高表达85.0%,乳酸脱氢酶大于或等于1 000 U/L组高表达82.2%,CD7+病例高表达83.0%;AML-M0 高表达100.0%,AML-M5 高表达84.6%,AML-M6 高表达100.0%,淋髓混合高表达100%,预后不良核型组高表达90.9%;而预后好的AML-M3高表达25.0%,预后良好核型组高表达55.0%。高白细胞、乳酸脱氢酶升高、FAB分型AML-M4、-M5、-M6、髓淋混合和染色体预后不良核型均是影响预后不良指标。随访持续不缓解2例患者,CDX2表达逐步升高,死亡前CDX2表达量分别是初发时的60倍及100余倍。均提示CDX2高表达可能与白血病细胞高负荷和预后不良相关,还需更多的病例研究去证实。
本组病例统计显示CDX2高表达不影响AML诱导缓解率及早期复发率,这与黎国伟等[7]研究结果相符。化疗后CR患者CDX2表达量较化疗前均有不同程度降低,随访6个月以上病例19例,随着化疗疗程增加CDX2表达逐步降低,复发时显著升高。有2例随访超过2年复发病例,CDX2基因表达量升高早于流式细胞仪(FCM)检测白血病微小残留及骨髓细胞形态学,且染色体正常核型组CDX2高表达78.3%。提示可和FCM监测白血病相关免疫表型结合,作为染色体核型正常、无其他分子生物学异常标记AML患者的MRD监测。同时本组病例提示AML患者骨髓和外周静脉血均表达CDX2基因,且具有高度正相关,这与李迎侠等[8]研究结果相同,可用外周静脉血代替骨髓检测CDX2基因表达。但本研究连续观察病例数量少,CDX2基因作为染色体核型正常AML患者MRD监测的临床意义,外周静脉血代替骨髓作为MRD监测的可靠性,还有待大宗病例的进一步观察。
[1]Chase A,Reiter A,Burci L,et al.Fusion of ETV6 to the caudal-related homeobox gene CDX2 in acute myeloid leukemia with the t(12;13)(p13;q12)[J].Blood,1999,93(3):1025-1031.
[2]Scholl C,Bansal D,D?hner K,et al.The homeobox gene CDX2 is aberrantly expressed in most cases of acute myeloid leukemia and promotes leukemogenesis[J].J Clin Invest,2007,117(4):1037-1048.
[3]张之南,沈悌.血液病诊断及疗效标准[M].天津:天津科学技术出版社,1991:P116-P121.
[4]潘登.急性髓细胞白血病预后因素研究进展[J].癌症进展,2012,10(4):360-363.
[5]李迎侠CDX2基因与白血病关系的研究进展[J].国际儿科学杂志,2011,38(1):85-87.
[6]陆滢,汪琼,牧启田,等.CDX2基因在初发急性髓细胞白血病患者中的表达及临床意义[J].中华血液学杂志,2012,33(10):835-838.
[7]黎国伟,王东宁,叶玉蝶,等.急性髓细胞白血病CDX2基因表达及临床意义的探讨[J].中华肿瘤防治杂志,2009,16(16):1253-1255.
[8]李迎侠,黄嘉莉,钱新宏,等.儿童急性白血病CDX2基因WT1基因表达及其临床意义对照研究[J].中国实用儿科杂志,2013,28(3):195-199.
Expression and clinical significance of CDX2 gene in adult acute myeloid leukemia*
ShenShuzhen,LiuJuan,MaYun,YangRui,XuFei,LiLing,BaiXiaochuan
(DepartmentofHematology,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan,Ningxia750004,China)
ObjectiveTo explore the expression and clinical significance of caudal homeobox gene CDX2 in acute myeloid leukemia(AML) patients.MethodsBone marrow (BM)and peripheral blood (PB)samples were colleted in 114 cases of donor AML patients and 56 patients undergoing chemotherapy.The CDX2 gene expression in every patient′s mononuclera cells were detected by RT-PCR.Among these patients,19 cases were detected the gene continuous every three months.Eight healthy PB and five patients with iron deficiency anemia BM as control.ResultsCDX2 gene transcript levels were detectable in bone marrow mononuclear cells from 114 AML patients and 13 healthy donors,but the level of gene expression was higher in AML patients(90/114,78.9%).There was a statistically significant difference between the AML patients and normal donor (P<0.01).The higher or lower expression of CDX2 gene showed no correlation with CR rate.CDX2 gene expression level had a positive correlation in BM and PB mononuclera cells(the correlation coefficientr=0.656,P<0.01).The expression of CDX2 in patients with CR was 10.3%-86.2% of pre-chemotherapy,wihch decreased with the treatment course,while elevated in recurrence. 19 cases of patients underwent half a year of follow-up,there was no significant difference of the rate of early recurrence in two groups(P>0.05).ConclusionHigher expression level of CDX2 gene is mostly in AML patients,but its expression has no relation with CR rate.CDX2 gene may be a prognostic molecular marker in AML patients,and can be used to monitor the minimal residual disease of Normal chromosome karyotype AML.
CDX2;leukemia,myeloid,acute;prognosis;minimal residual disease
10.3969/j.issn.1671-8348.2015.29.004
2012年宁夏回族自治区科技攻关项目。
:申淑珍(1969-),硕士,主任医师,主要从事血液内科专业工作。
R733.71
A
1671-8348(2015)29-4042-03
2015-04-25
2015-08-16)

