hrpZPsg12转基因烟草及其抗性评价
杨丽娜,刘兴娜,卢宝慧,吴庠玉,白庆荣,王 雪,高 洁
(1 吉林农业大学 农学院,吉林 长春 130118;2 吉林省辽源市 农业技术推广总站,吉林 辽源 136300)
hrpZPsg12转基因烟草及其抗性评价
杨丽娜1,刘兴娜2,卢宝慧1,吴庠玉1,白庆荣1,王 雪1,高 洁1
(1 吉林农业大学 农学院,吉林 长春 130118;2 吉林省辽源市 农业技术推广总站,吉林 辽源 136300)
【目的】 将来源于大豆细菌性斑点病菌(Pseudomonassyringaepv.glycinea)Psg12菌株的hrpZPsg12基因导入烟草“云烟87”,对转化植株进行烟草普通花叶病毒(TMV)、烟草马铃薯Y病毒(PVY)和烟草野火病菌(Pseudomonassyringaepv.tabaci)的抗病性鉴定,为培育多抗烟草新品系奠定基础。【方法】 采用农杆菌介导法,将hrpZPsg12基因转入烟草“云烟87”中,对T0和T1代转基因植株进行PCR检测、Southern杂交,并对T1代转基因植株的抗病性进行评价。【结果】hrpZPsg12基因成功转入“云烟87”中,PCR检测表明共获得7株T0代阳性植株、35株T1代阳性植株。对T1代PCR阳性植株进行Southern检测,表明外源目的基因hrpZPsg12已经整合进烟草基因组中,并可在转基因后代植株中稳定遗传。抗病性测定表明,T1代转基因烟草对TMV和PVY表现高抗,对烟草野火病表现中抗。【结论】 获得了高抗TMV和PVY及中抗烟草野火病菌的转hrpZPsg12基因植株20和15株。
烟草;hrpZPsg12基因;农杆菌介导法;转基因植株
hrp(Hypersensitive response and pathogenicity)基因普遍存在于革兰氏阴性病原细菌中,其编码的Harpin类蛋白本身不具有任何杀菌活性,但可以激活植物产生一系列抗性反应,使植物获得广谱的抗病、抗虫作用,并能促进植物生长,提高植物抗逆性,增加作物产量,在生产上具有较好的应用前景[1-5]。国内外学者用不同来源的hrp基因转化梨树、油菜、马铃薯、大豆等植物,转基因植株都获得了不同程度的抗性[6-11]。来源于大豆细菌性斑点病菌(Pseudomonassyringaepv.glycinea,Psg)的hrpZPsg12基因大小为1 026 bp,编码431个氨基酸,甘氨酸含量为13.19%,编码蛋白的分子质量约为34 ku。由hrpZPsg12基因编码的Harpin蛋白具有与其他Harpins蛋白类似的特征和功能。姜兆远等[12]克隆到该基因,也证明该基因表达的蛋白质产物具有诱导植物产生抗病性和促进植物生长等效应[13-15]。张云月等[10]、尹俊琦等[11]将hrpZPsta基因转入大豆品种中,转基因后代对大豆灰斑病的抵抗能力大幅度增强。但目前该基因在烟草抗病性改良方面的研究尚未见报道,为进一步明确该基因在烟草抗性改良中的功能,提高烟草抗病性,本研究将该基因转化到烟草中并对其进行抗病性鉴定,以期进一步验证激活hrpZPsg12基因诱导植物产生抗病性和促进植物生长的能力,为烟草抗病育种和诱导抗病机制的研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 受体材料 供试烟草品种为吉林省主栽烟草品种云烟87,由吉林省烟叶公司提供。
1.1.2 菌株和质粒 大豆细菌性斑点病菌(Pseudomonassyringaepv.glycinea,Psg)菌株Psg12、农杆菌LBA4404、烟草普通花叶病毒(TMV)、烟草马铃薯Y病毒(PVY)和烟草野火病菌(Pseudomonassyringaepv.tabaci),均由吉林农业大学植物病害综合治理实验室保存。植物表达载体pROKⅡ,由山东农业大学植物抗病基因工程研究室惠赠。
1.1.3 主要试剂 PCR扩增试剂、限制性内切酶,均购自MBI公司;DNA Marker DL2000,购自TaKaRa公司;植物基因组DNA提取试剂盒,购自北京天根公司。其他试剂均为国产分析纯。
1.2 方 法
1.2.1 植物表达载体的构建 根据GenBank登录号为FJ853143的大豆细菌性斑点病菌hrpZPsg12基因序列设计1对特异性引物(P1:5′-GCTCTAG-ATGATGCAGAGTCTCAGTCTT-3′和P2:5′-CG-AGCTCTCAGGCAGCAGCCTGGTTTT-3′),在其5′端和3′端分别引入XbaⅠ和SacⅠ酶切位点。以大豆细菌性斑点病菌Psg12基因组DNA为模板进行PCR扩增[8]。PCR扩增条件:94 ℃预变性6 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸90 s,30个循环;72 ℃延伸8 min。PCR产物与pGM-T连接,构建克隆质粒,转化大肠杆菌DH5α,提取重组质粒,双酶切鉴定后送TaKaRa公司测序。用XbaⅠ和SacⅠ分别对克隆载体及表达载体pROKⅡ进行双酶切,回收目的片段。将目标基因与植物表达载体连接、热激法转化DH5α,提取重组质粒后进行双酶切鉴定,测序。冻融法将其转入到农杆菌LBA4404中,用于转化烟草。
1.2.2 农杆菌介导法转化烟草 转化烟草按白庆荣等[16]的方法进行,转基因植株种子分单株收获。
1.2.3 T0代和T1代植株的分子检测 1)PCR检测。从T0和T1代转化烟草植株及对照植株中剪取叶片,CTAB法提取植物基因组DNA,以P1和P2为引物进行PCR扩增,以质粒pROKⅡ-hrpZPsg12为阳性对照,未转化的植株为阴性对照。
2)Southern blot检测。采用植物基因组DNA提取试剂盒提取PCR检测阳性植株和对照植株的基因组DNA,经BamHⅠ消化过夜,然后用0.8%琼脂糖凝胶进行分离,再用20ΧSSC转移到尼龙膜,80 ℃固定2 h后与探针杂交。地高辛DNA标记与检测试剂盒(Roche公司)进行Southern杂交检测。以纯化的hrpZPsg12为模板制备探针,采用随机引物标记法进行标记,随后按照试剂盒说明书进行转膜、杂交、封闭和显色。
1.2.4 T1代转基因植株的抗病性评价 (1)TMV和PVY的抗性评价。病毒汁液的制备:取感染TMV和PVY的烟草叶片,用流水冲洗叶片表面,消毒滤纸擦干后剪去主脉,将叶片放入研钵中并加入等量的磷酸缓冲液,在冰上研磨,4 ℃、10 000 r/min 离心10 min,吸取上清液至50 mL离心管中,按1∶5体积比用0.1 mol/L的磷酸缓冲液(含体积分数0.1%的巯基乙醇,pH 7.2)稀释后加入体积分数0.05%的Tween-80表面活性剂备用。
病毒接种:分别选取5株7叶期T1代转基因烟草植株和空白对照植株作为接种对象,每株接种2个完全展开的新生叶片。先将石英砂均匀撒在叶片上,用灭菌毛刷蘸取病毒汁液在接种叶片上轻度摩擦,1~2 h后用无菌水喷洗接种部位,将接种植株置25 ℃温室中培养。逐天观察接种烟草叶片的症状变化,参照黄婷等[9,17]的方法分别调查接种后7,15 d烟草叶片的发病情况,并对转基因烟草进行抗性评价。
(2)烟草野火病菌的抗性评价。将活化后的烟草野火病菌制成5×108CFU/mL的菌悬液。分别选取15株转基因植株(7叶期)用上述菌悬液喷雾接种,再选取15株非转基因健康植株用无菌水喷雾作为空白对照,套袋保湿24 h,置25 ℃温室中培养。接种后7 d,调查发病情况,记载叶片病斑直径,计算平均病斑直径和病叶率。
烟草野火病的病级指数采用9级分级标准,其中0级:叶片无病斑;1级:病斑占叶片面积5%以下;3级:病斑占叶片面积6%~10%;5级:病斑占叶片面积11%~20%;7级:病斑占叶片面积21%~40%;9级:病斑占叶片面积40%以上。按下式计算病情指数:
病情指数=[(∑各级病叶数×该病级值)/(调查总叶数×9)]×100。
按病情指数进行群体抗性分类。群体抗性分类标准为4级,其中免疫:病情指数等于0,无侵染;高抗:0<病情指数≤20;中抗:20<病情指数≤50;感病:50<病情指数≤100。
2 结果与分析
2.1 植物表达载体的构建
将PCR扩增产物与pGM-T连接,构建克隆质粒pGM-hrpZPsg12,转化大肠杆菌DH5α,提取重组质粒。用XbaⅠ和SacⅠ分别对克隆载体进行酶切,得到1 026 bp的片段,将该片段与相同酶切位点的植物表达载体pROKⅡ进行连接,构建重组质粒pROKⅡ-hrpZPsg12, PCR和双酶切鉴定(图1)及测序结果表明,植物表达载体构建成功。

图1 质粒pROKⅡ-hrpZPsg12的酶切鉴定M.DL2000 DNA Marker;1,2.pROKⅡ-hrpZPsg12质粒 XbaⅠ/SacⅠ双酶切
2.2 农杆菌介导的烟草的转化
将构建好的植物表达载体经冻融法转入根癌农杆菌LBA4404中,叶盘法转化烟草,结果获得10株卡那抗性植株(图2)。

图2 农杆菌介导的hrpZPsg12基因转化烟草A.预培养;B.共培养;C.选择培养;D.分化芽;E.生根培养;F.转化植株
Fig.2 Transformation ofhrpZPsg12gene into tobacco via agrobacterium-mediated method A.Pre-regeneration culture;B.Co-cultivation;C.Callus culture;D.Km resistant buds from tobacco leaf disks;E.Root-reduced culture;F.Transformation plants
2.3 转基因烟草的分子检测
2.3.1 PCR检测 转基因植株T0代总DNA PCR产物的电泳检测结果(图3)表明,从T0代植株中扩增出了与阳性对照在同一位置的特异性条带,初步证明hrpZPsg12基因成功地转入到受体烟草品种中,共获得了7株阳性植株。
播种PCR检测为阳性的T0代植株的种子,获得T1代转基因植株,将其播种于营养钵中,提取基因组DNA,以其为模板,P1、P2为引物进行PCR检测,结果(图4)表明,外源hrpZPsg12基因在转基因后代中能够遗传,共获得了35株T1代转基因植株。
2.3.2 Southern杂交 对部分T1代PCR检测为阳性的植株基因组DNA用BamHⅠ进行酶切,并进行Southern 杂交分析,结果如图5所示。图5显示,PCR检测为阳性的T1植株与阳性对照在相同位置出现杂交条带,证明外源hrpZPsg12基因已整合到烟草基因组中并可稳定遗传。
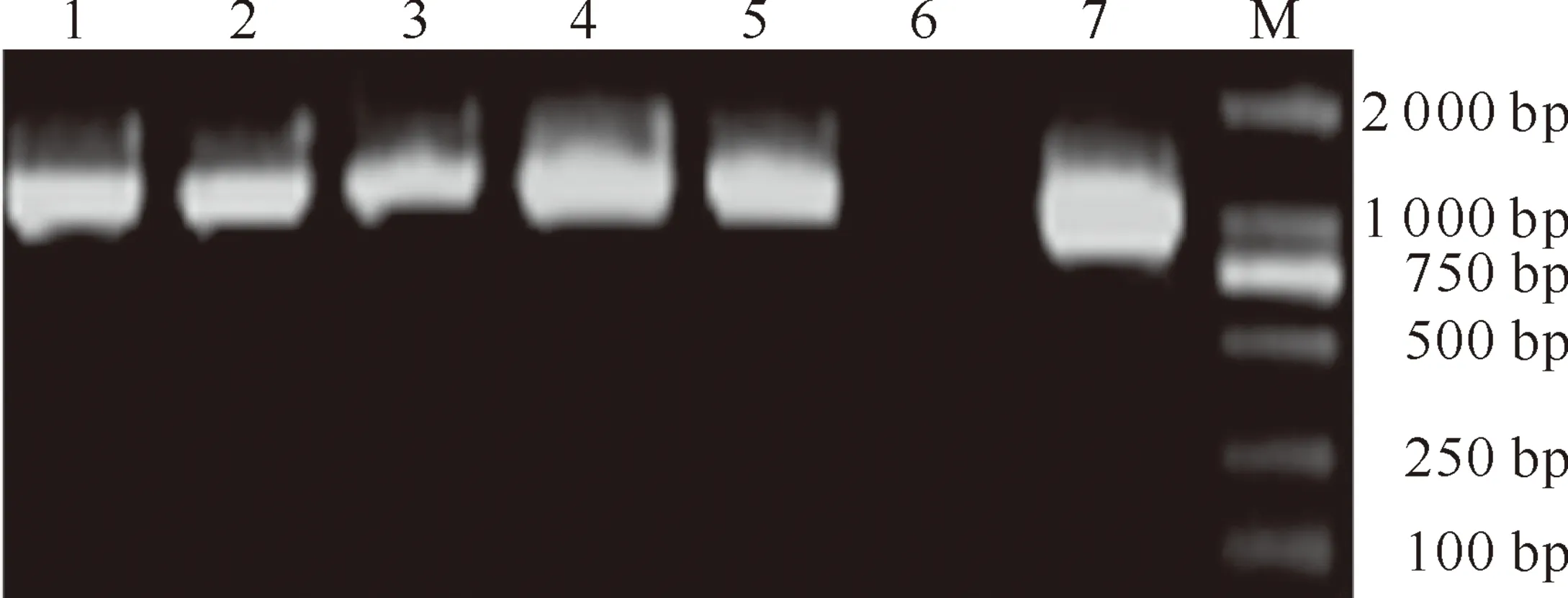
图3 T0代转基因烟草植株的PCR检测
1~5.转基因植株;6.未转化植株;7.重组表达质粒 pROKⅡ-hrpZPsg12; M.DL2000 DNA Marker
Fig.3 PCR analysis of T0transgenic tobacco plants 1-5.Transgenic tobacco plants;6.Non-transgenic plant;7.Recombined plasmid pROKⅡ-hrpZPsg12;M.DL2000 DNA Marker

图4 T1代转基因植株的PCR检测1~4.T1代转基因植株;5.未转化植株;M.DL2000 DNA MarkerFig.4 PCR analysis of T1 transgenic tobacco plants 1-4.Transgenic tobacco plants;5.Non-transgenic plant;M.DL2000 DNA Marker
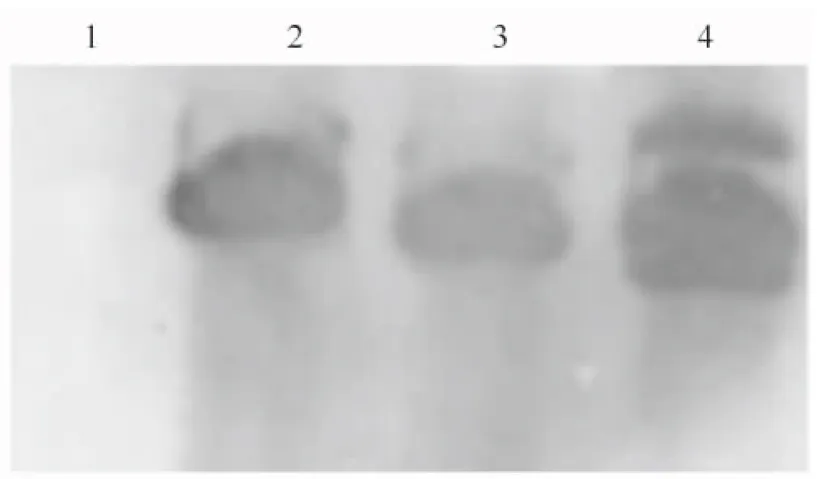
图5 转基因烟草的Southern blot分析1.阴性对照;2.阳性对照;3,4.转基因阳性株系Fig.5 Southern blot analysis of transgenic tobacco plants1.Negative control;2.Positive control;3,4.Transgenic tobacco plants
2.4 T1代转基因烟草的抗病性评价
在接种TMV后7 d,转基因烟草接种的2个叶片产生不规则的过敏性枯死斑(图6-A),未转基因植株的叶片产生典型的TMV初期症状(图6-B);在接种后15 d,转基因烟草植株接种的2个叶片枯死,上部新生叶片正常(图6-C),而未转基因对照植株随着病程的持续,整株发病(图6-D)。由此可以看出,转基因烟草对TMV具有高度抗性。
图6 转基因烟草和非转基因烟草植株接种TMV后的症状
A.接种7 d的转基因植株;B.接种7 d的非转基因植株;C.接种15 d的转基因植株;D.接种15 d的非转基因植株
Fig.6 Symptoms on leaves of transgenic plants and non-transgenic plants after inoculation with TMV respectively
A.Transgenic tobacco plants 7 d after inoculation;B.Non-transgenic plants 7 d after inoculation; C.Transgenic tobacco plants 15 d after inoculation;D.Non-transgenic plant 15 d after inoculation
在接种PVY后7 d,转基因烟草植株生长正常 (图7-A);非转基因对照植株的叶片产生典型的PVY症状(图7-B)。在接种后15 d,转基因烟草生长正常(图7-C),而非转基因对照植株叶脉呈褐色至黑色坏死,常延伸到中脉和茎上,造成叶片皱缩卷曲,在叶中脉或侧脉处常发生大小数目不一的褐色或白色坏死斑点(图7-D)。由此可以看出,转基因烟草对PVY具有高度抗性。

图7 转基因烟草和非转基因烟草植株接种PVY后的症状A.接种7 d的转基因植株;B.接种7 d的非转基因植株;C.接种15 d的转基因植株;D.接种15 d的非转基因植株
在接种烟草野火病菌的第4天,转基因植株未出现发病症状(图8-A),非转基因烟草植株出现水渍状圆形褪色的小斑点(图8-B);在接种后13 d,转基因烟草开始有部分叶片出现水渍状圆形褪色的小斑点(图8-C),发病率为5%,推迟发病7~9 d。非转基因烟草发病率达到60%,病斑扩大,中心变成褐色,周围有一圈很宽的黄绿色晕环,病斑合并扩大,呈不规则形(图8-D);在接种后第21天,转基因植株的平均病情指数为40,而对照植株的平均病情指数为100(表1)。随着病程的持续,接种30 d时对照植株进入病情指数为100的平稳期,转基因植株在30 d时才进入病情指数为80平稳期。上述结果表明,所选取的15株转基因烟草均中抗烟草野火病菌。

图8 转基因烟草和非转基因烟草植株在接种烟草野火病菌后的症状A.接种4 d的转基因植株;B.接种4 d的非转基因植株;C.接种13 d的转基因植株;D.接种13 d的非转基因植株

表1 转基因烟草和非转基因烟草植株对烟草野火病菌的抗性Table 1 Resistance of transgenic and non-transgenic plants against Pseudomonas syringae pv.tabaci
3 讨 论
hrpZ基因编码的Harpin蛋白在引起植物产生过敏反应的同时,不仅可以诱导植物获得系统性抗性,还能刺激植物生长发育,诱导其他有益反应的发生[13-16]。Harpin蛋白的作用机理并不是直接针对目标病原菌,而是刺激植物自身产生过敏性反应(HR),从而达到抵御不利微生物侵害的目的,该反应效果已被证实能够激发并提高植物体对多种微生物病原菌的抗性,而这种自然的免疫机制可以促进植物抵抗一系列的细菌、真菌和病毒病害,赋予植物广谱抗病性。目前已经得到了高抗晚疫病转hrp基因的马铃薯,用马铃薯晚疫病菌复合生理小种挑战接种测定表明,HrpN蛋白的转基因植株能够拮抗病原菌的侵扰[7-8]。张云月等[10]、尹俊琦等[11]将hrpZPsta基因转入2个大豆品种中,使大豆植株对真菌类病害的抵抗能力有较显著的增强。本试验将hrpZPsg12基因通过农杆菌介导法转入烟草获得了稳定遗传2代的转基因植株,T1代转基因植株对TMV、PVY和烟草野火病的抗性都有所增强,且对TMV和PVY表现高抗,对烟草野火病表现中抗,以上研究结果说明,hrp基因编码的Harpin蛋白在诱导植物获得系统性抗性上有很大的作用,但是具体对哪种病害的抵抗能力更强尚不甚明确,这有待进一步研究。
近些年,人们对转基因食品安全性的问题愈加关注。hrpZPsta基因编码的Harpin蛋白并非是毒蛋白,不会对植物体或者食用植物的动物或人造成危害,此种蛋白的主要作用是引起植物体本身的过敏性反应,以应对病原菌的入侵并产生广谱的抗病性。因此该基因是较为安全的,不会给人们带来对转基因作物的恐慌。该基因在增强植株自身抗病性的同时,还可以提高烟草抗病性,改良烟草的品质,为进一步培育抗病转基因烟草新品系奠定了基础。
[1] Galān J E,Collmer A.Type Ⅲ secretion machines:Bacterial devices for protein delivery into host cells [J].Science,1999,284(21):1322-1328.
[2] Staskawicz B J.Genetics of plant pathogen interactions specifying plant disease resistance [J].Plant,2001,25(1):73-76.
[3] Wei Z M,Laby R J,Zumoff C H,et al.Harpin,elicitor of the hypersensitive response produced by the plant pathogenErwiniaamylovora[J].Science,1992,257:85-88.
[4] Gopalan S,He S Y.Bacterial genes involved in the elicitation of hypersensitive response and pathogenesis [J].Plant Disease,1996,80:604-610.
[5] 杨 军,尹启生,宋纪真,等.植物病原菌的hrp基因 [J].遗传,2005,27(5):852-858.
Yang J,Yin Q S,Song J Z,et al.Review onhrpgenes of plant pathogenic bacteria [J].Hereditas,2005,27(5):852-858.(in Chinese)
[6] 赵延鹏,姜伯乐,何勇强,等.十字花科黑腐病菌hrpW基因导入油菜之研究初报 [J].中国农学通报,2007,23(4):67-70.
Zhao Y P,Jiang B L,He Y Q,et al.Preliminary report on obtaining transgenicBrassicanapusL.HarboringhrpWgene ofXanthomonascampestrispv.campestris[J].Chinese Agricultural Science Bulletin,2007,23(4):67-70.(in Chinese)
[7] 李先平,何云昆.通过农杆菌介导把HarpinEa基因导入马铃薯的初步研究 [J].云南农业大学学报,2002,17(3):252-257.
Li X P,He Y K.Analysis of late blight resistance in transgenic potato expressingHarpinEagene [J].Journal of Yunnan Agricultural University,2002,17(3):252-257.(in Chinese)
[8] 黄先群,蒋敏华,陈 坚,等.转hrap基因马铃薯获得晚疫病抗性研究 [J].分子植物育种,2011,9(2):218-223.
Huang X Q,Jiang M H,Chen J,et al.Integrating thehrapgene from sweet pepper into potato enhances resistance toPhytopthorainfestans[J].Molecular Plant Breeding,2011,9(2):218-223.(in Chinese)
[9] 黄 婷,袁治理,成巨龙,等.烟草对蚀纹病毒和马铃薯Y病毒的抗病性鉴定 [J].西北农林科技大学学报:自然科学版,2012,40(6):107-113.
Huang T,Yuan Z L,Cheng J L,et al.Identification of resistance to TEV and PVY in tobacco varieties [J].Journal of Northwest A&F University:Nat Sci Ed,2012,40(6):107-113.(in Chinese)
[10] 张云月,付永平,王丕武,等.转hrpZPsta抗病基因大豆的研究 [J].西北农林科技大学学报:自然科学版,2011,39(9):86-91.
Zhang Y Y,Fu Y P,Wang P W,et al.Study on transforminghrpZPstagene into soybean [J].Journal of Northwest A&F University:Nat Sci Ed,2011,39(9):86-91.(in Chinese)
[11] 尹俊琦,王 楠,周 莹,等.两个大豆品种转hrpZPsta基因后代对大豆灰斑病的抗性分析 [J].大豆科学,2013,32(2):238-241.
Yin J Q,Wang N,Zhou Y,et al.Analysis on resistance to frogeye leaf spot between two species of transgenic soybean progenies withhrpZPstagene [J].Soybean Science,2013,32(2):238-241.(in Chinese)
[12] 姜兆远,邹晓薇,高 洁,等.大豆细菌性斑点病菌harpin编码基因的克隆与表达 [J].微生物学报,2009,49(10):1403-1407.
Jiang Z Y,Zou X W,Gao J,et al.Cloning and expressing of a harpin-encoding gene fromPseudomonassyringaepv.glycinea[J].Acta Microbiologica Sinica,2009,49(10):1403-1407.(in Chinese)
[13] 王金生.植物病原细菌学 [M].北京:中国农业出版社,2000:258-264.
Wang J S.Plant bacteriology [M].Beijing:Agricultrue Publishing House in China,2000:258-264.(in Chinese)
[14] 陈功友,张 兵,武晓敏,等.大豆斑疹病菌harpin编码基因的克隆与特性研究 [J].微生物学报,2005,45(4):496-499.
Chen G Y,Zhang B,Wu X M,et al.Cloning and characterization of an harpin_encoding gene fromXanthomonasaxonopodispv.glycinesrequired for hypersensitive response on nonhost plant tobacco [J].Acta Microbiologica Sinica,2005,45(4):496-499.(in Chinese)
[15] 谭放军,徐泽安,尹文雅,等.Harpin蛋白研究进展及其应用 [J].湖南农业科学,2003(6):38-40.
Tan F J,Xu Z A,Yin W Y,et al.Studies on Harpin protein and its application [J].Hunan Agricultural Sciences,2003(6):38-40.(in Chinese)
[16] 白庆荣,朱俊华,刘晓玲.利用RNA介导的抗病性获得抗2种病毒的转基因烟草 [J].植物病理学报,2005,35(2):148-154.
Bai Q R,Zhu J H,Liu X L,et al.Production of transgenic tobacco plants resistant to two viruses via RNA-mediated virus resistance [J].Acta Phytopathologica Sinica,2005,35(2):148-154.(in Chinese)
[17] 黄 婷,柯美福,陈 伟,等.烟草品种对烟草花叶病毒病和黄瓜花叶病毒病的抗性鉴定 [J].植物保护,2012,38(5):115-119.
Huang T,Ke M F,Chen W,et al.Identification of tobacco variety resistance to Tobacco mosaic virus and Cucumber mosaic virus [J].Plant Protection,2012,38(5):115-119.(in Chinese)
Transgenic tobacco withhrpZPsg12gene and evaluation of its resistance
YANG Li-na1,LIU Xing-na2,LU Bao-hui1,WU Xiang-yu1, BAI Qing-rong1,WANG Xue1,GAO Jie1
(1CollegeofAgronomy,JilinAgriculturalUniversity,Changchun,Jinlin130118,China;2AgriculturalTechnologyExtensionStationofLiaoyuanCity,Liaoyuan,Jinlin136300,China)
【Objective】hrpZPsg12gene fromPseudomonassyringaepv.glycineaPsg12 strain was imported to tobacco variety “Yunyan 87” and the disease resistance to TMV,PVY andPseudomonassyringaepv.tabaciwas identified to provide reference for cultivating resistant tobacco varieties.【Method】hrpZPsg12gene was transferred into “Yunyan 87” by agrobacterium-mediated transformation method.Transgenic plants of T0generation and T1generation were detected by PCR,Southern blot and resistance assay.The disease resistance of T1generation plants was also evaluated.【Result】 PCR detection showed that this study obtained 7 positive transgenic plant lines in T0generation and 35 plant lines in T1generation,indicating thathrpZPsg12gene could inherit in transgenic plants.Southern blot for T1generation confirmed thathrpZPsg12gene was integrated into tobacco.Resistance assay confirmed that T1generation had high resistance against TMV and PVY,and moderate resistance againstPseudomonassyringaepv.tabaci.【Conclusion】 A total of 20 transgenic plants lines with high resistance against TMV and PVY and 15 transgenic plants lines with moderate resistance againstPseudomonassyringaepv.tabaciwere obtained.
tobacco;hrpZPsg12gene;transformation;multiple resistance transgenic plants
时间:2015-09-09 15:41
10.13207/j.cnki.jnwafu.2015.10.010
2014-03-10
吉林省科技发展计划项目(20090211);吉林省烟草公司长春市分公司和湖南中烟工业有限责任公司联合资助项目(2012130073);吉林农业大学青年启动基金项目(201029);吉林农业大学博士科研启动基金项目(201106)
杨丽娜(1981-),女,吉林扶余人,实验师,硕士,主要从事植物病害综合治理研究。E-mail:yanglina2004@sina.com
高 洁(1965-),女,吉林梨树人,教授,博士生导师,主要从事植物病害综合治理研究。E-mail:jiegao115@126.com
S572.034
A
1671-9387(2015)10-0070-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150909.1541.020.html

