柱前衍生RP-HPLC法测定狗尾草种子氨基酸含量
赵 岩,唐国胜,侯莹莹,郜玉钢,王士杰,蔡恩博,张连学
(1 吉林农业大学 中药材学院,吉林 长春 130118;2 吉林农业科技学院 中药学院,吉林 吉林 132101)
柱前衍生RP-HPLC法测定狗尾草种子氨基酸含量
赵 岩1,唐国胜1,侯莹莹1,郜玉钢1,王士杰2,蔡恩博1,张连学1
(1 吉林农业大学 中药材学院,吉林 长春 130118;2 吉林农业科技学院 中药学院,吉林 吉林 132101)
【目的】 采用柱前衍生反相高效液相色谱(RP-HPLC)法检测狗尾草种子中游离氨基酸和水解氨基酸含量,为阐明其应用价值提供支撑。【方法】 制备狗尾草种子的水解氨基酸样品溶液和游离氨基酸样品溶液,以异硫氰酸苯酯和三乙胺进行柱前衍生,建立RP-HPLC法,检测方法的精密性、稳定性、重复性。利用RP-HPLC法,采用梯度洗脱方法,检测狗尾草种子中游离氨基酸和水解氨基酸含量。【结果】 21种氨基酸的检测浓度线性范围为0.001 9~2.700 0 μmol/mL,相关系数R2均≥0.999 0。21种游离氨基酸的平均加样回收率在87.50%~100.20%,相对标准偏差(RSD )在0.82%~2.46%;水解氨基酸的平均加样回收率在91.10%~100.21%,RSD 在0.52%~2.08%。必需氨基酸和半必需氨基酸在狗尾草21种游离氨基酸和水解氨基酸中均含有,但水解后色氨酸、天冬酰胺、组胺酰胺遭到了破坏,含量较低。【结论】 建立的氨基酸测定方法稳定、快速、精密度高、线性范围宽,适合狗尾草种子中游离氨基酸和水解氨基酸的含量测定。狗尾草种子中含有丰富的游离和水解氨基酸。
狗尾草种子;氨基酸;反相高效液相色谱法;柱前衍生化
狗尾草(Setariaviridis(L.) Beauv.)为禾本科狗尾草属一年生草本植物,在全球分布广泛,一直被人们视为害草,而忽略了其药用价值。《本草纲目》、《本草纲目拾遗》等中药典籍中有记载:狗尾草具有除热、去湿、消肿、治痈肿、疮癣、赤眼的功效。贤景春等[1]对狗尾草多酚提取及其抗氧化性进行了研究,但对于狗尾草种子中游离氨基酸及水解氨基酸含量尚未见相关报道。而氨基酸有多种药理作用,例如:谷氨酸是生物机体内氮代谢的基本氨基酸之一,是动物体内中枢神经系统的一种重要的兴奋性神经递质,与脑蛋白质和糖代谢、促进氧化过程、改善中枢神经系统紧密相关;亮氨酸可作为营养增补剂、调味增香剂,也可配制氨基酸输液及综合氨基酸制剂、降血糖剂、植物生长促进剂等。氨基酸水解方法主要有酸水解法、氧化水解法、微波辅助水解法[2-5]等,测定方法主要有氨基酸自动分析仪分析法、高效液相色谱法、细管电泳法、紫外检测法等[6-10]。柱前衍生高效液相色谱法(RP-HPLC)测定氨基酸具有选择性高、分析速度快和灵敏度高等优点,在药物和临床样品氨基酸分析中得到了广泛应用,已成为一种较为理想的氨基酸检测方法。本试验利用RP-HPLC检测了狗尾草种子中的氨基酸含量,以期为狗尾草种子的进一步研究和开发利用提供参考。
1 材料与方法
1.1 材 料
狗尾草种子采收于吉林农业大学校园内,经该校张连学教授鉴定,阴干,备用。
1.2 仪器与试剂
CXTH-3000高效液相色谱仪(北京创新通恒科技有限公司);DHG-9140A型恒温干燥箱(上海精宏实验设备有限公司);2XZ-4型旋片式真空泵(上海博一泵业制造有限公司);DZF6020真空干燥器(上海恒科学仪器有限公司);氨基酸水解管(北京康农科技发展有限公司);PHS-W微机型Ph/mV酸度剂(上海般特仪器有限公司)。甲醇、乙腈,色谱纯;异硫氰酸苯酯(PITC),化学纯;21种氨基酸(国药集团化学试剂有限公司),分析纯。其他试剂均为分析纯试剂。
1.3 方 法
1.3.1 试剂的配制 流动相A:精密称取15 g乙酸钠,加纯净水溶解,用乙酸调pH为 6.5,加水至1.85 L,加140 mL乙腈,摇匀,0.45 μm滤膜过滤,即得0.1 mol/L乙酸钠(pH 6.50)与乙腈体积比为93∶7的流动相A。
流动相B:精密量取乙腈800 mL,水200 mL,混匀,0.45 μm滤膜过滤,即得乙腈与水体积比为 4∶1 的流动相B。
衍生试剂A (即异硫氰酸苯酯试剂贮备液):取2 mL异硫氰酸苯酯置10 mL量瓶中,用乙腈稀释至刻度,即得。
衍生试剂B (即三乙胺试剂贮备液):取2 mL三乙胺置10 mL容量瓶中,用乙腈稀释至刻度,即得。
1.3.2 氨基酸标准溶液的配制 准确称取天冬氨酸(Asp)16.7 mg、谷氨酸(Glu)18.4 mg、丝氨酸(Ser)13.13 mg、甘氨酸(Gly) 9.38 mg、组氨酸(His)19.39 mg、精氨酸(Arg)21.77 mg、苏氨酸(Thr)14.90 mg、丙氨酸(Ala)11.13 mg、脯氨酸(Pro)14.39 mg、胱氨酸(Cys-Cys)14.02 mg、半胱氨酸(Cys)15.14 mg、缬氨酸(Val)14.64 mg、甲硫氨酸(Met)18.64 mg、异亮氨酸(Lle)16.39 mg、亮氨酸(Leu)16.39 mg、酪氨酸(Tyr)22.64 mg、苯丙氨酸(Phe)20.64 mg、色氨酸(Trp)25.51 mg、赖氨酸(Lys)18.27 mg、天冬酰胺(Asn)16.70 mg和谷氨酰胺(Gln)18.26 mg,加0.1 mol/L盐酸超声溶解,配制胱氨酸浓度为0.625 μmol/mL、其他标样浓度为1.25 μmol/mL的标准溶液,4 ℃保存。
1.3.3 供试品溶液的制备与衍生 (1)游离氨基酸供试品溶液。 精密称取狗尾草种子样品0.5 g,加入体积分数50%乙醇溶液50 mL,超声提取30 min,用滤纸过滤,滤渣再加入体积分数50%乙醇溶液 30 mL,超声提取 30 min,过滤,合并2次所得滤液于 80 ℃水浴中挥发至近干,用体积分数50%乙醇溶液定容至10 mL。取1 mL提取液,加入衍生试剂A 和B 各1 mL,于50 ℃水浴中保持 45 min,加入正己烷1 mL萃取,取下层溶液用0.45 μm 滤膜过滤,进行HPLC分析。
(2) 水解氨基酸供试品溶液。 采用酸水解的方法处理狗尾草种子样品,参考李玉玲等[4]在吹N2状态下封口的方法,本试验采用抽真空后充氮气,保证氮气充满水解管,以防止氨基酸氧化的方法进行试验。具体操作是,精密称取样品0.1 g,置于氨基酸水解管中,加入6 mol/L盐酸10 mL、体积分数1%苯酚1 mL,重复抽真空充氮气3次,置于110 ℃烘箱中水解24 h;水解后置于80 ℃水浴挥发干,加入2 mL水,重复该操作2次,尽可能多地挥发掉盐酸;加入2 mL水,超声1 min使溶解并定容于10 mL容量瓶中,吸取1 mL提取液,加入衍生试剂A 和B 各1 mL,于50 ℃水浴中保持45 min,加入正己烷1 mL萃取,取下层溶液用0.45 μm滤膜过滤,进行HPLC分析。
1.3.4 色谱条件 色谱柱:Ultimate Amino Acid氨基酸色谱专用柱(4.6 mm×250 mm,5 μm),流速:1.0 mL/min,检测波长:254 nm,柱温:36 ℃,进样量:10 μL。流动相梯度为:0 min, A;11 min,6.5%B+93.5%A;13.9 min,11%B+89%A;17 min,13.4%B+86.6%A;29 min,30%B+70%A;32 min,70%B+30%A;35 min,B;42 min, B;45 min,A;60 min,A。
1.4 HPLC方法考察
1.4.1 线性关系考察 分别取氨基酸标准溶液 0.01,0.05,0.10,0.50,1.00 mL,按1.3.3节方法衍生后进行HPLC。以各氨基酸峰面积为纵坐标(y),氨基酸浓度(μmol/mL)为横坐标(x),做线性回归。
1.4.2 精密度试验 取混合氨基酸标准溶液1 mL,按1.3.3节方法衍生后进行HPLC分析,连续进样5 次,测定峰面积,考察方法的精密度。
1.4.3 稳定性试验 取1.3.3节供试品溶液1 mL,分别于0,1,2,4,6,8,12 h 进行HPLC分析,测定峰面积,考察方法的稳定性。
1.4.4 重复性试验 取同一批狗尾草种子粉末,按1.3.3节方法制备游离氨基酸和水解氨基酸的供试品溶液并衍生化,进行HPLC分析,平行测6次,测定峰面积,并计算氨基酸含量,考察方法的重复性。
1.4.5 加标回收率试验 (1)游离氨基酸加样回收率。 精密称取已知氨基酸含量的狗尾草种子粉末(与重复性试验同批次)0.25 g,加入混合氨基酸标准溶液1 mL,按游离氨基酸检测方法分别提取、衍生、进样,平行6 次,计算各氨基酸的回收率。
(2)精密称取已知氨基酸含量的狗尾草种子粉末0.05 g,加入混合氨基酸标准溶液1 mL,按水解氨基酸检测方法分别提取、衍生、进样,平行6 次,计算各氨基酸的回收率。
1.5 氨基酸含量测定
取狗尾草种子样品,按本研究建立的RP-HPLC法分别测其游离氨基酸和水解氨基酸含量。
2 结果与分析
2.1 HPLC方法考察
2.1.1 线性关系 由表1可见, 21种氨基酸的检测浓度在0.001 9~2.700 0 μmol/mL内与各自峰面积呈良好的线性关系,相关系数R2均≥0.999 0。

表1 21种氨基酸的线性回归方程Table 1 Linear regression equations of 21 amino acids
2.1.2 精密度 21种氨基酸峰面积的相对标准偏差(RSD) 在0.61%~1.12%(n=5),表明仪器精密度良好。
2.1.3 稳定性 在0~12 h,21种氨基酸峰面积的RSD在0.62%~2.23%(n=9),表明供试品溶液在12 h内比较稳定。
2.1.4 重复性 21种游离氨基酸相对含量的RSD 在0.91%~2.41%(n=6),21种水解氨基酸相对含量的RSD 在0.82%~2.31%(n=6),表明本方法重复性良好。
2.1.5 加样回收率 21种游离氨基酸的平均回收率在87.50%~100.20%,RSD在0.82%~2.46%。21种水解氨基酸的平均回收率在91.10%~100.21%,RSD 在0.52%~2.08%。
2.2 狗尾草种子中的氨基酸含量
样品色谱图见图1。
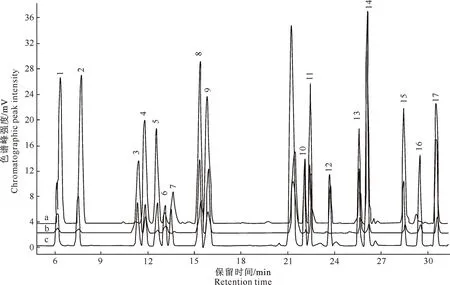
图1 狗尾草种子中氨基酸含量测定的高效液相色谱a.标准品;b.游离氨基酸;c.水解氨基酸;1.天冬氨酸;2.谷氨酸;3.天冬酰胺;4.丝氨酸;5.甘氨酸;6.谷氨酰胺;7.组氨酸;8.苏氨酸+脯氨酸+丙氨酸;9.精氨酸;10.酪氨酸;11.缬氨酸;12.胱氨酸;13.甲硫氨酸;14.半胱氨酸+亮氨酸+异亮氨酸;15.苯丙氨酸;16.色氨酸;17.赖氨酸
狗尾草种子中游离氨基酸总量可达到5.4%,水解后的氨基酸总量可达到45.7%。由表2可见,狗尾草种子中游离氨基酸含测定的全部21种氨基酸,氨基酸的含量丰富而全面;含量最高的为天冬酰胺(2 260.18 mg/hg),其次是精氨酸(636.66 mg/hg),胱氨酸的含量最低(20.71 mg/hg)。
21种水解氨基酸含量明显比游离氨基酸含量高,在水解氨基酸中,人体必需的氨基酸如色氨酸、亮氨酸、赖氨酸、苏氨酸、缬氨酸、异亮氨酸、苯丙氨酸和甲硫氨酸均有,且与其他氨基酸相比,必需氨基酸含量都相对较高,色氨酸含量最低为562.84 mg/hg。水解氨基酸也含有半必需氨基酸精氨酸、组氨酸,其中精氨酸含量较高,达6 731.49 mg/hg,在细胞分裂、伤口复原、免疫功能、激素分泌等方面均有重要作用[11-14]。谷氨酸在生物体内的蛋白质代谢过程中占重要地位,参与动物、植物和微生物中的许多重要化学反应,因其特殊作用,在医药、食品及化工等行业有着广泛的应用,并参与氨的去毒作用[15-16]。狗尾草种子中谷氨酸含量很高,达5 677.48 mg/hg。蛋白质酸水解氨基酸是一种常用的方法,多数氨基酸在酸性条件下较稳定。但在酸水解过程中,色氨酸会被破坏,天冬酰胺和谷氨酰胺也会脱酰胺基,因此水解后这3种氨基酸含量较低。
表2 狗尾草种子中游离氨基酸和水解氨基酸的种类及含量
Table 2 Types and contents of free amino acids and total amino acids in seeds of Setaria viridis (L.) Beauv. mg/hg
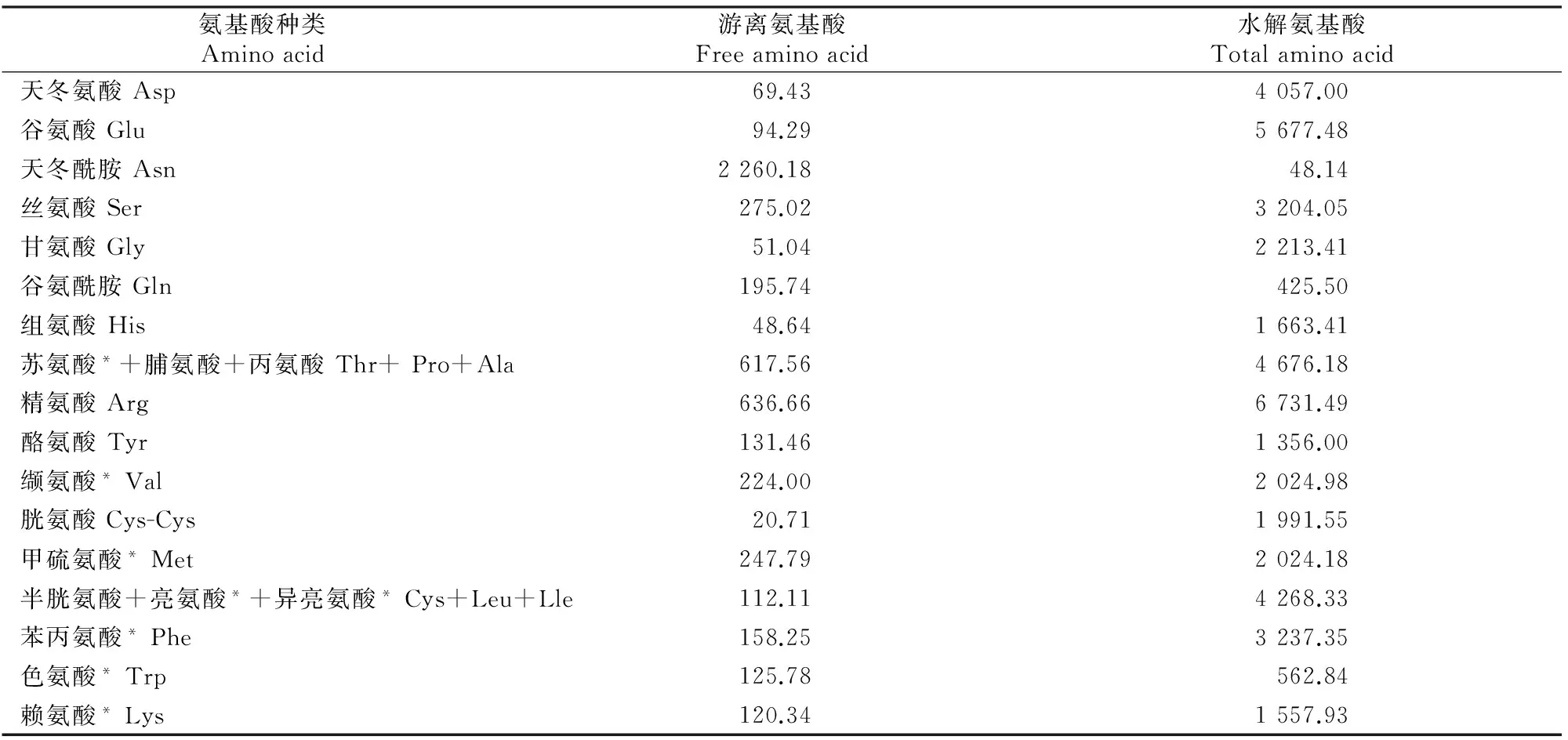
氨基酸种类Aminoacid游离氨基酸Freeaminoacid水解氨基酸Totalaminoacid天冬氨酸Asp69.434057.00谷氨酸Glu94.295677.48天冬酰胺Asn2260.1848.14丝氨酸Ser275.023204.05甘氨酸Gly51.042213.41谷氨酰胺Gln195.74425.50组氨酸His48.641663.41苏氨酸*+脯氨酸+丙氨酸Thr+Pro+Ala617.564676.18精氨酸Arg636.666731.49酪氨酸Tyr131.461356.00缬氨酸*Val224.002024.98胱氨酸Cys-Cys20.711991.55甲硫氨酸*Met247.792024.18半胱氨酸+亮氨酸*+异亮氨酸*Cys+Leu+Lle112.114268.33苯丙氨酸*Phe158.253237.35色氨酸*Trp125.78562.84赖氨酸*Lys120.341557.93
注:**代表必需氨基酸。
Note:*indicates essential amino acids.
3 讨 论
本研究在预试验中,对不同浓度盐酸进行了考察,发现当盐酸浓度较低时,有利于色氨酸、天冬酰胺、谷氨酰胺水解及检测,但整体水解效果不佳;当盐酸浓度为6 mol/L时,除色氨酸、天冬酰胺和谷氨酰胺3种氨基酸外,其余氨基酸水解效果最佳,因此本试验采用6 mol/L盐酸水解氨基酸。在以往的研究中,水解氨基酸时未对色氨酸、天冬酰胺和谷氨酰胺进行测定[17-19],本试验对这3种氨基酸也进行了检测,但水解后的含量不能准确测定,因此若要检测此3种水解氨基酸含量应采用其他水解方法。
本试验建立了一种利用反相高效液相色谱测定狗尾草种子中游离氨基酸和水解氨基酸含量的方法。该方法稳定、快速、精密度高、线性范围宽,适用于狗尾草种子中游离氨基酸和水解氨基酸含量的测定。本试验结果表明,狗尾草种子中含有所有人体必需的氨基酸,游离氨基酸总量可达到5.4%,水解后的氨基酸总量可达到45.7%,可见狗尾草种子中氨基酸的资源极其丰富,是一种可以充分利用的资源,有着很好的实际利用价值和广阔的开发前景。
[1] 贤景春,高 威.狗尾巴草多酚提取及抗氧化性研究 [J].四川农业大学学报,2012,30(3):348-351.
Xian J C,Gao W.Study on the extraction of polyphenols and antioxidant activity of the HerbaSetariaeviricis[J].Journal of Sichuan Agricultural University,2012,30(3):348-351.(in Chinese)
[2] 欧金秀,谷陟欣,张妮瑜,等.柱前衍生HPLC同时测定驴胶补血颗粒中6种水解氨基酸 [J].中国实验方剂学杂志,2012,18(16):93-96.
Ou J X,Gu Z X,Zhang N Y,et al.Determination of 6 amino acids in Lujiao Buxue Keli by pre-column derivation HPLC [J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(16):93-96.(in Chinese)
[3] Zhang H,Wang Z Y,Yang X,et al.Determination of free amino acids and 18 elements in freeze-dried strawberry and blueberry fruit using an amino acid analyzer and ICP-MS with micro-wave digestion [J].Food Chemistry,2014(147):189-194.
[4] 李玉玲,李卫华,杨秀清.反相高效液相色谱法检测奶粉中含硫氨基酸 [J].食品科学,2012,33(8):167-170.
Li Y L,Li W H,Yang X Q.Determination of sulfur-containing amino acids in milk powder by reverse-phase high performance liquid chromatography [J].Food Science,2012,33(8):167-170.(in Chinese)
[5] Sandoval W N,Pham V C,Lill J R.Recent developments in microwave assisted protein chemistries-can this be integrated into the drug discovery and validation process [J].Drug Discovery Today,2008(13):1075-1081.
[6] 张 嵩,李 峰.不同规格鹿茸商品药材中氨基酸含量分析 [J].中国中药杂志,2013,38(12):1919-1923.
Zhang S,Li F.Analysis of amino acids in medicinal materials of different specifications of pilose antler products [J].China Journal of Chinese Materia Medica,2013,38(12):1919-1923.(in Chinese)
[7] 张 波,刘红燕,李洪芹.柱前衍生高效液相色谱法测定鬼针草属药用植物氨基酸的含量 [J].食品与药品,2013,15(2):98-100.
Zhang B,Liu H Y,Li H Q.Determination of amino acids in bidens by HPLC coupled with pre-column derivatization [J].Food and Drug,2013,15(2):98-100.(in Chinese)
[8] 辛敏通,傅欣彤,陈有根.柱前衍生化UPLC测定板蓝根颗粒中主要游离氨基酸的含量 [J].中国中药杂志,2011,36(23):3306-3308.
Xin M T,Fu X T,Chen Y G.Determination of the main free amino acids in banlangen granules by pre-column derivation UPLC [J].China Journal of Chinese Materia Medica,2011,36(23):3306-3308.(in Chinese)
[9] 赵雅静.微波衍生毛细管电泳法测定金银花和奶粉中的氨基酸 [D].长春:吉林大学,2013.
Zhao Y J.Determination of amino acids in flower ofLonicerajaponicaThunb.and powdered milk by microwave derivatization capillary [D].Changchun:Jilin University,2013.(in Chinese)
[10] 杜雪莉,张凤枰,刘耀敏.微波辅助蛋白质水解效果稳定性研究 [J].食品科学,2011,32(8):121-124.
Du X L,Zhang F P,Liu Y M.Stability of microwave-assisted acid hydrolysis of protein [J].Food Science,2011,32(8):121-124.(in Chinese)
[11] 陈亚军,齐玉梅,项 琦,等.谷氨酰胺和精氨酸对创伤后大鼠血浆蛋白和抗氧化能力的影响 [J].天津医科大学学报, 2008,14(2):229-231.
Chen Y J,Qi Y M,Xiang Q,et al.Effect of glutamine and arginine on plasma protein and antioxidation in traumatic rats [J].Journal of Tianjin Medical University,2008,14 (2):229-231.(in Chinese)
[12] 袁中彪,陈代文.精氨酸的免疫作用 [J].饲料工业,2003,24(3):35-36.
Yuan Z B,Chen D W.The immune function of arginine [J].Feed Industry,2003,24(3):35-36.(in Chinese)
[13] 姜丽丽,王 安,李珍珍,等.精氨酸对笼养育雏期蛋鸭生产性能及抗氧化功能的影响 [J].饲料工业,2013,34(12):30-33.
Jiang L L,Wang A,Li Z Z,et al.Effect of arginine on growth performance and antioxidant function of caged egg-type duckling [J].Feed Industry,2013,34(12):30-33.(in Chinese)
[14] 王琤韦华.精氨酸对仔猪宫内发育及N-氨甲酰谷氨酸对断奶仔猪生长的影响 [D].南昌:江西农业大学,2012.
Wang Z H.Effects of arginine on intrauterine growth,N-carbamoylglutamate on growth of piglets [D].Nanchang:Jiangxi Agricultural University,2012.(in Chinese)
[15] 李赛钰,王 晓,马广存,等.毛白杨雄花序营养成分分析及评价 [J].山东科学,2004,17(3):10-12.
Li S Y,Wang X,Ma G C,et al.PopulustomantosaCarr.nutritional composition of analysis and evaluation [J].Shandong Science,2004,17(3):10-12.(in Chinese)
[16] 邓毛程,梁世中.二次接种叠加生物素的谷氨酸发酵工艺研究 [J].食品与发酵工业,2007(7):1-5.
Deng M C,Liang S Z.Second vaccination superposition of biotin glutamic acid fermentation research [J].Food and Fermentation Industries,2007(7):1-5.(in Chinese)
[17] 刘利娥,常爱武,韩 萍,等.反相高效液相色谱法测定野生四叶参中氨基酸 [J].郑州大学学报:医学版,2008,43(1):101-104.
Liu L E,Chang A W,Han P,et al.Determination of amino acids in wild codonop is lanceolata by RP-HPLC [J].Journal of Zhengzhou University:Medical Sciences,2008,43(1):101-104.(in Chinese)
[18] 白玉静,高晓燕,张宏桂,等.HPLC-ELSD法测定清开灵注射液中19种氨基酸含量 [J].中国中药杂志,2009,34(24):3301-3303.
Bai Y J,Gao X Y,Zhang H G,et al.Determination of 19 amino acids in Qingkailing injection by HPLC-ELSD [J].China Journal of Chinese Materia Medica,2009,34(24):3301-3303.(in Chinese)
[19] 王 薇,周正礼,李 健,等.高效液相色谱柱前衍生法测定金银花中氨基酸的含量 [J].辽宁中医杂志,2010,37(11):2212-2213.
Wang W,Zhou Z L,Li J,et al.Determination of amino acids inFlosloniceraeby HPLC coupled with pre-column derivatization [J].Liaoning Journal of Traditional Chinese Medicine,2010,37(11):2212-2213.(in Chinese)
Determination of amino acids in seeds ofSetariaviridis(L.) Beauv. by pre-column derivatization RP-HPLC
ZHAO Yan1,TANG Guo-sheng1,HOU Ying-ying1,GAO Yu-gang1,WANG Shi-jie2,CAI En-bo1,ZHANG Lian-xue1
(1ChineseMedicineMaterialCollegeofJilinAgriculturalUniversity,Changchun,Jilin130118,China;2CollegeofChineseMedicine,JilinAcademyofAgriculturalScienceandTechnology,Jilin,Jilin132101,China)
【Objective】 This study aimed to establish a method for determinating the contents of free and hydrolyzed amino acids from seeds ofSetariaviridis(L.) Beauv.by pre-column derivatization RP-HPLC.【Method】 The sample solution including free and hydrolyzed amino acids from the seeds ofSetariaviridis(L.) Beauv was prepared before being derived with phenyl isothiocyanate and triethylamine,and detected by HPLC.The precision,stability,and repeatability were detected before gradient elution chromatography was applied to determine the contents of free and hydrolyzed amino acids.【Result】 The 21 amino acids had good linearity in the range of 0.001 9-2.700 0 μmol/mL with correlation coefficients all over 0.999 0.The average recovery of free amino acids was 87.50%-100.20% (RSD=0.82%-2.46%).The average recovery of total amino acids was 91.10%-100.21%(RSD=0.52%-2.08%).There were essential amino acids and semi essential amino acids for human in seeds ofSetariaviridis(L.) Beauv.But tryptophan,asparagine,and histamine amide were compromised after hydrolysis.【Conclusion】 The established method was sensitive,accurate,reproducible,and reliable for determination of amino acids.Both free and hydrolyzed amino acids were rich in seeds ofSetariaviridis(L.) Beauv.
seeds ofSetariaviridis(L.) Beauv.;amino acids;RP-HPLC;pre-column derivation
时间:2015-08-05 08:57
10.13207/j.cnki.jnwafu.2015.09.026
2014-01-27
国家科技支撑计划项目(2011BAI03B01);国家公益性行业科研专项(201303111);科技部科技人员服务企业项目(2009GJB10031);吉林省科技发展计划项目(20130303094,20140204013YY,YYZX201258,20140311050YY)
赵 岩(1979-),男(满族),吉林长春人,副教授,博士,主要从事天然药物化学成分与生物活性研究。 E-mail:zhyjlu79@163.com
张连学(1955-),男,吉林长春人,教授,博士,主要从事药用植物栽培与加工研究。E-mail:zlx863@163.com
R917
A
1671-9387(2015)09-0185-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150805.0857.052.html

