球形芽孢杆菌BS-10高产培养基的优化
刘 美,王刘庆,廖美德,陆 亮
(华南农业大学 天然农药与化学生物学教育部重点实验室,广东 广州 510642)
球形芽孢杆菌BS-10高产培养基的优化
刘 美,王刘庆,廖美德,陆 亮
(华南农业大学 天然农药与化学生物学教育部重点实验室,广东 广州 510642)
【目的】 对杀蚊球形芽孢杆菌BS-10高产培养基进行优化,为该菌株的规模化生产提供理论依据。【方法】 以菌株BS-10菌体生物量、干质量和芽孢数为考察指标,对培养基中添加的碳、氮组成成分进行正交试验优化,并对优化所得培养基进行发酵罐扩大培养试验和生物活性测定。【结果】 菌株BS-10高产毒力最优培养基(NBFB)配方为胰蛋白胨3 g/L,牛肉膏1 g/L,鱼粉6 g/L,麸皮4 g/L;采用NBFB培养基,可将BS-10培养周期缩短至18 h,芽孢数达4.12×109CFU/mg,对致倦库蚊幼虫的毒力较基础培养基增大了100倍。【结论】 菌株BS-10在NBFB培养基扩大培养中,不仅获得了高产量,而且缩短了发酵周期,具有较好的应用潜力和经济价值。
球形芽孢杆菌;菌株BS-10;致倦库蚊;鱼粉;麸皮
LIU Mei,WANG Liu-qing,LIAO Mei-de,LU Liang
蚊虫是众所熟知的一种卫生害虫和传媒昆虫,能传播多种疾病,如疟疾、丝虫病、流行性乙型脑炎、登革热和黄热病等,给人类的健康和畜牧业生产带来了极大的威胁。球形芽孢杆菌(Bacillussphaericus,简称BS)作为蚊虫幼虫生物防治的有益细菌之一,不仅能够产生多种具有高选择性的杀蚊毒素(Bin,Mtx)[1-5],而且能够侵染蚊虫幼虫虫体并在其体内存活,延长持效期[6],这些优点使得其逐渐成为蚊虫幼虫防治化学农药的替代物。球形芽孢杆菌BS-10是江苏省里下河地区农业研究所选育的杀蚊幼高毒力菌株,其血清型与世界卫生组织(WHO)推荐的1593、2362菌株一样,同属H5a5b型,但其发酵液毒力比1593菌株高1.78~3.2倍,比2362菌株高 1.79 倍[7-8]。然而,实际应用中发现BS-10的毒力效价并不高,需要高剂量才能达到防治效果[9]。究其原因主要是由于其在多种培养基中的芽孢率不高,这限制了其高毒力制剂的发展。为了提高BS-10的芽孢率,本研究筛选出鱼粉和麸皮2种物质作为液体发酵培养基的组成成分,通过正交试验确定了各组分的最佳配比,并进行了实验室级发酵罐放大试验,以期为BS-10菌株的规模化生产提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试生物 球形芽孢杆菌(Bacillussphaericus)BS-10菌株由肇庆真格生物科技公司提供,并由华南农业大学天然农药与化学生物学教育部重点实验室保存。致倦库蚊(Culexquinquefasciatus)3龄末或4龄初幼虫由广东省疾病预防控制中心提供。
1.1.2 培养基材料 鱼粉、大豆粉、玉米粉、麸皮等副产品,均购于广州市花鸟虫鱼市场。
1.1.3 培养基 种子培养基、基础培养基(NB培养基):胰蛋白胨5 g、牛肉膏3 g、氯化钠5 g、去离子水1 000 mL(pH 7.0);NYSM培养基:胰蛋白胨5 g、牛肉膏3 g、氯化钠5 g、酵母粉0.5 g、MgCl2·6H2O 0.203 g、CaCl2·2H2O 0.103 g、MnCl2·4H2O 0.01 g、去离子水1 000 mL(pH 7.0)。
1.2 菌株BS-10种子液与发酵液的制备
刮取活化后的菌株BS-10菌苔 1~2环接种在装有20 mL种子培养基的250 mL 锥形瓶中,于30 ℃、180 r/min下振荡培养10 h得到种子液。将种子液以2%接种量(体积分数)接种到发酵培养基中,30 ℃、200 r/min 振荡培养24 h,得到发酵液。
1.3 菌体生物量及芽孢数的测定
取适量发酵液,用分光光度计在600 nm处测定其吸光度(OD600),以去离子水为对照,吸光度值OD600为标准判断菌体生物量(精确到0.1)。取100 mL发酵液,12 000×g下离心,去掉上清液,冷冻干燥,分析天平称菌体干质量(含有鱼粉和麸皮的发酵液离心之前用孔径25 μm筛子去掉残留物),进一步对比相同组分不同配比发酵液的菌体生物量(精确到 0.01)。芽孢数测定:准确称取0.1 g冻干菌粉溶于100 mL含有少量玻璃珠的无菌水中,振荡20 min,进行梯度稀释,将稀释后的菌液放入80 ℃水浴中加热12 min,冷却后,采用平板倾注计数法测算芽孢数(CFU/mg)。
1.4 培养基优化试验设计
1.4.1 碳源对菌株BS-10菌体生物量和芽孢数的影响 在基础培养基中分别添加5 g/L的葡萄糖、蔗糖、可溶性淀粉、甘露醇、麦芽糖、乙酸钠(CH3COONa)、麸皮,按1.2节的方法培养24 h,以基础培养基为对照,测定OD600和芽孢数。
1.4.2 氮源对菌株BS-10菌体生物量和芽孢数的影响 在基础培养基中分别添加3 g/L的鱼粉、大豆粉、花生饼粉、玉米粉、酵母粉、尿素、NH4NO3,按1.2节的方法培养24 h,以基础培养基为对照,测定OD600和芽孢数。
1.4.3 麸皮、鱼粉添加量对菌株BS-10菌体生物量和芽孢数的影响 将筛选出的最佳碳源(麸皮)、氮源(鱼粉)以不同添加量(质量分数0%,0.1%,0.3%,0.5%,0.7%,0.9%,1.1%,1.3%,1.5%)添加到基础培养基中,按1.2节的方法培养24 h,以基础培养基为对照,测定OD600和芽孢数。
1.4.4 培养基组分配比优化与正交试验设计 以基础培养基中的胰蛋白胨、牛肉膏及优化得到的麸皮和鱼粉进行4因素3水平的正交试验,采用 L9(34) 正交表确定培养基各组分的最佳配比(表1)。

表1 菌株BS-10培养基成分组合优化的正交试验设计Table 1 Orthogonal experiment design for medium composition optimization of BS-10 g/L
1.5 优化培养基扩大培养试验
以NYSM培养基为对照培养基,采用7 L发酵罐(NBS公司, BIO FLO 3000)和优化所得培养基NBFB对BS-10进行扩大培养,培养温度30 ℃,溶氧30%(采用搅拌转速-溶氧联合控制,初始转速300 r/min),通气量1 v/(v·min),每2 h取样1次,测定菌体生物量和芽孢数,记录发酵过程中的相关参数。
1.6 生物活性测定
参考WHO推荐的生物活性测定方法进行杀蚊幼虫活性测定[10]。称取一定量的BS-10菌粉,溶于蒸馏水中配制成质量浓度为1 g/L的母液。在(28±2) ℃下,以3龄末至4龄初的致倦库蚊幼虫为供试对象,设置7个质量浓度(10 mg/L,1 mg/L,100 μg/L,10 μg/L,1 μg/L,0.5 μg/L,0.1 μg/L),每个质量浓度重复3次,每20头幼虫置于100 mL待测药液中记为1次重复,记录48 h后的死亡数。以无菌水作对照,计算校正死亡率,用SPSS软件进行统计分析,计算LC50值。
2 结果与分析
2.1 菌株BS-10培养基组分的筛选
2.1.1 不同碳源对菌株BS-10菌体生物量和芽孢数的影响 试验结果(图1)表明,添加麸皮的BS-10菌株发酵液菌体生物量、芽孢数明显高于对照和其他处理组;添加葡萄糖、蔗糖、可溶性淀粉、甘露醇和麦芽糖的试验组与对照组无明显差异。综合菌体生物量和芽孢数2个因素,选择麸皮作为最佳碳源。
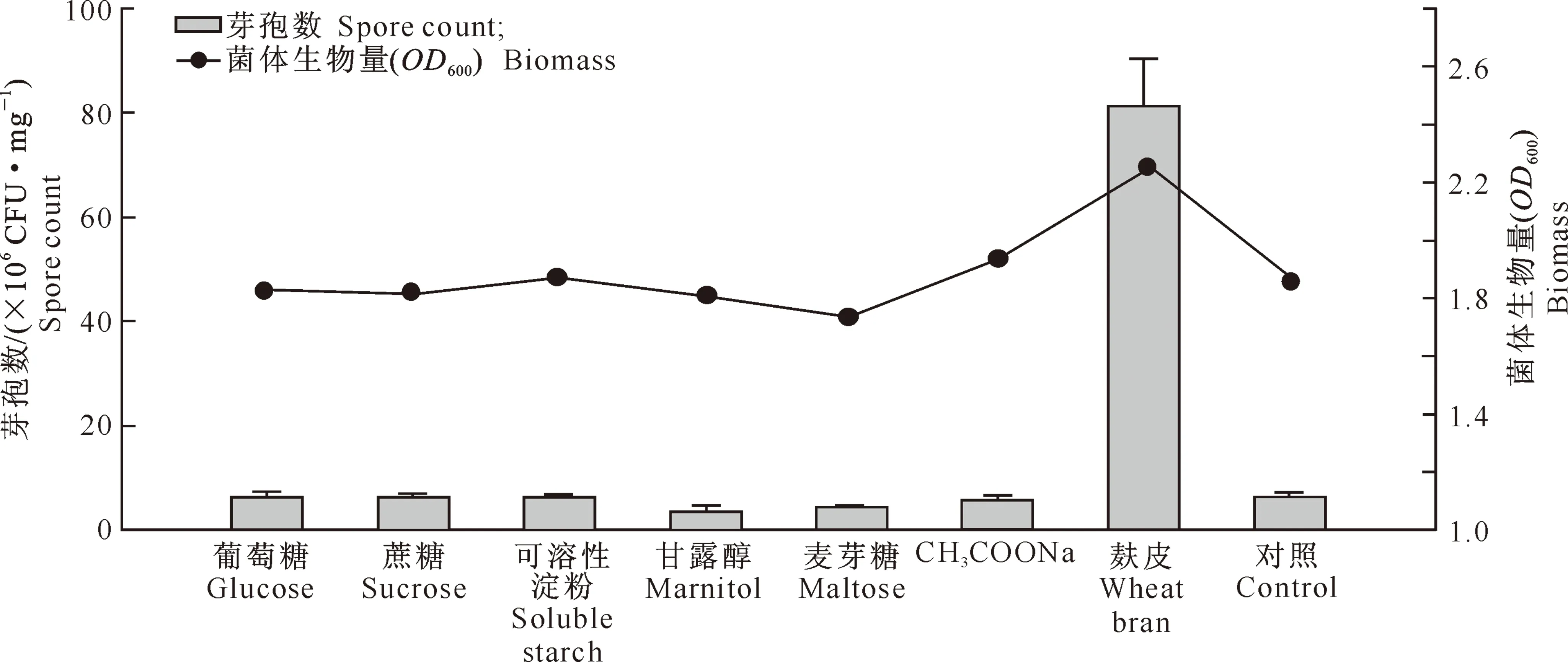
图1 碳源对菌株BS-10发酵菌体生物量和芽孢数的影响
2.1.2 不同氮源对菌株BS-10菌体生物量和芽孢数的影响 图2表明,添加鱼粉、大豆粉和花生饼粉均能促进BS-10的菌体生长,其中,鱼粉的芽孢数最高,大豆粉次之;添加玉米粉、酵母粉、尿素和NH4NO3的发酵液芽孢数均低于对照。综合菌体生物量和芽孢数2个因素,选择鱼粉作为最佳氮源。
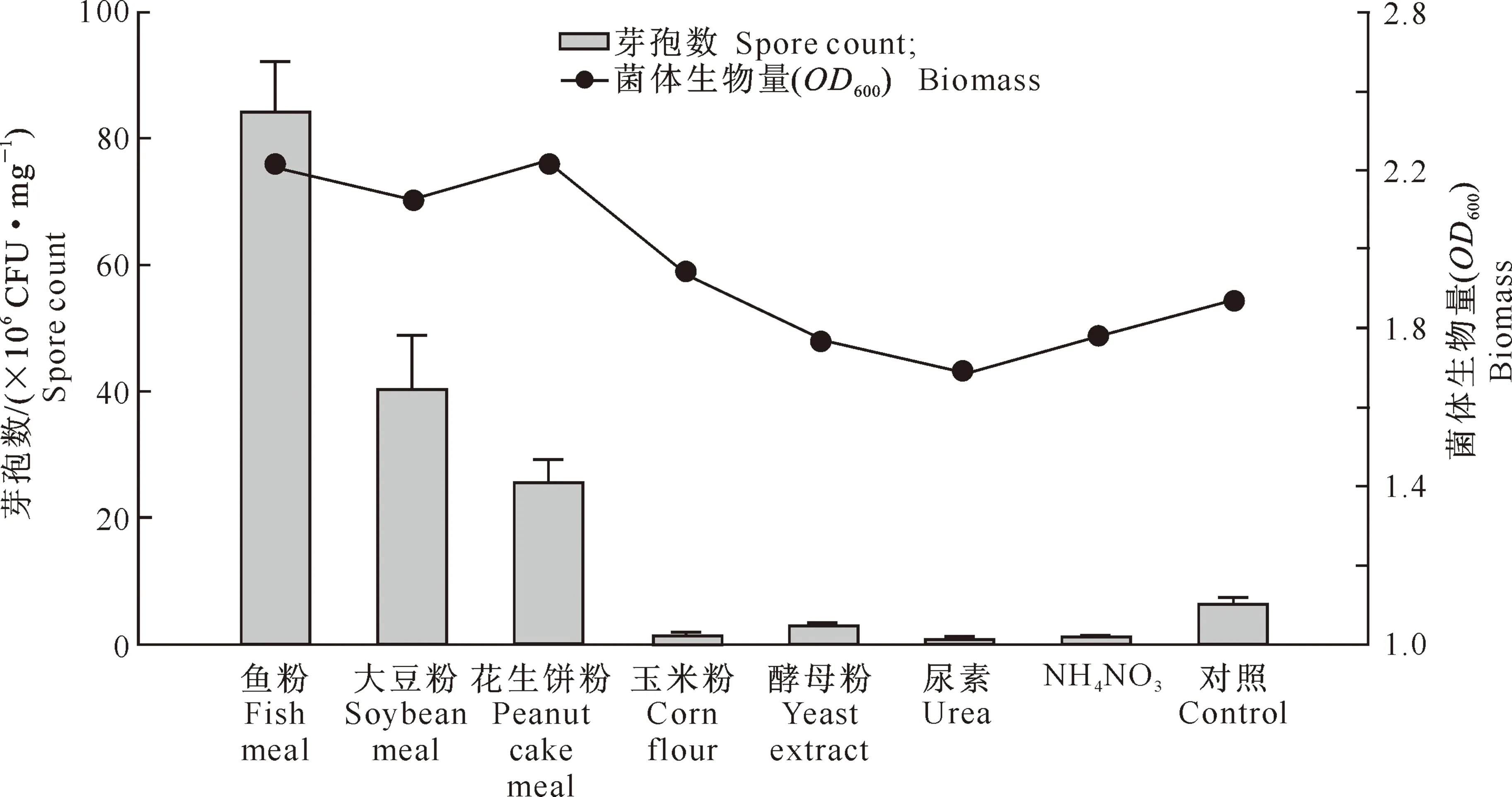
图2 氮源对菌株BS-10发酵菌体生物量和芽孢数的影响
2.1.3 鱼粉、麸皮添加量对菌株BS-10发酵菌体生物量和芽孢数的影响 试验结果(图3,图4)表明,随着鱼粉和麸皮在基础培养基中比例的增加,发酵液菌体生物量和芽孢数逐渐增大,当鱼粉的添加量为1.1%时,发酵液菌体生物量和芽孢数达到最大;当麸皮的添加量为1.1%和1.3%时,发酵液菌体生物量和芽孢数分别达到最大。但随着添加量的继续增大,发酵液菌体生物量和芽孢数呈下降趋势。因此,在培养基中同时添加鱼粉和麸皮时,其添加量之和不能大于1.3%。

图3 鱼粉添加量对菌株BS-10发酵菌体生物量和芽孢数的影响Fig.3 Effect of fish meal additive amount on biomass and spore count of BS-10
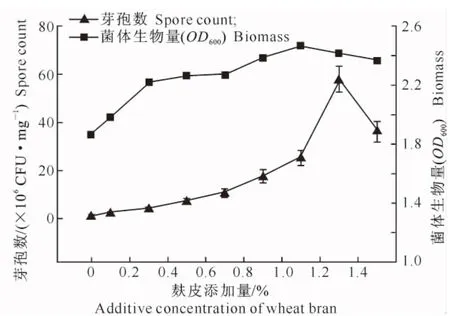
图4 麸皮添加量对菌株BS-10发酵菌体生物量和芽孢数的影响Fig.4 Effect of wheat bran additive amount on biomass and spore count of BS-10
2.2 菌株BS-10培养基组分的优化
正交试验结果表明,胰蛋白胨、牛肉膏、鱼粉和麸皮对菌株BS-10菌体生物量和芽孢数均有明显影响,具体结果见表2。
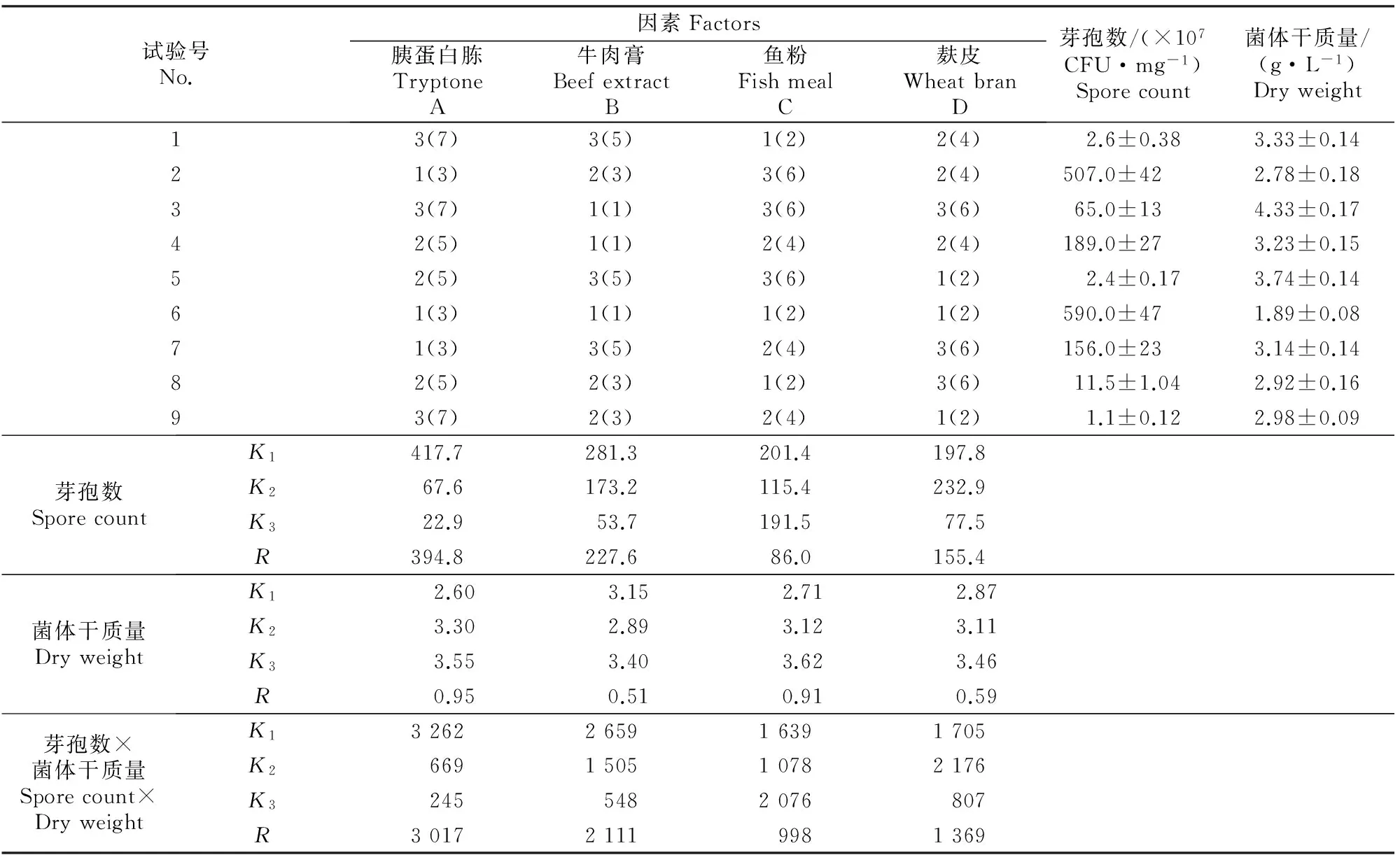
表2 菌株BS-10培养基成分组合优化的正交试验结果Table 2 Orthogonal experiment results for medium composition optimization of BS-10
表2表明,4因素对菌株BS-10芽孢数影响大小依次为:A>B>D>C,即胰蛋白胨>牛肉膏>麸皮>鱼粉;对菌体干质量影响大小依次为A>C>D>B,即胰蛋白胨>鱼粉>麸皮>牛肉膏。以芽孢数为考察指标时,培养基成分最优组合为A1B1C1D2;以菌体干质量为考察指标时,培养基成分最优组合为A3B3C3D3。因此,为同时保证菌体干质量和芽孢数,以菌体干质量和芽孢数的乘积为考察指标,此时培养基成分最优组合为A1B1C3D2,即胰蛋白胨3 g/L,牛肉膏1 g/L,鱼粉6 g/L,麸皮4 g/L(NBFB培养基)。
2.3 菌株BS-10优化培养基扩大培养试验结果
图5和图6结果表明,菌株BS-10在NYSM 培养基中6 h进入快速生长阶段,耗氧量在7~13 h迅速增加,而在NBFB培养基中培养3 h即进入快速生长阶段,耗氧量在3~7 h 迅速增加。
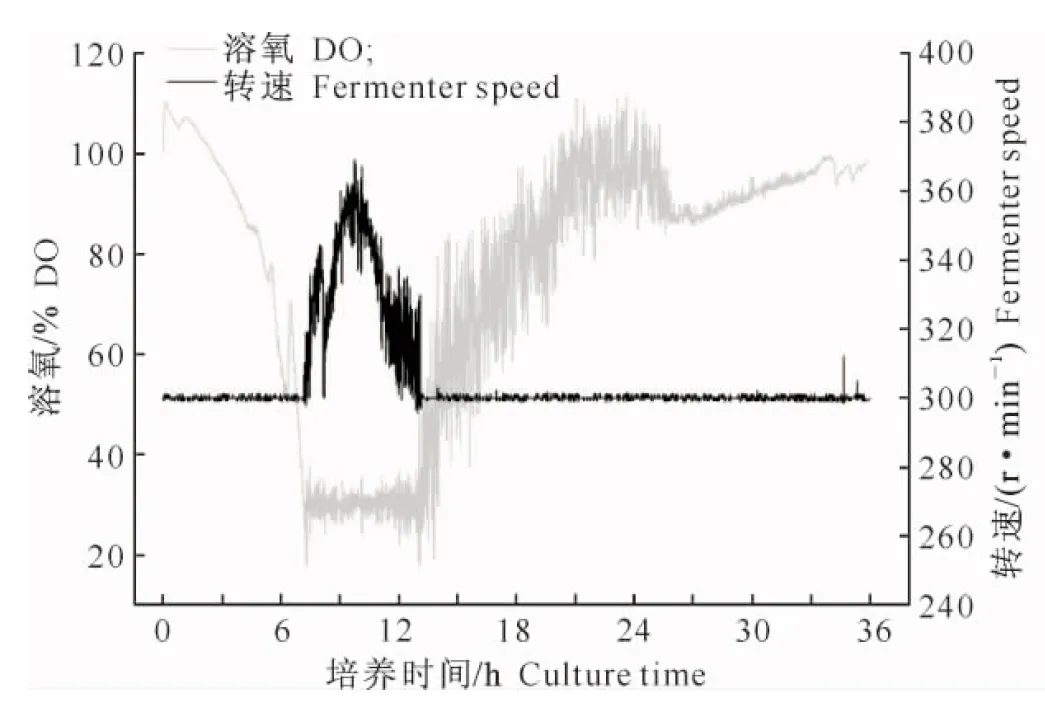
图5 菌株BS-10在NYSM 培养基中的溶氧和转速Fig.5 Dissolved oxygen and speed of BS-10 in NYSM medium

图6 菌株BS-10在NBFB培养基中的溶氧和转速Fig.6 Dissolved oxygen and speed of BS-10 in NBFB medium
图7结果进一步表明,BS-10在NBFB培养基中没有经过稳定期,即进入了快速生长的对数期,而在NYSM培养基中需要4 h的稳定期。显微镜观察芽孢萌发情况表明,BS-10菌株在NYSM培养基中培养22 h芽孢出现脱落,而在NBFB中培养18 h即出现脱落,说明菌株BS-10在NBFB培养基中发酵周期缩短了4 h。
2.4 不同培养基对致倦库蚊幼虫的毒力
表3结果表明,3种培养基的BS-10培养物对致倦库蚊幼虫的毒力大小依次为NBFB>NYSM>NB,与NB基础培养基相比,优化的NBFB培养基中BS-10芽孢数增大了2个数量级,毒力也增加了100倍,说明优化得到的NBFB培养基可取代NYSM培养基用于菌株BS-10规模化生产。

图7 菌株BS-10在NYSM和NBFB培养基中的生长曲线

表3 不同培养基中BS-10生物量、芽孢数和毒力的比较Table 3 Comparison of biomass,spore count and toxicity among different media
3 讨 论
大量研究结果表明,球形芽孢杆菌不能利用葡萄糖、蔗糖等糖类物质,只能利用蛋白质、氨基酸等作为能源物质[11]。本研究结果进一步证实了球形芽孢杆菌的这一特性。也就是说,麸皮作为碳源添加到NB培养基中,起促进作用的是其中的氨基酸等物质。这与郭荣君等[12]通过有机氮源筛选试验得出的“豆饼粉和麸皮添加到液体培养基中能够显著提升地衣芽孢杆菌BH1芽孢量”的结果相一致。
鱼粉和麸皮作为培养基成分能够为微生物提供所需的碳源、氨基酸、微量元素和维生素[13]。对于球形芽孢杆菌而言,麸皮往往作为固体发酵培养基的成分用于杀蚊毒素的生产。然而,固体发酵的周期相对较长,需要72 h以上才能获得理想的生物量和芽孢数[14-15]。为了缩短发酵周期,降低发酵成本,研究者们开始将目光转向生物副产品。目前可以作为发酵生产的材料有花生饼粉[16]、黄豆粉[16]、蛋黄[17]、污泥[18]等,但在这些培养基中,所得发酵液的毒力多与对照培养基(NYSM培养基或者NB培养基)相当。本研究发现,在NB培养基中添加适量的鱼粉或麸皮均能够显著促进菌株BS-10的菌体生物量和芽孢数,且鱼粉的效果要优于花生饼粉和大豆粉,而在同时含有鱼粉和麸皮的NBFB培养基中,菌株BS-10的培养周期缩短至18 h,毒力增大了100倍,考虑到2种添加物均为价格低廉的副产品,因此,NBFB培养基可以用于菌株BS-10的规模化生产。
另外,本研究发现,高浓度的鱼粉和麸皮对菌体生物量及芽孢数的促进效果进一步减小,这与EL-Bendary等[15]在研究干酪乳清液培养球形芽孢杆菌时得到的结果相一致,推测其可能与高浓度乳清液中含有过量的阳离子等因素有关。对于2种添加物中是否存在芽孢促进因子,有研究表明:精氨酸、谷氨酸和甲硫氨酸能够促进球形芽孢杆菌芽孢的形成和毒素蛋白的合成[19],这可能是NBFB培养基毒性提高以及发酵周期缩短的原因所在。而这种向培养基中添加鱼粉和麸皮的方法是否适用于其他芽孢杆菌,以及两者促进球形芽孢杆菌芽孢形成的机制均有待进一步研究。
4 结 论
(1)通过单因素试验筛选出促进菌株BS-10芽孢形成的2种培养基成分鱼粉和麸皮,通过正交设计试验得到高产芽孢的NBFB培养基:3 g/L胰蛋白胨,1 g/L牛肉膏,6 g/L鱼粉和4 g/L麸皮。
(2)NBFB培养基发酵周期较NYSM培养基缩短了4 h。
(3)NBFB培养基芽孢数达4.12×109CFU/mg,对致倦库蚊幼虫的毒力较基础培养基增大了100倍。
[1] Nielsen-Leroux C,Charles J F.Binding ofBacillussphaericusbinary toxin to a specific receptor on midgut brush-border membranes from mosquito larvae [J].Eur J Biochem,1992,210(2):585-590.
[2] Shanmugavelu M,Rajamohan F,Kathirvel M,et al.Functional complementation of nontoxic mutant binary toxins ofBacillussphaericus1593M generated by site-directed mutagenesis [J].Appl Environ Microbiol,1998,64(2):756-759.
[3] Thanabalu T,Hindley J,Jackson-Yap J,et al.Cloning,sequencing,and expression of a gene encoding a 100-kilodalton mosquitocidal toxin fromBacillussphaericusSSⅡ-1 [J].J Bacteriol,1991,173(9):2776-2785.
[4] Thanabalu T,Porter A G.ABacillussphaericusgene encoding a novel type of mosquitocidal toxin of 31.8 kDa [J].Gene,1996,170(1):85-89.
[5] Liu J W,Porter A G,Wee B Y,et al.New gene from nineBacillussphaericusstrains encoding highly conserved 35.8-kilodalton mosquitocidal toxins [J].Appl Environ Microbiol,1996,62(6):2174-2176.
[6] Wirth M C,Walton W E,Federici B A.Evolution of resistance to theBacillussphaericusBin toxin is phenotypically masked by combination with the mosquitocidal proteins ofBacillusthuringiensissubspecies israelensis [J].Environ Microbiol,2010,12(5):1154-1160.
[7] 陈世夫,管玉霞,武秀兰,等.五株球形芽胞杆菌的产毒效能及杀虫活性影响因子的比较研究 [J].中国公共卫生学报,1989,8(6):371-373.
Chen S F,Guan Y X,Wu X L,et al.A comparative study of five strains ofBacillussphaericusfactor of toxigenic effectiveness and impact of insecticidal activity [J].Chinese Journal of Public Health,1989,8(6):371-373.(in Chinese)
[8] 戴承镛,黄湘云.球形芽孢杆菌BS-10菌株的生物学特性及其杀灭蚊幼效果 [J].中国公共卫生学报,1990,9(2):69-72.
Dai C Y,Huang X Y.Biological properties and moqutio larvicide activity ofBacillussphaericusstrain BS-10 [J].Chinese Journal of Public Health,1990,9(2):69-72.(in Chinese)
[9] 戴志东,袁生安,吴鹤临.球形芽孢杆菌BS-10于水生植物覆盖污水塘、沟灭蚊幼效果比较 [J].医学动物防制,1994,10(2):120-121.
Dai Z D,Yuan S A,Wu H L.The mosquito larvicide effect ofBacillussphaericusBS-10 in sewage pond and ditch covered aquatic plants [J].Journal of Medical Pest Control,1994,10(2):120-121.(in Chinese)
[10] World Health Organization.Informal consultation on the development ofBacillussphaericusas a microbial larvicide [M].Geneva:TDR/BCV/SPHAERICUS/85.3,1985:1-24.
[11] Russell B L,Jelley S A,Yousten A A.Carbohydrate metabolism in the mosquito pathogenBacillussphaericus2362 [J].Appl Environ Microbiol,1989,55(2):294-297.
[12] 郭荣君,王步云,李世东.营养对生防菌株BH1芽孢产量的影响研究 [J].植物病理学报,2005(3):283-285.
Guo R J,Wang B Y,Li S D.Nutrient requirement for the spore production of biocontrol strain BH1 [J].Journal of Plant Pathology,2005(3):283-285.(in Chinese)
[13] Devi P S,Ravinder T,Jaidev C.Cost-effective production ofBacillusthuringiensisby solid-state fermentation [J].J Invertebr Pathol,2005,88(2):163-168.
[14] Foda M S,El-Bendary M A,Moharam M E.Salient parameters involved in mosquitocidal toxins production fromBacillussphaericusby semi-solid substrate fermentation [J].Egyptian Journal of Microbiology,2003,38(3):229-246.
[15] EL-Bendary M A,Moharam M E,Foda M S.Efficient mosquitocidal toxin production byBacillussphaericususing cheese whey permeate under both submerged and solid state fermentations [J].J Invertebr Pathol,2008,98(1):46-53.
[16] Prabakaran G,Balaraman K,Hoti S L,et al.A cost-effective medium for the large-scale production ofBacillussphaericusH5a5b (VCRC B42) for mosquito control [J].Biological Control,2007,41(3):379-383.
[17] Prabakaran G,Hoti L.Egg yolk enhances early sporulation and toxicity ofBacillussphaericusH5a5b for small-scale production of a mosquito control agent [J].Acta Tropica,2008,108(1):50-53.
[18] Zhuang L,Zhou S,Wang Y,et al.Mosquito biolarvicide production by sequential fermentation with dual strains ofBacillusthuringiensissubsp.israelensisandBacillussphaericususing sewage sludge [J].Bioresource Technology,2011,102(2):1574-1580.
[19] Shevtsov V V,Petrova T M,Khovrychev M P,et al.Growth and spore germination factors of various strains ofBacillussphaericus[J].Mikrobiologiia,1990,59(3):453-459.
Optimization of high yield medium forBacillussphaericusstrain 10
(KeyLaboratoryofNaturalPesticideChemicalBiology,MinistryofEducation,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong510642,China)
【Objective】 The medium for high mosquito larvicide activity ofBacillussphaericusstrain 10 (BS-10) was optimized to guide large-scale production.【Method】 In terms of bacterial biomass,dry weight and spore count of strain BS-10,carbon and nitrogen sources of medium were optimized by orthogonal experiment.Then,the biomass,dissolved oxygen,and other related parameters of optimal medium were evaluated through a 7 L fermentor.【Result】 The optimal medium (NBFB) of BS-10 consisted of 3 g/L tryptone,1 g/L beef extract,6 g/L fish meal and 4 g/L wheat bran.Fermentation period was shortened to 18 h with the optimal medium.The maximum spore count was 4.12×109CFU/mg and the toxicity againstCulexquinquefasciatuswas increased by 100 times compared to basal medium (NB medium).【Conclusion】 Culturing strain BS-10 in NBFB medium obtained higher larvicide activity and shortened the fermentation period,which has a promising application potential and economic value.
Bacillussphaericus;BS-10;Culexquinquefasciatus;fish meal;wheat bran
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.032
2014-03-26
广州市科技局项目(2010J1-E361)
刘 美(1988-),男,河南许昌人,硕士,主要从事微生物农药研究。E-mail:panda1988mei@163.com
廖美德(1965-),男,湖北黄梅人,副教授,主要从事微生物、农药生物技术研究。E-mail:liaomeide@scau.edu.cn
S476.11
A
1671-9387(2015)11-0214-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.064.html

