猪流行性腹泻病毒3种抗原卵黄抗体的制备
胡青松,李吕木,张小飞,许发芝,丁小玲,徐延伟,丁维民
(1 安徽农业大学 动物科技学院,安徽 合肥 230036;2 南京天邦生物科技有限公司,江苏 南京 211102;3 安徽安泰农业集团,安徽 广德 242200)
猪流行性腹泻病毒3种抗原卵黄抗体的制备
胡青松1,李吕木1,张小飞2,许发芝1,丁小玲1,徐延伟2,丁维民3
(1 安徽农业大学 动物科技学院,安徽 合肥 230036;2 南京天邦生物科技有限公司,江苏 南京 211102;3 安徽安泰农业集团,安徽 广德 242200)
【目的】 探讨猪流行性腹泻病毒(PEDV)3种不同抗原制备的卵黄抗体对PEDV的中和能力,为抗猪流行性腹泻卵黄抗体的制备提供新的方法和理论基础。【方法】 根据PEDV S糖蛋白基因设计引物扩增PEDVS534基因(636~789位氨基酸)和PEDVCOE基因(499~638位氨基酸),并构建原核表达质粒pET32a-PEDV S534和pET32a-COE,分别转化表达菌株BL21(DE3)进行诱导表达。以原核表达的PEDV S534蛋白、COE蛋白以及PEDV灭活病毒为抗原,分别免疫产蛋鸡并制备卵黄抗体,通过病毒中和试验评价各卵黄抗体的中和效力。【结果】 成功表达了PEDV S534蛋白和COE蛋白,Western-Blotting分析显示,2种蛋白均具有很好的免疫原性;制备的3种特异性卵黄抗体均具有一定的病毒中和能力,PEDV S534蛋白特异性卵黄抗体的中和效价为1∶12,COE蛋白特异性卵黄抗体的中和效价为1∶25,而PEDV灭活病毒的卵黄抗体中和效价达到1∶120。【结论】 PEDV灭活病毒的中和能力最强,其次为COE蛋白特异性卵黄抗体, PEDV S534卵黄抗体的中和能力较弱。
猪流行性腹泻病毒;原核表达;卵黄抗体;中和试验
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由冠状病毒科、冠状病毒属的猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种以呕吐、腹泻和脱水为主要临床特征的高度接触性传染病[1],是引起当今世界各国仔猪早期死亡的重要疫病之一[2]。目前主要使用疫苗免疫妊娠母猪,通过母源抗体保护仔猪来防治仔猪PED。然而,由于母源抗体存在时间短,不能使仔猪安全渡过整个生长阶段。此外,也有通过在饲料中大量添加抗生素来治疗PED,但抗生素对病毒性腹泻无效,只能起到防止继发感染的效果,且抗生素的残留也容易引起食品安全等问题。因此,研制开发安全有效的环保型生物制剂成为防治PED的重要课题。为此,在控制PED方面,特异性的卵黄抗体(Egg yolk antibody,IgY)以其效果明确、制备简单、安全性好等优势越来越受到人们的重视。
目前已经研发出以PEDV全病毒作为免疫原制备的卵黄抗体[3-6],但以含PEDV中和表位的重组蛋白为免疫原制备卵黄抗体的研究尚未见报道。而以抗原表位蛋白作为免疫原制备卵黄抗体则更为可行和有效,如Sotiropoulou等[7]利用重组的KLK6蛋白免疫蛋鸡制备的特异性卵黄抗体在临床样品诊断方面深受欢迎;Han等[8]用原核表达的犬细小病毒VP2蛋白制备的卵黄抗体和刘文鑫等[9]以大肠杆菌菌毛蛋白K88ab和K99制备的卵黄抗体均具有显著的治疗效果;江馗语[10]采用基因工程技术表达猪瘟病毒不同的抗原表位蛋白,免疫产蛋鸡后制备的卵黄抗体均具有一定的抗病毒能力。
S蛋白是PEDV表面的一种重要的结构与功能蛋白,在免疫反应中起重要作用,有识别靶细胞及使病毒和细胞膜融合的作用[11]。S蛋白被划分为S1区域(1~789位氨基酸)和S2区域(790~1 383位氨基酸)[12], S1区域包括S蛋白的主要中和表位,组成了暴露在PEDV病毒粒子表面的球形胞外功能区,其中S1D(636~789位氨基酸)是抗原中和表位区域。S1D区域中的S1D5(744~759位氨基酸)和S1D6(756~771位氨基酸)被证实为PEDV S蛋白的2个线性表位,而SS2(Y748SNIGVCK755)和SS6(L764QDGQVKI771)分别为S1D5和S1D6 2个区域的核心表位[13]。Chang等[14]根据猪传染性胃肠炎病毒(TGEV)S基因的中和表位区序列信息,推导出PEDV S蛋白中和表位,用之制备的高免血清能够明显地抑制PEDV在Vero细胞上的蚀斑形成,初步鉴定了PEDVS基因的一个抗原表位区(499~638 氨基酸)。Kang等[15]证明韩国株PEDVS基因序列的1 504~1 923 bpK-COE基因是PEDV的中和抗原位点。Cruz等[16]利用噬菌体随机肽库鉴定了PEDV S蛋白的一个模拟表位(G1 368PRLQPY1 374),该区域位于S蛋白C末端24位氨基酸,能够诱导机体产生强烈的抗体反应,可能是PEDV的中和表位之一。孙东波[17]利用fd噬菌体展示技术鉴定出了PEDV S蛋白3个新的抗原表位,分别为S1P1(248~280位氨基酸)、S1P2(442~499 位氨基酸)和S1P3(697~638位氨基酸),其融合蛋白的单因子血清能够识别Vero细胞培养物中天然的PEDV。PEDVS基因片段PEDV S534(编码636~789位氨基酸)和PEDVS COE(499~638位氨基酸)重组蛋白已被证明其抗血清均有一定的中和活性,具有潜在的应用价值[17-19]。
为此,本研究利用PEDV S534和PEDV COE 2种重组蛋白,以及PEDV灭活病毒分别作为免疫原制备卵黄抗体,比较其中和效价,以期获得更加经济高效的PEDV卵黄抗体。
1 材料与方法
1.1 材 料
1.1.1 质粒、宿主菌、病毒、细胞和试验动物 质粒pET32a-PEDV S534、pET32a-COE和大肠杆菌菌株BL21(DE3)及猪流行性腹泻病毒分离株和其增殖用Vero细胞,均来自南京天邦生物技术有限公司研究所。试验动物为15只18周龄莱杭蛋鸡。
1.1.2 主要试剂 弗氏完全佐剂和不完全佐剂,购自Sigma公司;辣根过氧化物酶HRP标记的羊抗鸡抗体及DAB显色试剂盒,购自上海生工有限公司;细胞培养基DMEM和血清,购自GIBCO BRL公司。其他试剂均为国产分析纯级试剂。
1.2 免疫原的制备
1.2.1 重组蛋白免疫原 将重组质粒pET32a-PEDV S534和pET32a-COE转化表达菌BL21,用含100 g/L氨苄青霉素(Amp)的LB平板37 ℃培养过夜后挑取单克隆至5 mL TB培养基中,摇菌16~18 h后以1∶100(体积比)转入新鲜TB培养基中继续培养,至OD600值达到0.6~0.8时加入IPTG至终浓度为0.8 mmol/mL,诱导6 h后收菌。将菌液离心(6 000 r/min,20 min),沉淀用PBS悬浮,超声破碎15 min(工作3 s,间隔2 s)后离心(12 000 r/min,10 min),分别取上清液和沉淀(用8 mol/L尿素溶液溶解)进行SDS-PAGE分析。包涵体蛋白经尿素溶液溶解后加入透析袋中透析复性。复性后的蛋白用镍离子柱纯化,用BCA试剂盒测定纯化后的蛋白浓度。将纯化后的蛋白与等量的弗氏完全佐剂或不完全佐剂充分乳化,制备PEDV S534和COE抗原。
1.2.2 PEDV病毒免疫原 将1日龄未吃初乳的仔猪人工感染PEDV,出现腹泻后进行剖杀,取小肠组织用于提取和纯化PEDV。参照王金洛等[6]的试验方法,制备PEDV病毒免疫原。
1.3 卵黄抗体的制备
1.3.1 免疫产蛋鸡 在注射抗原前3 d收集鸡蛋作为对照组,然后皮下多点注射已制备的免疫原。2种重组蛋白免疫原免疫剂量为首免100 μg/只,二免150 μg/只,三免300 μg/只;PEDV病毒免疫原免疫剂量为首免1 mL/只、二免1.5 mL/只、三免2 mL/只。免疫间隔期均为2周;首免佐剂为弗氏完全佐剂,二免和三免佐剂为弗氏不完全佐剂。三免后10 d开始收集鸡蛋,检测抗体效价,制备卵黄抗体。
1.3.2 卵黄抗体的分离纯化 采用硫酸铵梯度沉淀法分离纯化卵黄抗体。首先用新洁尔灭对收集的鸡蛋进行表面消毒,在无菌条件下破壳,将蛋清倒出,用吸纸将蛋黄表面的蛋清尽量吸净。然后将蛋黄倒入无菌烧杯中,加入9倍体积的PBS,4 ℃充分搅拌20 min。参照改良的硫酸铵沉淀法[20],调节蛋黄稀释液pH值为5.11,4 ℃放置12 h后10 000 r/min 离心20 min,收集上清,加入终浓度为0.6 mol/L的Na2SO4,并调节pH值为7.5。将该溶液与等体积的PBS混合,搅拌均匀,4 ℃缓慢滴加饱和硫酸铵至饱和度为40%,4 ℃静置1 h后12 000 r/min 离心30 min,弃上清液,沉淀用原样品体积的PBS重悬;再次缓慢滴加饱和硫酸铵至饱和度为35%,4 ℃静置1 h后12 000 r/min离心30 min,弃上清,沉淀用原样品体积1/2的PBS重悬。采用透析的方法除去卵黄抗体中残留的盐离子硫酸铵,用SDS-PAGE分析纯化前、后的卵黄抗体纯度。
1.4 卵黄抗体的Western-Blotting检测
取原核表达的蛋白样品,经SDS-PAGE凝胶电泳后将蛋白电转(60 V,2 h)至PVDF膜上,用100 g/L脱脂牛奶封闭过夜,TBST洗涤3次;分别以PBS稀释的PEDV S534和COE卵黄抗体为一抗(稀释倍数1∶200,V/V),37 ℃作用2 h后用TBST洗涤3次;以HRP标记的羊抗鸡作为二抗(稀释倍数1∶4 000,V/V),37 ℃反应1.5 h后用TBST洗涤5次。采用DAB试剂盒进行显色分析。
1.5 卵黄抗体中和效价的测定
病毒半数细胞感染量(TCID50)的测定:将PEDV病毒原液按密度梯度10-3,10-4,10-5,10-6,10-7和10-8进行稀释,分别接种Vero细胞,每个稀释度为1组,每组设5个重复。37 ℃培养,记录48~96 h病变细胞数和未病变细胞数,按Reed-Muech法计算TCID50。
固定病毒稀释抗体,以每孔100 TCID50病毒量与倍比稀释(2,4,8,16,32,64,128和256倍)的卵黄抗体37 ℃作用1 h后接种细胞,同时设低倍稀释的血清对照、正常孔对照及100 TCID50/孔、0.1 TCID50/孔的病毒对照,当100 TCID50/孔全部病变而0.1 TCID50/孔无病变时开始记录每组的病变细胞数和未病变细胞数,计算抗体的中和效价。
2 结果与分析
2.1 PEDV S534和COE基因的原核表达
由图1可以看出,经IPTG诱导后,pET32a-PEDV S534和pET32a-COE重组质粒诱导后分别在37和36 ku处出现特异性蛋白条带(另外2条带为菌体蛋白),表达的蛋白存在于沉淀中,上清液中除大肠杆菌菌体蛋白条带外,不存在目的蛋白。
2.2 卵黄抗体的纯化
图2显示,制备的3种卵黄抗体经硫酸铵梯度沉淀后得到了很好的纯化。
2.3 卵黄抗体的Western-Blotting分析
Western-Blotting分析结果(图3-A、B)显示,分别以PEDV S534和COE蛋白制备的卵黄抗体作为一抗,能够分别检测到分子质量为37和36 ku的蛋白条带,表明已成功制备了2种重组蛋白的特异性卵黄抗体。
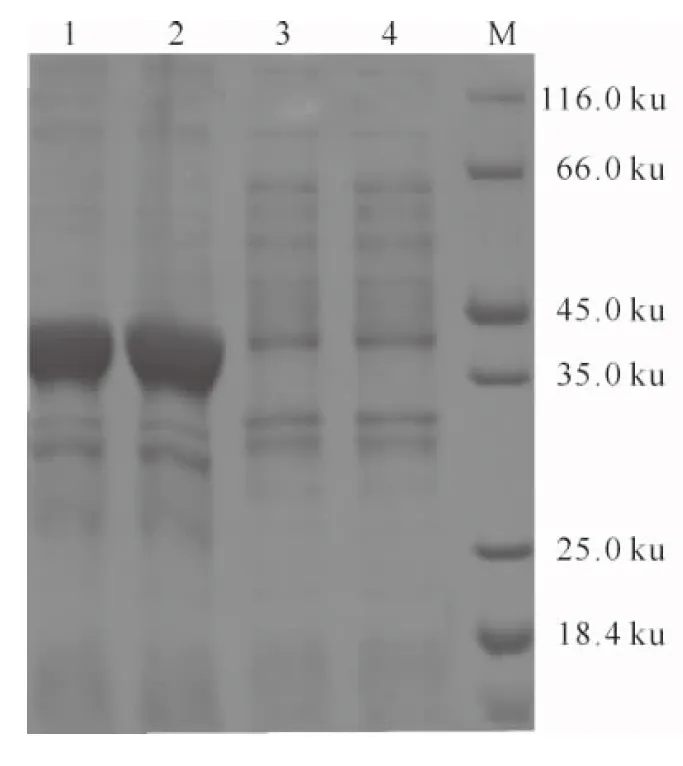
图1 PEDV S534和COE融合蛋白的诱导表达1.COE菌体蛋白裂解后沉淀;2.PEDV S534菌体蛋白裂解后沉淀;3.COE菌体蛋白裂解后上清;4.PEDV S534菌体蛋白裂解后上清;M.蛋白Marker
Fig.1 Expression of PEDV S534and COE fusion proteins 1.Inclusion bodies of COE mycoprotein;2.Inclusion bodies of PEDV S534mycoprotein;3.Supernatant after sonication of COE mycoprotein;4.Supernatant after sonication of PEDV S534mycoprotein;M.Protein marker
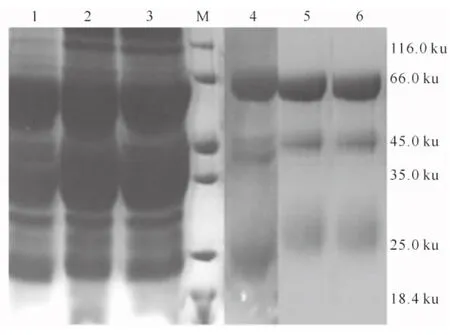
图2 PEDV 3种卵黄抗体的纯化效果
1.纯化前的PEDV抗原卵黄抗体;2.纯化前的S534卵黄抗体;3.纯化前的COE卵黄抗体;M.蛋白Marker;4.纯化后的PEDV抗原卵黄抗体;5.纯化后的S534卵黄抗体;6.纯化后的COE卵黄抗体
Fig.2 Purification effects of egg yolk antibodies1.PEDV antigen IgY with no purified;2.S534IgY with no purified;3.COE IgY with no purified;M.Protein Marker;4.PEDV antigen vaccine IgY after purified;5.S534IgY after purified;6.COE IgY after purified

图3 PEDV融合蛋白S534和COE卵黄抗体的Western-Blotting检测A.S534卵黄抗体;B.COE卵黄抗体
Fig.3 Western-Blotting analysis on the binding activities of PEDV fusion proteins S534and COE yolk antibodies A.Anti-S534IgY;B.Anti-COE IgY
2.4 中和试验
中和试验的效价测定结果显示,制备的PEDV S534卵黄抗体的中和效价为1∶12,COE卵黄抗体的中和效价为1∶25,PEDV全病毒免疫制备的卵黄抗体的中和效价达到1∶120,而对照组的中和效价低于1∶2,表明制备的卵黄抗体具有一定的中和活性。
3 讨 论
PED自1971年被首次报道[21]以来,现已成为危害养猪业的最重要传染病之一。2006年有报道称,PED开始在免疫猪群中大面积流行,并造成了巨大的经济损失[4],这在一定程度上说明传统的疫苗免疫已经不能起到很好的保护作用。由于仔猪出生时体内没有免疫球蛋白,因此新生仔猪必须通过母乳来获得被动免疫[22-23]。卵黄抗体与初乳作用机理相似,能够直接进入肠道中和病毒,作用快速有效,在无有效药物或紧急免疫接种疫苗不能在短时间产生免疫保护的情况下,应用抗猪流行性腹泻卵黄抗体对猪群进行紧急预防是预防猪流行性腹泻的重要补充措施。
PEDV S蛋白能够介导感染宿主产生中和抗体。近年来,国内外研究人员先后对PEDV S蛋白中和表位的中和活性及构象进行了研究。PEDV韩国株S 蛋白COE基因已在烟草[15]和马铃薯[24]中得到表达,用表达的蛋白免疫接种小鼠后,可刺激机体产生有效的系统免疫和黏膜免疫应答,产生的抗体具有中和活性。葛俊伟[25]以PEDV LJB/03株S基因的COE片段为目的基因,经大肠杆菌表达后证实COE具有诱导中和抗体产生的作用,经干酪乳杆菌表达系统表达后口服免疫接种小鼠,能够诱导机体产生特异性的sIgA和IgG抗体,血清具有中和活性,中和效价为1∶12。汪淼[26]构建了COE基因的重组乳酸乳球菌表达系统,口服免疫接种动物后能够有效刺激肠道黏膜的免疫细胞,达到对动物的免疫保护作用,血清中和抗体效价可达1∶90。PEDV是以体液免疫为主的病毒,因而B细胞抗原表位在抗PEDV感染中具有重要意义,孙东波[17]通过试验鉴定得知PEDV S1区的S1D(636~789位氨基酸)亚区是一个免疫优势区,S1D的GST重组蛋白能介导小鼠产生特异性的抗体,该抗体能够识别天然的S蛋白,并对PEDV在Vero E6细胞上的复制具有中和作用;同时利用S1D的单克隆抗体,通过S1基因肽库筛选出2个线性抗原表位,即P744VLVYSNIGVCKSGSI759和S756GSIGYVPLQDGQ-VKI771;进一步的试验结果表明,S1D5表位的核心序列是Y748SNIGVCK755,S1D6表位的核心序列是L764QDGQVKI771,S1D5和S1D6表位的GST融合蛋白介导小鼠产生的抗体能够识别天然的S蛋白。Cruz等[16]筛选出了一个PEDV S蛋白模拟构象表位G1 368PRLQPY1 374,中和试验表明该表位能够抑制病毒的早期复制,并阻止病毒进入宿主细胞。S1D1、S1D2和S1D3表位的GST融合蛋白均可与PEDV多克隆血清发生反应,S1D2和S1D3表位的GST融合蛋白介导小鼠产生的抗体能识别天然的S蛋白,S1D1、S1D2和S1D3的串联表位S1P123具有更好的抗原性和免疫原性,但融合蛋白产生的抗体无中和活性。
本试验首次选用PEDV S蛋白的中和表位基因S534和COE为靶基因,原核表达这2种蛋白作为免疫原制备卵黄抗体。中和试验结果表明,制备的卵黄抗体均具有一定的病毒中和能力,中和效价分别为1∶12和1∶25,但均低于以PEDV全病毒灭活为免疫原制备的卵黄抗体的中和效价。分析其原因,可能是由于PEDV灭活免疫原包含的是PEDV全病毒,全病毒具有病毒基因中所有的中和位点,抗原也具有天然的构象。所以,以PEDV灭活苗为免疫原制备的卵黄抗体完全针对靶病毒,对病毒的中和能力也最强。PEDV S534和COE蛋白均为一段具有中和性抗原的表位蛋白,针对PEDV的中和作用的抗原表位数量不多,因此以其作为免疫原制备的卵黄抗体对病毒的中和能力也相对较弱。本试验结果与江馗语[10]对猪瘟病毒4种不同抗原卵黄抗体中和效价的评价结果一致。抗PEDV S534重组蛋白卵黄抗体的中和效价比抗COE重组蛋白的中和效价低,这可能是由于中和表位PEDV S534片段与病毒的结合能力不如COE片段强,这与葛俊伟[25]的试验结果一致。中和位点的多少及中和位点基因的优化可能与重组蛋白作为抗原制备的卵黄抗体的中和效价有密切的关系,本研究为进一步探讨PEDV分离株中和表位的变异与疫苗保护性之间的关系提供了新的思路。
[1] Pensaert M B.Porcine epidemic diarrhea [M]//Diease of Swine.7th edition.USA:Iowa State University Press,1992:293-298.
[2] Wood E N.An apparently new syndrome of porcine epidmic diarrhea [J].Vet Rec,1997,100:243-244.
[3] Song D,Park B.Porcine epidemic diarrhoea virus:A comprehensive review of molecular epidemiology,diagnosis,and vaccines [J].Virus genes,2012,44(2):167-175.
[4] Kweon C H,Kwon B J,Woo S R,et al.Immunoprophylactic effect of chicken egg yolk immunoglobulin (IgY) against porcine epidemic diarrhea virus (PEDV) in piglets [J].The Journal of Veterinary Medical Science,2000,62(9):961-964.
[5] 崔焕忠,姜海龙,张加力,等.抗猪传染性胃肠炎病毒与猪流行性腹泻病毒卵黄抗体制备及其临床应用研究 [J].中国畜牧兽医,2012,39(6):173-175.
Cui H Z,Jiang H L,Zhang J L,et al.Study and application the hyperimmunized yolk antibodies of TGEV and PEDV in piglets [J].China Animal Husbandry & Veterinary Medicine,2012,39(6):173-175.(in Chinese)
[6] 王金洛,宋维平,徐福洲,等.抗猪流行性腹泻病毒卵黄抗体 (PEDV-IgY)及其特性研究 [C]//中国畜牧兽医学会.中国畜牧兽医学会2003年学术年会论文集.北京:中国农业出版社,2003:326-329.
Wang J L,Song W P,Xu F Z,et al.Effect of IgY treatment on porcine epidemic diarrhea virus(PEDV-IgY) in piglets [C]//China Animal Husbandry and Veterinary Institute.Academic papers 2003 of China Animal Husbandry and Veterinary Institute.Beijing:China Agriculture Press,2003:326-329.(in Chinese)
[7] Sotiropoulou G,Pampalakis G,Prosnikli E,et al.Development and immunochemical evaluation of a novel chicken IgY antibody specific for KLK6 [J].Chemistry Central Journal,2012,6(1):1-8.
[8] Han S,Zhang X,Zhao J.Production of egg yolk antibody (IgY) against Recombinant Canine Parvovirus VP2 protein [J].Acta Scientiae Veterinariae,2012,40(2):1029.
[9] 刘文鑫,冯瑜菲,杨旭东,等.重组大肠杆菌K88ab和K99蛋白制备的鸡卵黄抗体的效力评价 [J].中国预防兽医学报,2010 32(12):968-971.
Liu W X,Feng Y F,Yang X D,et al.Evaluation of the effectiveness of chicken egg yolk antibody stimulated by recombinant K88a-b,K99 protein ofEscherichiacoli[J].Chinese Journal of Preventive Veterinary Medicine,2010,32(12):968-971.(in Chinese)
[10] 江馗语.猪瘟病毒四种不同抗原卵黄抗体中和效力评价 [D].哈尔滨:东北农业大学,2012.
Jiang K Y.Evaluation of neutralization effectiveness of chicken egg yolk prepared on four different antigens of classical swine fever virus [D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[11] Brian D A,Baric R S.Coronavirus genome structure and replication [M]//Coronavirus Replication and Reverse Genetics.Berlin Heidelberg:Springer-Verlag,2005:1-30.
[12] Spaan W,Cavanagh D,Horzinek M C.Coronaviruses:Structure and genome expression [J].Journal of General Virology,1988,69(12):2939-2952.
[13] 孙东波,冯 力,陈建飞,等.猪流行性腹泻病毒CH/JL毒株S基因的克隆、序列分析及线性抗原表位区的鉴定 [J].病毒学报,2007,23(3):224-228.
Sun D B,Feng L,Chen J F,et al.Cloning and sequence analysis of the spike protein gene of porcine epidemic diarrhea virus CH/JL strain and identification of its antigenic region containing linear epitopes [J].Chinese Journal of Virology,2007,23(3):224-228.(in Chinese)
[14] Chang S H,Bae J L,Kang T J,et al.Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea vieus [J].Molecules and Cells,2002,14(2):295-299.
[15] Kang T J,Seo J E,Kim D H,et al.Cloning and sequence analysis of the Korean strain of spike gene of porcine epidemic diarrhea virus and expression od its neutralizing epitope in plants protein [J].Expression and Purification,2005,41:378-383.
[16] Cruz D J M,Kim C J,Shin H J.Phage-displayed peptides having antigenic similarities with porcine epidemic diarrhea virus (PEDV) neutralizing epitopes [J].Virology,2006,354(1):28-34.
[17] 孙东波.猪流行性腹泻病毒S蛋白抗原表位鉴定及受体结合域的初步筛选 [D].北京:中国农业科学院,2008.
Sun D B.Porcine epideimc diarrhea virus protein epitopes S identification and initial screening receptor binding domain [D].Beijing:Chinese Academy of Agricultural Sciences,2008.(in Chinese)
[18] Godet M,Grosclaude J,Delmas B,et al.Major receptor-binding and neutralization determinants are located within the same domain of the transmissible gastroenteritis virus(coronavirus)spike protein [J].Journal of Virology,1994,68:8008-8016.
[19] Bae J L,Lee J G,Kang T J,et al.Induction of antigen-specific systemic and uncosal immune responses by feeding antimals transgenic plants expressing the antigen [J].Vaccine,2003,21(25):4052-4058.
[20] 杨 帆,刘先菊,林树柱,等.改良的硫酸铵沉淀法纯化大雁的卵黄抗体 [J].中国比较医学杂志,2007,17(11):625-628.
Yang F,Liu X J,Lin S Z,et al.Improved ammonium sulfate precipitation method to purify wild goose egg yolk IgY [J].Chinese Journal of Comparative Medicine,2007,17(11):625-628. (in Chinese)
[21] Oldham J.Letter to the editor [J].Pig Farming,1972,10:72-73.
[22] Cox E,Pensaert M B,Callebaut P.Intestinal protection against challenge with transmissible gastroenteritis virus of pigs immune after infection with the porcine respiratory coronavirus [J].Vaccine,1993,11:267-272.
[23] Lanza I,Shoup D I,Saif L J.Lactogenic immunity and milk antibody isotypes to transmissible gastroenteritis virus in sow exposed to porcine respiratory coronavirus during pregnancy [J].American Journal of Veterinary Research,1995,56:739-748.
[24] Kim Y S,Kang T J,Jang Y S,et al.Expression of neutralizing epitope of porcine epidemic diarrhea virus in potato plants [J].Plant Cell,Tissue and Organ Culture,2005,82(2):125-130.
[25] 葛俊伟.猪流行性腹泻病毒主要结构蛋白不同抗原片段在重组干酪乳杆菌中的表达及其免疫学评价 [D].哈尔滨:东北农业大学,2008.
Ge J W.Expression of the different antigen fragments of the major structural protein of porcine epidemic diarrhea virus in recombin-ant lactobacillus casei and immunology evaluation [D].Harbin:Northeast Agricultural University,2008.(in Chinese)
[26] 汪 淼.表达猪流行性腹泻病毒中和抗原区重组乳酸乳球菌系统的构建 [D].哈尔滨:东北农业大学,2009.
Wang M.Construction of recombinant lactococcus lactis expressing neutraliaing antigenic domain of procine epidemic diarrhea virus [D].Harbin:Northeast Agricultural University,2009.(in Chinese)
Preparation of yolk antibodies against three different antigens of porcine epidemic diarrhe virus
HU Qing-song1,LI Lü-mu1,ZHANG Xiao-fei2,XU Fa-zhi1, DING Xiao-ling1,XU Yan-wei2,DING Wei-min3
(1SchoolofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui230036,China;2NanjingTianbangBio-IndustryCO.,LTD,Nanjing,Jiangsu211102,China;3AnhuiAntaiAgriculturalGroupCO.,LTD,Guangde,Anhui242200,China)
【Objective】 This study investigated the ability of yolk antibodies to neutralize three different antigens of PEDV to provide new method and theoretical basis for preparing swine PED yolk antibody.【Method】 Two pairs of primers were designed to clone PEDVS534gene (636-789aa) andCOEgene (499-638aa) before they were inserted into pET32a to acquare recombinant plasmids,pET32a-PEDV S534and pET32a-COE.After the recombinant plasmids were transformed into BL21(DE3),IgY against PEDV was obtained from chicken egg yolk immunized with three different antigens,PEDV S534protein,COE protein and PEDV inactivated virus.Then,their abilities to neutralize PEDV were tested by neutralization test.【Result】 The PEDV S534protein and COE protein were expressed successfully,and Western-Blotting indicated that the immunogenicity of the proteins were high.The virus neutralization test indicated that all three egg yolk antibodies could neutralize PEDV.The anti-PEDV S534IgY neutralization titer was 1∶12,the anti-COE IgY neutralization titer was 1∶25,and the anti-PEDV inactivated virus IgY neutralization titer was 1∶120.【Conclusion】 The anti-PEDV inactivated virus IgY had the highest neutralization titer,followed by the anti-COE IgY and the anti-PEDV S534IgY.
porcine epidemic diarrhea virus(PEDV);prokaryotic expression;egg yolk antibody;neutralization test
时间:2015-10-13 08:46
10.13207/j.cnki.jnwafu.2015.11.006
2014-03-19
安徽省生猪产业技术体系营养与饲料研究专项(2012)
胡青松(1987-),男,江苏沛县人,在读硕士,主要从事猪营养与饲料研究。
李吕木(1956-),男,安徽和县人,研究员,博士,博士生导师,主要从事动物营养与饲料科学研究。 E-mail:llm56@ahau.edu.cn
S858.286.4
A
1671-9387(2015)11-0035-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151013.0846.012.html

