羊奶中挥发性成分顶空固相微萃取条件的优化
艾 对, 张富新, 于玲玲, 苏伟丽, 林乐英
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710062)
羊奶中挥发性成分顶空固相微萃取条件的优化
艾 对, 张富新*, 于玲玲, 苏伟丽, 林乐英
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710062)
采用顶空固相微萃取结合气相色谱检测羊奶中挥发性成分,以出峰数和峰面积为指标,对影响固相微萃取法提取羊奶中挥发性成分的萃取头、萃取温度、加盐量、萃取时间和解析时间5个因素进行优化。结果表明,选用CAR/PDMS为萃取头、NaCl添加量为0.3 g/mL、萃取温度为70℃、萃取时间为90 min、解析时间为5 min时,可最大限度地提取羊奶中挥发性成分。再以最优条件萃取羊奶中挥发性成分,经GC/MS分析检测,共检测出42种挥发性成分,其中酸性成分最多,有14种,其次是酯类、烷烃、芳香族、杂环、醇和醛酮,分别有6、5、5、5、4和3种。
羊奶;顶空固相微萃取;挥发性成分;气质联用
羊奶富含蛋白质、脂肪、矿物质、维生素以及多种生物活性物质,被称为 “奶中之王”[1-2]。但羊奶具有膻味,限制了羊奶及其产品的利用[3]。羊奶的膻味与其化学组成,尤其是羊奶中的挥发性成分有关[4],因此分析检测羊奶中挥发性成分,对于揭示羊奶膻味形成机理有重要意义。目前国内外对食品中挥发性成分检测报道较多,常用的有气相色谱(Gas Chromatograph,GC)法[5-6]、气相色谱-质谱联用(Gas Chromatograph-Mass Spectrometer,GC/MS)法[7-8]、液相色谱(Liquid Chromatograph,HPLC)法[9-10]、液相色谱 -质 联 用 (Liquid Chromatograph-Mass Spectrometer,LC/MS)法[7,11]等,但这些方法通常都要对样品进行前处理,其中顶空固相微萃取(Head Space Solid Phase Micro-Extraction,HS/SPME)是应用最为广泛且有效的方法。该方法集采样、萃取、富集、进样于一体,具有敏感、操作简便、样品用量少、无溶剂等优点[12-14],已成功地用于食品[15]、环境[16]、体液[17]和植物[18]等领域挥发性成分的分析。HS/SPME技术在羊奶及乳制品挥发性成分的研究已有报道[19-24],但由于HS/SPME条件的不同,其结果差异较大。大量研究表明,HS/SPME技术萃取挥发性成分的效果与萃取头、盐离子浓度、萃取温度、萃取时间和解析时间等因素相关[12-14]。因此,作者以羊奶为材料,采用HS/SPME技术对其挥发性物质进行萃取和富集,再经GC和GC/MS的分离和检测,以GC总峰面积和出峰数为优化指标,对萃取头、盐离子浓度、萃取温度、萃取时间和解析时间5个因素进行了系统的优化,再用GC/MS对其挥发性成分进行定性和定量分析,旨在建立HS/SPME-GC/MS分析方法,为进一步检测羊奶膻味物质提供技术支持。
1 材料与方法
1.1 羊奶
采用陕西红星乳业有限公司的混合奶样。样品取回后,放于-40℃冰箱中储存。实验时,在25℃水浴中解冻。
1.2 HS/SPME方法
在20 mL的顶空瓶中加入12 mL奶样和一定量NaCl,用密封垫迅速密封顶空瓶,在磁力搅拌(900 r/min)下,在30℃下平衡30 min后,将已老化的萃取头(250℃下老化1 h)插入顶空瓶,推出萃取纤维头,距液面1 cm,进行顶空萃取。在不同温度下萃取一定时间后,缩回萃取纤维,拔出萃取头,快速插入GC进样口,在250℃下解析一定时间,以出峰数和峰面积为检测指标优化萃取条件。每个样品重复3次。
1.3 GC分析条件
气相色谱仪 (TRACE 2000,Thermo Fisher Scientific,USA)配备火焰离子化检测器(Flame Ionization Detector,FID)和HP-INNOWAX石英毛细管色谱柱 (60 m×0.32 mm×0.25 μm,Agilent,USA);采用程序升温模式,起始温度为60℃,保持2 min,以1℃/min升至70℃,保持2 min,再以4℃/min升至180℃,保持27 min;进样口温度为250℃;以氮气为载气,流量是1.0 mL/min;不分流进样;检测器温度为260℃,氢气为燃烧气体,流量是35 mL/min,氧气为助燃气体,流量是350 mL/min,氮气为补偿气体,流速是35 mL/min。
1.4 GC/MS分析条件
气相色谱-质谱联用仪 (TRACE 1300-ISQ,Thermo Fisher Scientific,USA)和HP-INNOWAX石英毛细管色谱柱(规格同上);采用程序升温模式,起始温度为40℃,保持10 min,以4℃/min升至80℃,保持10 min,再以4℃/min升至180℃,保持30 min;进样口温度为250℃;以氦气(纯度99.99%)为载气,流量是1 mL/min;不分流进样。传输线接口温度为250℃;离子源温度为250℃;电离方式为EI;电离能量为70 eV;灯丝发射电流为20 μA;质量扫描范围为45~500,溶剂延迟时间为0.5 min。
1.5 数据处理
根据气相色谱工作站软件Chrom-card得到色谱峰的参数信息,采用Excel2003和Word2003对数据进行统计分析。利用GC/MS工作站软件Xcalibur自带NIST标准库对各色谱峰进行自动检索,只对能予以定性的挥发性成分做定量处理,采用峰面积归一化法计算各挥发性成分的相对百分含量。
2 结果与分析
2.1 固相微萃取条件的优化
2.1.1 萃取头的选择分别用PDMS(polydimethylsiloxane,7 μm)、PDMS/DVB(polydimethylsiloxanedivinylbenzene,65 μm)、PA (polyacrylate,85 μm)、CAR/PDMS(carboxen-polydimethylsiloxane,75 μm)萃取头对羊奶中挥发性物质在70℃下,萃取90 min后,用GC检测挥发性成分,结果见图1。
由图1可以看出,不同萃取头对羊奶挥发性成分的萃取效果有较大差别。用CAR/PDMS萃取头萃取后,经GC检测的色谱图不仅出峰数最多,且基线平稳,峰形对称均匀,而用PDMS、PDMS/DVB、PA萃取时,出峰数和峰面积都较少,这表明用CAR/ PDMS萃取头可最大限度的萃取羊奶中挥发性成分。在用SPME技术萃取食品中挥发性成分时,其萃取效果不仅要尽可能多的提高萃取到挥发性成分的种类,同时使提取物质的量尽可能多,用出峰数可代表萃取物质的种类,出峰面积可以反映萃取物质的量。同时由图5可以看出,用CAR/PDMS萃取头萃取后,羊奶中挥发性物质的出峰数最多,且峰面积最大。萃取头的萃取效果与萃取头构成高分子材质有关,极性材质对样品中极性物质萃取效果较好,而非极性材质对样品中非极性物质萃取效果较好[12]。由于羊奶中挥发性成分组成复杂,既有极性化合物,又有非极性化合物。本研究中采用的CAR/ PDMS萃取头属于复合型材质,对极性和非极性化合物均有较强的吸附作用,因此,对羊奶中挥发性成分萃取效果较好。
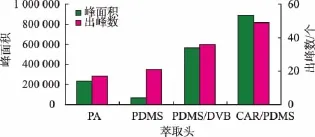
图1 萃取头对羊奶中挥发性成分萃取效果的影响Fig.1 Effect of SPME fibre on the extraction of volatile compounds from goat milk
2.1.2 NaCl添加量的选择在12 mL奶样中加入NaCl,使其质量浓度分别达到0.0、0.1、0.2、0.3、0.4 g/mL,再用CAR/PDMS萃取头萃取30 min,用GC检测挥发性成分,结果见图2。
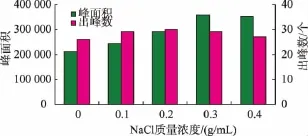
图2 NaCl添加量对羊奶中挥发性成分萃取效果的影响Fig.2 Effect of NaCl concentration on the extraction of volatile compounds from goat milk
由图2可以看出,随着NaCl添加量的增加,峰面积和出峰数有逐步增大的趋势。当NaCl添加量达0.3 g/mL时,出峰数和峰面积达到最大;当NaCl添加量达到0.4 g/mL时,出峰数和峰面积有降低趋势。羊奶中挥发性物质的逸出与奶样中离子强度有关,添加NaCl能加强溶液离子强度,降低挥发性组分在液相中的溶解度,有利于挥发性成分逸出,从而增加其在气相中的含量。但当NaCl添加量过大时,易出现饱和现象,使其在增加挥发性成分气-液分配比的同时也将影响基质粘度,降低挥发性成分的扩散速度,产生盐析负效应[25]。因此,在萃取羊奶中挥发性成分时,应添加适量的NaCl。
2.1.3 萃取温度的选择将奶样分别在30、45、60、70、80℃下,用CAR/PDMS萃取头萃取30 min,用GC检测挥发性成分,结果见图3。

图3 萃取温度对羊奶中挥发性成分萃取效果的影响Fig.3 Effect of extraction temperature on the extraction of volatile compounds from goat milk
由图3可以看出:随着萃取温度的升高,羊奶中挥发性成分的峰面积和出峰数呈增加趋势。当萃取温度大于70℃时,出峰数达到32个,且峰面积较大;当萃取温度达到80℃时,其峰面积与70℃萃取时无明显差异,但出峰数明显降低。在用SPME技术萃取食品中挥发性成分时,萃取温度对其萃取效果影响较大,提高萃取温度,可加快分子热运动,加速分子间热传导,使挥发性成分在基质间扩散加快,进而使气相中的组分含量增加,从而有利于萃取头的萃取。但当萃取温度过高时,又会使挥发性成分在萃取头涂层与基质间的分配系数降低,从而降低萃取头的萃取效果。
2.1.4 萃取时间的选择将奶样在70℃下,用CAR/PDMS萃取头分别萃取30、45、60、75、90、105 min,用GC检测挥发性成分,结果见图4。
由图4可以看出,随着萃取时间的延长,峰面积和出峰数呈增加趋势。当萃取时间达到90 min时,峰面积和出峰数达到最大;但在萃取90 min后,随着萃取时间的延长,峰面积和出峰数有降低的趋势。萃取时间的长短将直接影响挥发性成分在萃取头上的吸附状况,萃取时间较短时,挥发性成分在萃取头上吸附不充分;而萃取时间较长时,一些已吸附的挥发性成分可能会出现解析现象[26]。实际上,挥发性成分在萃取头上的吸附是处于一个动态平衡,只有在一定萃取时间,才能取得最大的萃取效果。

图4 萃取时间对羊奶中挥发性成分萃取效果的影响Fig.4 Effect of extraction time on the extraction of volatile compounds from goat milk

图5 解析时间对羊奶挥发性成分萃取效果的影响Fig.5 Effect of desorption time on the extraction of volatile compounds from goat milk
2.1.5 解析时间的选择将奶样用CAR/PDMS萃取头在70℃下,萃取30 min后,在GC进样口温度为250℃下分别解析1、3、5、7、9 min,检测挥发性成分,结果见图5。测出的峰面积和出峰数呈先增大后降低趋势。当解析时间小于5 min时,随着解析时间延长,峰面积和出峰数逐渐增大;在解析时间从5 min增加到7 min时,峰面积和出峰数无明显差异;而当解析时间大于7 min时,其峰面积和出峰数又降低。解析时间直接影响到挥发性成分从萃取头涂层的解析程度。解析时间较短时,不利于挥发性成分从萃取头涂层解析,而解析时间过长时,一些挥发性成分在高温下可能发生氧化、异构化等化学反应[27],从而影响检测效果。
2.2 羊奶中挥发性成分的分析
应用优化的HS-SPME条件萃取羊奶中挥发性成分,再经GS/MS分析检测,共检测出42种成分(见表1),其中酸类最多,有14种;其次是酯类、烷烃、芳香族、杂环、醇和醛酮,分别有6、5、5、5、4和3种。挥发性酸类成分主要由短链和中链脂肪酸组成,其中短链脂肪酸有10种,分别为2,2-二甲基丙酸、乙酸、丁酸、戊酸、己酸、庚酸、辛酸、4-甲基辛酸、壬酸和癸酸,相对含量较高的是己酸(15.67%)、辛酸(23.59%)和癸酸(29.09%),占总挥发性成分的68.35%,可见挥发性酸类成分是羊奶中的主要成分。大量研究报道,膻味与挥发性酸的种类和含量有关,何胜华等人[20]指出羊奶中膻味可能与庚酸、辛酸、壬酸和癸酸有关;Chilliard等人[28]和Carunchia等人[29]报道,膻味与4-甲基辛酸有关。可见挥发性酸类成分是羊奶的主要风味物质。同时,羊奶中也检测出6种挥发性酯类化合物,可赋予羊奶特殊的香气。此外,烷烃、芳香族、醇、醛酮和杂环类均是羊奶粉特殊风味的重要组成部分,这些挥发性成分中,相对含量较高的有丙酮、苯甲醛、2-甲基异丙醇和甘菊环。
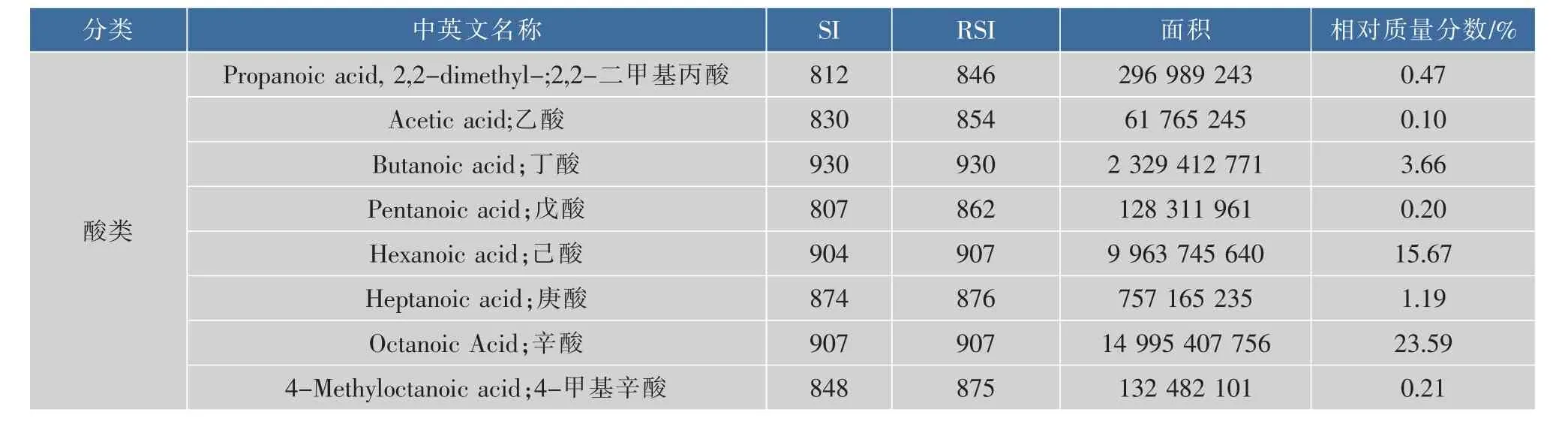
表1 羊奶中挥发性成分GC/MS分析结果Table 1 GC/MS analytical results of volatile compounds from goat milk
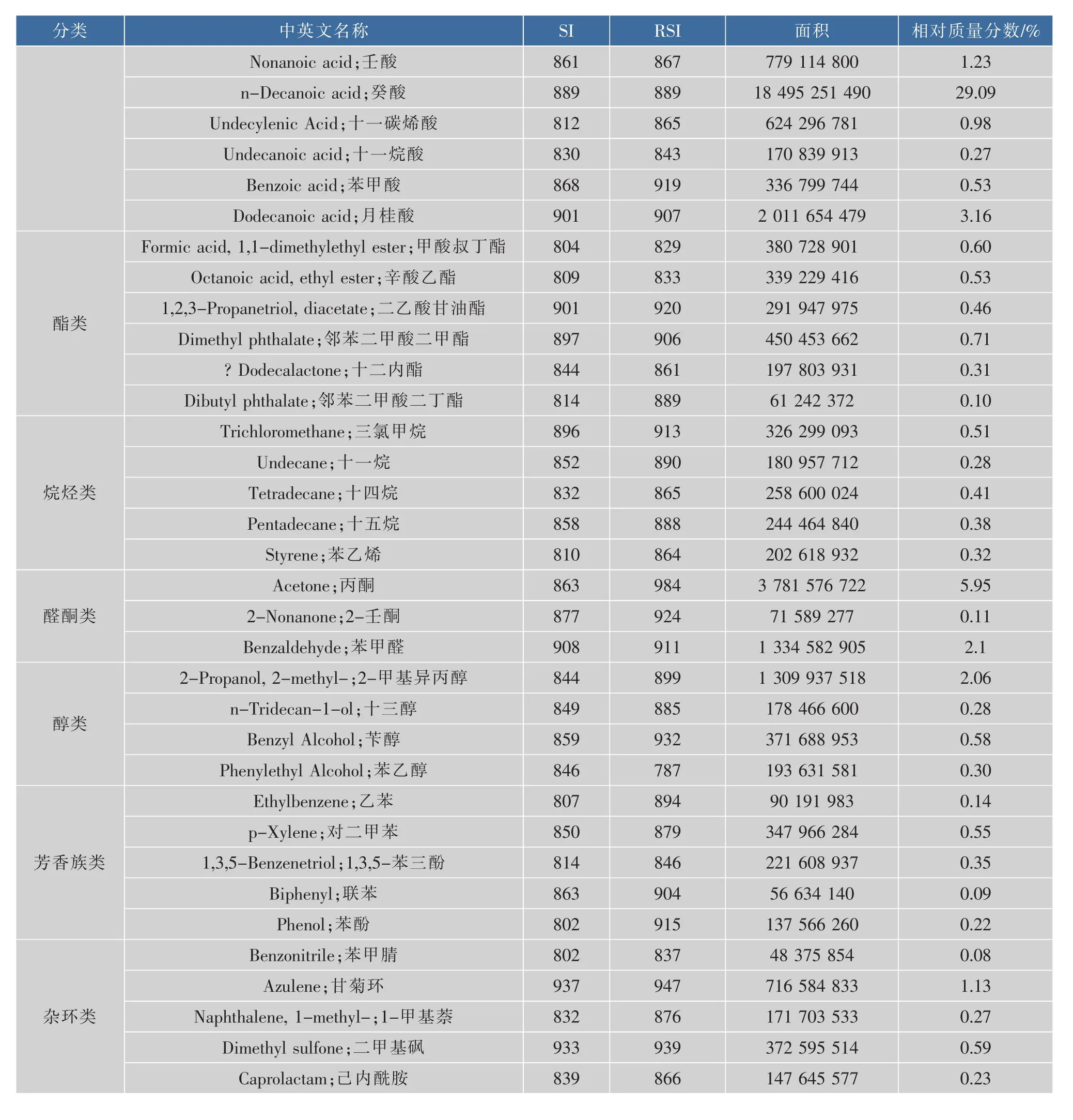
分类SI中英文名称RSI相对质量分数/%Nonanoic acid;壬酸861779 114 8001.23面积n-Decanoic acid;癸酸889 86788918 495 251 490 812 0.98 865 Undecylenic Acid;十一碳烯酸624 296 781Undecanoic acid;十一烷酸0.27843Benzoic acid;苯甲酸170 839 913 868919336 799 744Dodecanoic acid;月桂酸9018309072 011 654 4798043.16 Formic acid,1,1-dimethylethyl ester;甲酸叔丁酯829380 728 9010.60809833 Octanoic acid,ethyl ester;辛酸乙酯339 229 416 0.53酯类0.531,2,3-Propanetriol,diacetate;二乙酸甘油酯9200.46 901291 947 975906Dimethyl phthalate;邻苯二甲酸二甲酯8970.71 450 453 662 844861 ?Dodecalactone;十二内酯197 803 9310.31814889Dibutyl phthalate;邻苯二甲酸二丁酯61 242 3720.10896913326 299 0930.51Undecane;十一烷852890180 957 712烷烃类Trichloromethane;三氯甲烷8658320.28 258 600 0240.41Pentadecane;十五烷888 858244 464 840Styrene;苯乙烯29.09810 Tetradecane;十四烷202 618 932 8640.32Acetone;丙酮9843 781 576 722 8635.95 0.38醛酮类2-Nonanone;2-壬酮87792471 589 2770.11Benzaldehyde;苯甲醛9111 334 582 905 9082-Propanol,2-methyl-;2-甲基异丙醇8448991 309 937 518n-Tridecan-1-ol;十三醇醇类849885178 466 6000.28859 Benzyl Alcohol;苄醇371 688 9539320.58Phenylethyl Alcohol;苯乙醇787193 631 581 84680790 191 9830.14 894p-Xylene;对二甲苯850879347 966 2840.55芳香族类1,3,5-Benzenetriol;1,3,5-苯三酚814846221 608 9370.35Biphenyl;联苯Ethylbenzene;乙苯2.06 86390456 634 1400.09 915Phenol;苯酚802137 566 2600.22Benzonitrile;苯甲腈80283748 375 8540.08 Azulene;甘菊环937716 584 833 9471.13杂环类876 Naphthalene,1-methyl-;1-甲基萘832171 703 5330.27Dimethyl sulfone;二甲基砜9332.1 939372 595 5140.59 Caprolactam;己内酰胺839866147 645 577 0.300.23
3 结语
采用HS-SPME方法对羊奶挥发性成分进行萃取,获得的最优条件为:在12 mL奶样中,添加0.3 g/mL的NaCl,用CAR/PDMS萃取头在70℃下萃取90 min,然后在250℃下解析5 min,可获得最大的出峰面积和出峰数,最大限度地提取出羊奶中挥发性成分。应用最优条件萃取羊奶中挥发性成分,再经GC/MS分析,共检测出42种成分。其中酸类成分最多,有14种,其次是酯类、烷烃、芳香族、杂环、醇和醛酮,分别有6、5、5、5、4和3种。
参考文献:
[1]顾浩峰,张富新,梁蕾,等.山羊奶与牛奶和人奶营养成分的比较[J].食品工业科技,2012,33(8):369-373.
GU Haofeng,ZHANG Fuxin,LIANG Lei,et al.Comparison of nutritional components for goat milk,cow milk and human milk[J]. Science and Techcnology of Food Industry,2012,22(8):369-373.(in Chinese)
[2]张怡,张富新,贾润芳,等.水分活度对全脂羊奶粉贮藏期间脂肪稳定性的影响[J].食品工业科技,2013,34(1):327-333.
ZHANG Yi,ZHANG Fuxin,JIA Runfang,et al.Effect of water activity on the stability of fat in whole goat milk powder during storage[J].Science and Techcnology of Food Industry,2013,34(1):327-333.(in Chinese)
[3]焦凌梅,袁唯.改善山羊乳风味的方法研究[J].乳品加工,2006,6:56-58.
[4]Chilliard Y,Ferlay A,Rouel J,Lamberet G.A review of nutritional and physiological factors affecting goat milk lipid synthesis and lipolysis[J].Journal of Dairy Science,2003,86(5):1751-1770.
[5]Curioni P M G,Bosset J O.Key odorants in various cheese types as determined by gas chromatography-olfactometry[J]. International Dairy Journal,2002,12:959-984.
[6]Cullere L,Escudero A,Ferreira V.Gas Chromatography-olfactometry and chemical quantitative study of the aroma of six premium quality spanish aged red wines[J].Journal of Agricultural and Food Chemistry,2004,52:1563-1660.
[7]Sagratini G,Maggi F,Caprioli G,et al.Comparative study of aroma profile and phenolic content of montepulciano monovarietal red wines from the Marches and Abruzzo regions of Italy using HS-SPME-GC-MS and HPLC-MS[J].Food Chemistry,2012,132:1592-1599.
[8]宋江峰,李大婧,刘春泉,等.甜糯玉米软罐头主要挥发性物质主成分分析和聚类分析 [J].中国农业科学,2010,43(10):2122-2131.
SONG Jiangfeng,LI Dajing,JIU Chunquan,et al.Principal components analysis and cluster analysis of flavor compositions in waxy corn soft can[J].Scientia Agricultura Sinica,2010,43(10):2122-2131.(in Chinese)
[9]Hu Y L,Fan Y F,Li G K.Preparation and evaluation of a porous monolithic capillary column for microextraction of estrogens from urine and milk samples online coupled to high-performance liquid chromatography[J].Journal of Chromatography A,2012,1228:205-212.
[10]Melo A,Aguiar A,Mansilha C,et al.Optimisation of a solid-phase microextraction/HPLC/Diode Array method for multiple pesticide screening in lettuce[J].2012,130:1090-1097.
[11]Cao X Q,Wu A C,Yue Y,et al.A high-throughput method for the simultaneous determination of multiple mycotoxins in human and laboratory animal biological fluids and tissues by PLE and HPLC-MS/MS[J].Journal of Chromatography B,2013,942:113-114.
[12]Kataoka H,Lord H L,Pawliszyn J.Application of solid-phase microextraction in food analysis[J].Journal of Chromatography A,2000,880:35-62.
[13]Wardencki W,Michulec M,Curylo J.A review of theoretical and practical aspects of solid-phase microextraction in food analysis [J].International Journal of Food Science and Technology,2004,39:703-717.
[14]Zhang Z Y,Yang M J,Pawliszyn J.solid-phase microextraction[J].Analytical Chemistry,1994,66(7):844-853.
[15]Costa R,Tedone L,Grazia S D,et al.Multiple headspace-solid-phase microextraction:An application to quantification of mushroom volatiles[J].Analytica Chimica Acta,2013,770:1-6.
[16]Haftka J H,Scherpennisse P,Jonker M T O,Hermens J L M.Using Polyacrylate-Coated SPME Fibers To Quantify Sorption of Polar and Ionic Organic Contaminants to Dissolved Organic Carbon[J].Environmental Science&Technology,2013,47:4455-4462.
[17]Westland J L,Dorman F L.Comparison of SPME and static headspace analysis of blood alcohol concentration utilizing two novel chromatographic stationary phases[J].Forensic Science International,2013,231:e50-e56.
[18]Kusano M,Iizuka Y,Kobayashi M,et al.Development of a Direct Headspace Collection Method from Arabidopsis Seedlings Using HS-SPME-GC-TOF-MS Analysis[J].Metabolites,2013,3:223-242.
[19]Aardt M V,Duncan S E,Bourne D,et al.Flavor Threshold for Acetaldehyde in Milk,Chocolate Milk,and Spring Water Using Solid Phase Microextraction Gas Chromatography for Quantification [J].Journal of Agricultural and Food Chemistry,2001,49:1377-1381.
[20]何胜华,杨鑫,李海梅,等.固相微萃取技术(SPME)分析羊奶中挥发性化合物[J].食品工业科技,2009,30(12):133-135. HE Shenghua,YANG Xin,LI Haimei,et al.Analysis of volatile compounds from goat milk by solid-phase microextraction[J]. 2009,30(12):133-135.(in Chinese)
[21]Lecanu L,Ducrurt V,Jouquand C,et al.Optimization of headspace solid-phase microextraction(SPME)for the odor analysis of surface-ripened cheese[J].Journal of Agricultural and Food Chemistry,2002,50:3810-3817.
[22]Aardt M V,Duncan S E,Bourne D,et al.Flavor threshold for acetaldehyde in milk,chocolate milk,and spring water using solid phase microextraction gas chromatography for quantification[J].Journal of Agricultural and Food Chemistry,2001,49:1377-1381.
[23]李林强,昝林森.西农萨能奶山羊乳和荷斯坦牛乳挥发性游离脂肪酸组成比较及分子机理分析 [J].食品与生物技术学报,2011,30(6):822-826. LI Lingqiang,ZAN Linsen.A comparison of milk volatile free fatty acids from xinong saanen goat and Holstein cattle and molecular mechanism analysis[J].Journal of Food Science and Biotechnology,2011,30(6):822-826.(in Chinese)
[24]Marsili R T.Shelf-life prediction of processed milk by solid-phase microextraction,mass spectrometry,and multivariate analysis [J].Journal of Agricultural and Food Chemistry,2000,48:3470-3475.
[25]傅彦斌.固相微萃取分析条件的优化[J].干旱环境检测,2006,20(6):49-51. FU Yanbin.Optimizing analytical condition of SPME[J].Arid Cnuironmentdal Monitoring,2006,20(6):49-51.(in Chinese)
[26]何宇洁.液熏灌肠加工工艺研究及其挥发性风味物质的检测[D].合肥:合肥工业大学,2012.
[27]刘晓慧,张丽霞,王日为,等.顶空固相微萃取-气相色谱-质谱联用法分析黄茶香气成分[J].食品科学,2010,31(16):239-243. LIU Xiaohui,ZHANG LiXia,WANG Riwei,et al.Analysis of volatile components of yellow tea by HS-SPME/GC-MS[J].Food science,2010,31(16):239-243.(in Chinese)
[28]Chilliard Y,Ferlay A,Rouel J,et al.A review of nutritional and physiological factors affecting goat milk lipid synthesis and lipolysis[J].Jounal of Dairy Science,1984,67(10):2216-2223.
[29]Carunchia M E,Karagul-Yuceer Y,Avsr Y K,et al.Identification and quantification of character aroma components in fresh chevre-style goat cheese[J].2003,68(8):2441-2447.
Optimization of Head Space Solid Phase Micro-Extraction Conditions for Volatile Components in Goat Milk
AI Dui, ZHANG Fuxin*, YU Lingling, SU Weili, LIN Leying
(College of Food Engineering and Nutritional Science,Shanxi Normal University,Xi'an 710062,China)
Head Space Solid phase micro-extraction(HS/SPME)coupled with gas chromatography(GC)were used for the determination of volatile compounds in goat milk.HS/SPME experimental parameters,such as SPME fibre,extraction temperature,NaCl concentration,extraction time and desorption time were optimized using the number and area of peaks as index.The optimal extraction efficiency for goat milk was achieved when sample was headed at 70℃ for 90 min after the addition of 0.3 g/mL NaCl,extracted by a carboxen/polydimethylsiloxane(CAR/PDMS)fibre,and than the fibre was transferred to a GC injection port for thermal desorption at 250℃for 5 min.As a result,42 kinds of volatile components were detected that including acids(14 kinds),esters(6 kinds),hydrocarbons(5 kinds),alcohols(4 kinds),aldehydes(3 kind),aromatic(5 kinds)and heterocyclic(5 kinds).
goat milk,HS/SPME,volatile components,GC-MS
TS 252.1
A
1673—1689(2015)01—0040—07
2014-05-04
国家“十二五”科技支撑计划项目(2013BAD18B00);农业部公益性行业(农业)科研专项(201103038)。
*通信作者:张富新(1962—),男,陕西咸阳人,教授,主要从事乳品科学研究。E-mail:fuxinzh@snnu.edu.cn

