PI3K/Akt信号通路在严重烧伤大鼠血清诱导BMSCs迁移中的作用*
李茂华,滕 苗,果 磊
(重庆医科大学附属第一医院烧伤整形外科 400016)
论著·基础研究
PI3K/Akt信号通路在严重烧伤大鼠血清诱导BMSCs迁移中的作用*
李茂华,滕 苗,果 磊△
(重庆医科大学附属第一医院烧伤整形外科 400016)
目的探讨严重烧伤大鼠血清对骨髓间充质干细胞(BMSCs)迁移的影响及作用机制。方法建立严重烧伤大鼠模型,并制备严重烧伤大鼠血清。实验分为正常培养组(含10%胎牛血清,C组)、烧伤血清组(含10%烧伤大鼠血清,B组)、烧伤血清+阻断剂组(含10%烧伤大鼠血清+终浓度为10 μmol/L的PI3K信号通路抑制剂LY294002,B+LY组),MTT法检测各组细胞活性;Transwell小室检测各组细胞迁移情况;Western blot检测各组细胞p-Akt、Akt蛋白表达;免疫荧光检测各组细胞微管结构。结果与C组比较,B组烧伤血清处理24 h后,BMSCs细胞活性增高(P<0.01),p-Akt水平升高(P<0.05),细胞微管结构出现解聚,迁移数量增高(P<0.001);加入抑制剂后,与B组比较,B+LY组BMSCs细胞活性降低(P<0.01),迁移数量降低(P<0.001),p-Akt水平降低(P<0.05),细胞微管结构变化不明显。结论严重烧伤大鼠血清可促进BMSCs细胞迁移,可能与烧伤血清中细胞因子激活PI3K/Akt信号通路相关,进而引起BMSCs细胞微管结构变化,促进BMSCs迁移。
烧伤;间质干细胞;微管;迁移;PI3K/Akt;信号通路
严重烧伤有别于一般创伤,损伤组织。以及免疫防御系统可分泌大量炎症介质、细胞因子和烧伤毒素。烧伤后,在毛细血管通透性增加导致全身循环血量下降以前,即可发生心肌缺血缺氧损害和心功能减退,从而诱发或加重烧伤休克,即“休克心现象”[1],加重多器官损害,是导致患者死亡的主要原因。烧伤后各脏器结构、功能损伤修复,以及烧伤创面的愈合一直是临床救治的难点。
间充质干细胞(MSCs)是来源于发育早期中胚层和外胚层的一类成体干细胞,其取材简便、来源广泛,具有自我更新、快速增殖及多向分化潜能,且能分泌多种细胞因子,调节微环境,能够向损伤组织迁移,分泌细胞因子减缓全身及局部炎症,减少受损组织细胞的凋亡,促进血管生成,激活内源性干细胞,减轻器官组织功能紊乱,提高动物模型的生存率[2],为烧伤临床治疗开拓新的治疗方法。研究发现将载有绿色荧光蛋白(GFP)的人骨髓间充质干细胞(hBMSCs)移植在烧伤小鼠创面,hBMSCs可向血管内皮样细胞分化,促进烧伤创面愈合[3]。但严重烧伤时,损伤组织微环境对MSCs有何种影响,目前尚不明确。吕根法等[4]研究发现烧伤血清作用下的心肌细胞存在PI3K/Akt和p38信号通路的交叉对话,并可能对心肌细胞产生调控作用。PI3K/Akt通路是膜受体信号向细胞内转导的重要途径,可被细胞因子和理化因素激活,具有调控物质代谢、基因表达、细胞迁移、增殖和存活等多种生物学功能。研究发现在BMSCs向胶质瘤的定向迁移过程中,PI3K信号通路发挥了作用[5]。严重烧伤血清能否激活PI3K/Akt通路,促进BMSCs向损伤组织、细胞迁移,进而促进损伤组织修复、创面愈合,目前尚未见文献报道。
本实验拟采用严重烧伤大鼠血清模拟严重烧伤微环境培养BMSCs,观察烧伤血清对BMSCs活性、迁移的影响,探讨PI3K/Akt通路在此过程中的作用。
1 材料与方法
1.1 细胞、主要试剂及仪器 SD大鼠BMSCs细胞株及BMSCs细胞完全培养基(广州赛业生物科技有限公司);胎牛血清(FBS,Gibco,USA);MTT(碧云天生物技术研究所);α-tubulin单克隆抗体(Proteintech,USA);β-actin单克隆抗体(Proteintech,USA);Akt单克隆抗体(Abcam,USA);p-Akt单克隆抗体(Cell Signaling,USA);山羊抗兔IgG二抗(Proteintech,USA);FITC标记荧光二抗(Proteintech,USA);LY294002(Santa Cruz,USA);HEPA Class 100型CO2孵箱(Thermo,USA);M88自动酶标仪(Thermo,USA);Fusion FX7凝胶成像分析系统(VILBER lour MAT,French),激光共聚焦(LSM 510 META,Germany)。
1.2 方法
1.2.1 严重烧伤大鼠血清的制备 取体质量200~280 g 的雄性SD 大鼠30 只(第三军医大学实验动物中心提供),参考文献[6],制成40%TBSA的Ⅲ度烫伤模型。伤后 6 h在无菌操作下抽取腹主动脉血,室温凝血,4 ℃过夜,使血凝块尽量收缩。吸出血清,4 ℃ 3 000 r/min离心15 min,取上清液,56 ℃加热30 min 以灭活补体。上清液分装,-20 ℃冻存备用。
1.2.2 实验分组 取第3代生长状态良好BMSCs,实验随机分为:正常培养组(C组)、烧伤血清组(B组)、烧伤血清+阻断剂组(B+LY组),待细胞融合达80%~90%时,加入无血清BMSCs细胞基础培养基饥饿同化24 h,C组加入含10%胎牛血清(FBS)的BMSCs培养基,B组加入含10%烧伤大鼠血清的BMSCs培养基,B+LY组加入抑制终浓度为10 μmol/L的PI3K信号通路抑制剂LY294002+含10%烧伤大鼠血清的BMSCs培养基,作用24 h后进行相应检测。
1.2.3 MTT法检测BMSCs细胞活性 按1.2.2分组处理细胞,以2×105个/200 μL接种于96孔板,每组6个复孔,24 h后吸去培养液,PBS洗涤2次,每孔加入MTT(5 mg/mL)20 μL,继续培养4 h,弃上清液,加入150 μL甲基亚砜(DMSO)振荡10 min,用自动酶标仪在570 nm处测定吸光值(A),本实验重复3次。
1.2.4 Transwell小室检测细胞迁移 按1.2.2分组处理细胞,调整细胞浓度为4×104个/400 μL接种于Transwell小室上室中,C组Transwell小室下室加入600 μL含10%FBS的BMSCs细胞培养基,B组下室内加入600 μL含10%烧伤大鼠血清的BMSCs细胞培养基,B+LY组在Transwell上室加入抑制终浓度为10 μmol/L的PI3K信号通路抑制剂LY294002,下室内加入600 μL含10%烧伤大鼠血清的BMSCs细胞培养基,放入 37 ℃、5% CO2培养箱继续培养。24 h后取出Transwell小室,将上室培养基吸尽,用棉签擦拭上室中的细胞,PBS清洗1次,并将小室置于4%多聚甲醛中室温固定20 min,PBS清洗1次,结晶紫染色30 min,PBS清洗,显微镜下观察小室半透膜下表面细胞并计数,每组按照上下左右中随机选取5个视野,取5个视野细胞总数的均数进行统计分析,以迁移至小室半透膜下表面细胞个数的均数表示细胞的迁移能力。
1.2.5 Western blot检测Akt、p-Akt蛋白的表达 按1.2.2分组处理细胞,收集细胞进行离心沉淀,按总蛋白提取试剂盒说明书提供的方法提取细胞总蛋白,采用BCA法测定蛋白浓度。取40 μg/孔蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),5%BSA室温封闭2 h,分别加入Akt(1∶500)、p-Akt(1∶500)抗体,4 ℃过夜;次日,TBST洗膜3次,加入1∶4 000稀释的HRP标记的山羊抗兔二抗,37 ℃孵育2 h,化学发光、显影,凝胶成像仪获取图像,Image J 软件进行灰度分析,结果以p-Akt与Akt灰度值比值表示。本实验重复3次。
1.2.6 免疫荧光染色观察细胞微管结构 按1.2.2分组处理细胞,以1×103个/mL密度接种于无菌玻片的24孔板中,24 h后,用4%的多聚甲醛室温固定细胞爬片30 min,0.1% Triton X-100破膜20 min,5%山羊血清37 ℃封闭30 min,滴加兔抗大鼠的α-tubulin单克隆抗体(1∶100),4 ℃过夜;滴加荧光二抗(1∶100),37 ℃避光孵育1 h,滴加DAPI(1∶100),37 ℃避光孵育5 min,抗荧光淬灭剂封片,每步操作前均要用PBS洗3遍,每遍5 min,但血清封闭后不洗,直接加一抗。激光共聚焦显微镜下观察并拍照。
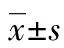
2 结 果
2.1 MTT法检测BMSCs活性 C组、B组、B+LY组细胞活性分别为1.76±0.09、1.93±0.06、1.57±0.2(F=9.10,P<0.01)。与C组比较,B组细胞增多,活性增高(t=3.50,P<0.01);加入抑制剂后,B+LY组细胞活性较B组降低(t=3.80,P<0.01)。

A:C组;B:B组;C:B+LY组。
图1 3组BMSCs细胞迁移情况(×100)
2.2 Transwell小室检测细胞迁移 与C组比较,B组每100倍视野下迁移至小室半透膜下表面的细胞增多(t=7.14,P<0.01),B+LY组迁移至小室半透膜下表面的细胞数量较B组明显减少(t=9.13,P<0.01)。见图1、表1。
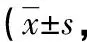
表1 3组BMSCs细胞迁移数比较个)
2.3 Western blot检测Akt、p-Akt蛋白的表达 24 h后,各组p-Akt/Akt比值分别为0.42±0.04、0.95±0.02、0.63±0.02,B组细胞Akt磷酸化水平较C组增高(t=20.29,P<0.01),加入抑制剂后,B+LY组细胞Akt磷酸化水平较B组降低(t=16.68,P<0.01),见图2。
2.4 免疫荧光染色观察细胞微管结构 C组细胞微管以胞核为中心向四周呈放射状分布,B组细胞微管出现解裂增多,排列紊乱,B+LY组微管结构与C组相似,见图3。

a:P<0.05,与C组比较;b:P<0.05,与B+LY组比较。
图2 3组BMSCs细胞Akt活化状态

A:C组;B:B组;C:B+LY组。
图3 3组BMSCs细胞微管的分布及形态变化
3 讨 论
严重烧伤后引起的脏器损害和功能下降,特别是烧伤合并多器官功能障碍综合征,是导致患者死亡的主要原因,烧伤后各脏器结构和功能损伤的确切机制仍不完全明了,严重烧伤一直是困扰医学界的难题。近年,干细胞与组织工程学的飞速发展,为大面积烧(创)伤的修复开辟了新的途径。目前已有研究表明MSCs可促进烧伤创面愈合,胡克苏等[7]将人脐带间充质干细胞(UC-MSCs)移植修复烧伤皮肤,研究发现UC-MSCs移植治疗可能通过抑制皮损局部炎性反应,减少淋巴细胞的浸润,促进血管的再生和成纤维细胞的生长促进损伤皮肤的修复。此外,研究将BMSCs移植到严重烧伤大鼠体内,研究发现移植后BMSCs能够向受损肝组织定植,对烧伤引起的肝损伤有明显的修复作用,其机制可能与抑制细胞凋亡有关[8]。MSCs移植后,其定向迁移至受损部位是其发挥作用的前提,损伤组织分泌细胞黏附因子、趋化因子和生长因子等相互调节,可影响MSCs的黏附、迁移。烧伤后患者血清中含有集落刺激因子、转化生长因子-β(TGF-β)、血小板衍生生长因子(PDGF)、胰岛素生长因子-1(IGF-1)、表皮生长因子(EGF)等。严重烧伤患者血清可显著刺激人脐带间充质干细胞(hUCMSCs)快速增殖,不引起细胞凋亡,能减少细胞衰老[9]。但严重烧伤血清能否促进MSCs迁移尚不清楚。
PI3K/Akt信号通路最早被发现在胰岛素刺激及其应答的调控中起重要作用。随着研究的深入和下游底物的不断发现,PI3K/Akt信号通路作为一条非常重要的细胞内信号转导通路被人们所认识。Akt是PI3K信号通路的直接下游效应分子,PI3K可被PDGF、IGF、胰岛素、成纤维生长因子(FGF)、重组人EGF、骨形态发生蛋白2(BMP-2)等细胞因子与其受体结合而激活,活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad[10]、mTOR[11]、Caspase9、NF-κB、GSK-3、FKHR、p21Cip1和p27 Kip1等,进而调节细胞的增殖、分化、凋亡,以及迁移等[12]。研究发现,用PI3K/Akt抑制剂LY294002和Wortmannin可减弱SDF-1α和bFGF诱导的MSCs迁移[13-14]。
本实验以严重烧伤血清处理BMSCs模拟体内严重烧伤环境,实验结果表明,烧伤血清处理24 h后,BMSCs细胞活力、细胞迁移数量较正常培养组增高,且p-Akt水平增高,表明严重烧伤血清可促进BMSCs细胞迁移,且可激活PI3K/Akt信号通路。为进一步证实烧伤血清诱导PI3K/Akt信号通路活化是否参与BMSCs细胞的迁移,加入PI3K/Akt信号通路抑制剂LY294002后,BMSCs细胞迁移能力明显受抑,表明严重烧伤血清可促进BMSCs细胞迁移,可能与其激活PI3K/Akt信号通路相关。此外,本实验还发现严重烧伤血清处理BMSCs后,BMSCs细胞微管结构解聚/聚合动态失衡,发生解聚,同时细胞迁移能力增强,但用PI3K/Akt信号通路抑制剂LY294002作用后BMSCs细胞微管结构与正常培养组相似,且细胞迁移能力减弱,说明严重烧伤血清可能激活BMSCs细胞PI3K/Akt信号通路,进而影响细胞微管结构发生变化,使细胞骨架解聚/聚合的动态平衡被打破,朝解聚方向移动,以利于细胞迁移。
有研究表明,细胞迁移需要微管介导的细胞体的收缩、伸展等一系列过程,缺氧可使表皮细胞微管动力学发生变化,增强细胞迁移能力[15]。PI3K/Akt信号通路可影响许多细胞结构,特别是肿瘤细胞。核糖体蛋白S6激酶[p70(S6K)]是PI3K/Akt信号通路下游信号分子,p70(S6K)可通过肌动蛋白纤维交联蛋白调节细胞骨架动力学。过表达p70(S6K)可促进卵巢癌细胞定向迁移[16]。p70(S6K)可快速激活Ras相关的C3肉毒素底物1、细胞分裂周期蛋白42以及他们下游信号分子p21小GTP酶活化激酶1[16]。抑制p70(S6K)可导致其下游蛋白表达下调及肌动蛋白骨架结构重组。但在严重烧伤环境下,严重烧伤血清中哪些物质激活PI3K/Akt信号通路,通过调控细胞微管骨架结构变化,进而促进细胞迁移能力的具体作用机制还有待进一步研究。
[1]Huang YS,Jiaping Z,Xiaohui L.A serial studies oni°post-burn shock hearti[J].Burns,2007,33(Suppl 1):S14-S15.
[2]Wannemuehler TJ,Manukyan MC,Brewster BD,et al.Advances in mesenchymal stem cell research in sepsis[J].J Surg Res,2012,173(1):113-126.
[3]Xue L,Xu YB,Xie JL,et al.Effects of human bone marrow mesenchymal stem cells on burn injury healing in a mouse model[J].Int J Clin Exp Pathol,2013,6(7):1327-1336.
[4]吕根法,陈璧,张万福,等.烧伤血清作用下心肌细胞蛋白激酶B和p38丝裂原活化蛋白激酶通路的交叉对话研究[J].中华烧伤杂志,2008,24(4):263-267.
[5]胡宜,程鹏,刘云会.磷脂酰肌醇-3-激酶信号通路在骨髓间充质干细胞向胶质瘤定向迁移中的作用[J].广东医学,2014,52(35):507-510.
[6]郑军,黄跃生,黄晓元,等.反义p38α基因转染对缺氧复合烧伤血清处理心肌细胞炎性因子的表达[J].第三军医大学学报,2004,26(23):2097-2101.
[7]胡克苏,祁俊,蔡玉辉,等.人脐带间充质干细胞移植修复烧伤皮肤的机制[J].江苏医药,2014,40(8):759-761.
[8]陈浩,尹飞,孟春阳,等.骨髓间充质干细胞移植对严重烧伤大鼠肝损伤的修复作用及其机制[J].吉林大学学报,2014,40(2):219-223.
[9]刘玲英,柴家科,侯玉森,等.严重烧伤患者血清对人脐带MSCs生物学特性的影响[J].中国修复重建外科杂志,2013,27(7):769-774.
[10]Del Peso L,González-García M,Page C,et al.Interleukin-3-induced phosphorylation of BAD through the protein kinase Akt[J].Science,1997,278(5338):687-689.
[11]Agani F,Jiang BH.Oxygen-independent regulation of HIF-1:novel involvement of PI3K/AKT/mTOR pathway in cancer[J].Curr Cancer Drug Targets,2013,13(3):245-251.
[12]Misra UK,Pizzo SV.Activation of Akt/PDK signaling in macrophages upon binding of receptor-recognized forms of alpha2-macroglobulin to its cellular receptor:effect of silencing the CREB gene[J].J Cell Biochem,2004,93(5):1020-1032.
[13]Liu H,Xue W,Ge G,et al.Hypoxic preconditioning advances CXCR4 and CXCR7 expression by activating HIF-1α in MSCs[J].Biochem Biophys Res Commun,2010,401(4):509-515.
[14]Rosova L,Dao M,Capoccia B,et al.Hypoxic preconditioning results in increased motility and improved therapeutic potential of human mesenchymal stem cells[J].Stem Cells,2008,26(8):2173-2182.
[15]Schreml S,Szeimies RM,Prantl L,et al.Oxygen in acute and chronic wound healing[J].Br J Dermatol,2010,163(2):257-268.
[16]Ip CK,Cheung AN,Ngan HY,et al.p70 S6 kinase in the control of actin cytoskeleton dynamics and directed migration of ovarian cancer cells[J].Oncogene,2011,30(21):2420-2432.
Role of PI3K/Akt signal pathway in BMSCs migration induced by serum of rats with severely burn*
LiMaohua,TengMiao,GuoLei△
(DepartmentofBurnandPlasticSurgery,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China.)
ObjectiveTo study the effects of severely burned rats serum on migration of BMSCs and mechanism.MethodsSeverely burned rats model was established,and the preparation of severely burned rats serum.Experimental groups:normal training group(containing 10% fetal bovine serum,group C),burn serum group(containing 10% burns in the rat serum,group B),burn serum+blockers(10% burns in the rat serum+final concentration of 10 μmol/L PI3K signaling pathway inhibitor LY294002 training,group B+LY).Activity of cells was examined with MTT;migration of cells was examined with Transwell chambers testing;protein expression of p-AKT/AKT was determined with Western blot;microtubule structure of cells was examined with immunofluorescence.ResultsCompared with group C,group B burn serum treatment after 24 h,BMSCs activity(P<0.01),p-AKT levels(P<0.05),increased migration quantity(P<0.001);cell microtubule structures appear rupture,after adding inhibitor,compared with group B,group B+LY BMSCs activity(P<0.01),to reduce the number of migration(P<0.001),p-lower AKT(P<0.05),cell microtubule structure similar to the normal group.ConclusionSeverely burned rats serum can promote BMSCs migration,may burn serum cytokine activation of PI3K/AKT signal pathway,resulting in cell microtubule structure change,promote the migration of BMSCs.
burns;mesenchymal stem cells;microtubules;migration;PI3K/Akt;signaling pathway
10.3969/j.issn.1671-8348.2015.27.003
重庆市基础与前沿研究计划项目(cstc2013jcyjA10069)
:李茂华(1989-),硕士,研究方向为创面愈合与瘢痕防治。△
,E-mail:cqguolei@sina.com。
R34
A
1671-8348(2015)27-3752-04
2015-03-07
2015-06-13)
——水芹主要害虫识别与为害症状

