结构化学中的VSEPR理论与八隅体规则
路慧哲 杜凤沛
(中国农业大学理学院应用化学系 北京 100193)
结构化学中的VSEPR理论与八隅体规则
路慧哲 杜凤沛
(中国农业大学理学院应用化学系 北京 100193)
介绍在新型晶体结构中出现的不符合八隅体规则的现象,讨论了结构化学教学中VSEPR理论与八隅体规则的相关问题,帮助学生客观准确地理解相关理论及应用。
结构化学 VSEPR理论 八隅体规则
物质的新结构一直是科学工作者的兴趣所在。2013年,美国《科学》杂志发表了在高压物理领域的最新研究成果《钠氯间反常计量比化合物》[1],通过理论预测并实验验证了在Na-Cl体系中,高压下存在不符合八电子规则(即八隅体规则)的反常计量比化合物。文中用结构化学的VSEPR理论解释了这一不符合八隅体规则的情况。
1 VSEPR理论
VSEPR理论即价层电子对互斥理论(valence shell electron pair repulsion theory, VSEPR),以简单的电子对互斥判断多原子分子的几何结构。VSEPR 理论认为:原子周围各个价电子对之间由于相互排斥,在键长一定的条件下,相互间距离愈远愈稳定。
关于VSEPR理论的发展首先要追溯到1940 年,Sidgwick和Powell[2]分析当时已知的分子结构, 提出了只有单键结合的分子, 外层或价电子对尽可能远离的观点。其中的价电子对包括成键电子对(bond pairs,BP)和孤电子对(lone pairs,LP)。他们认为电子对作用相等, 所有电子对都占有一定的空间, 而且所有的电子对都相互排斥, 称为Sidgwick-Powell理论。1957年,Gillespie和Nyholm[3]发展了Sidgwick-Powell理论,进一步预测和解释了一些分子的结构;此后,Gillespie扩充完备了上述观点,提出了VSEPR理论[ 4-6]。
VSEPR理论忽略了许多次要因素,抓住价层电子对相互排斥这一主要因素,结合简单的几何知识对整个分子的构型进行预测。该理论不考虑中心原子的杂化轨道的形状,仅仅考虑价层电子对的数目,多用于对分子构型的预测,方法简便而准确。因此,VSEPR 理论已经同经典价键理论、杂化轨道理论以及分子轨道理论一并成为大学化学价键理论体系的核心内容。
2 VSEPR理论的应用
VSEPR理论能解释许多化合物的几何构型[7],是一种简捷快速地预测多原子分子几何构型的方法,对于以A为中心的ABn型分子,根据中心原子A的价电子数和成键情况,确定其成键电子对BP数目(每形成一个BP,原子A贡献一个价电子,另一个价电子由原子B贡献) 及孤电子对LP数目的总和。根据电子对尽量远离的原则,确定分子构型。VSEPR理论认为,成键电子对的中心在以A为球心的球面上等距离分布,当成键电子对数为2时,其两中心点是通过球心的直径两端,分子为直线形;当成键电子对数为3时,其三中心点是通过球心的内接三角形顶点,分子为三角形;当成键电子对数为4时,分子为四面体形;当成键电子对数为5时,分子为三角双锥形;当成键电子对数为6时,分子为八面体形。以上规则在许多分子的结构分析中得到验证,简便而准确。例如:BeCl2,中心原子Be的价电子数为2,与Cl形成两个成键电子对,分子为直线形;BF3,中心原子B的价电子数为3,与F形成3个成键电子对,分子为平面三角形;CCl4有4个成键电子对,分子为正四面体形;PCl5有5个成键电子对,分子为三角双锥形。
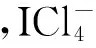
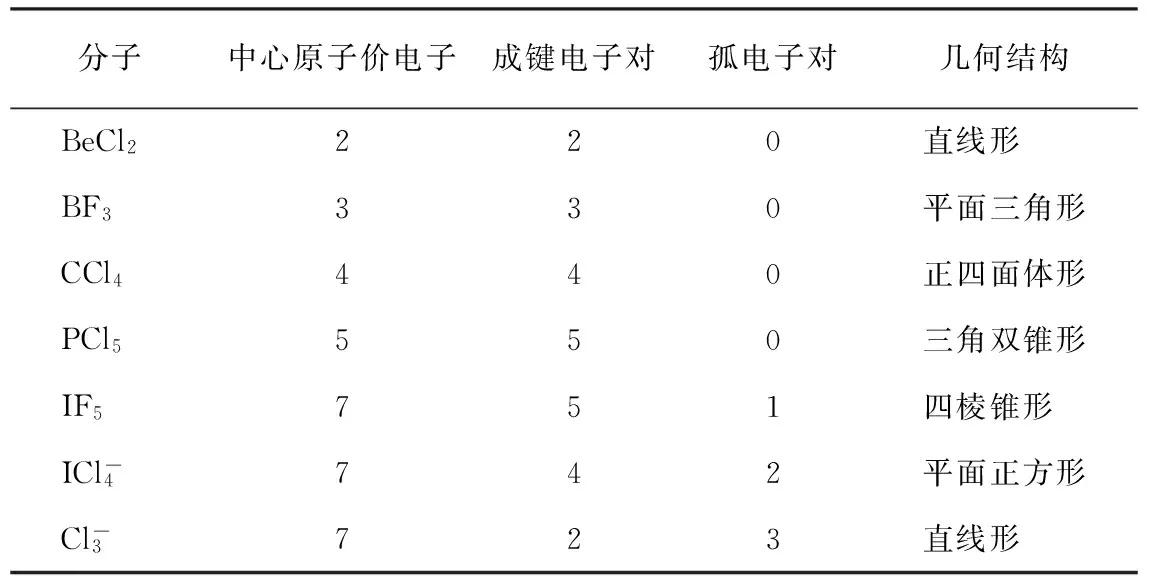
表1 若干分子(或离子)的电子结构与几何结构
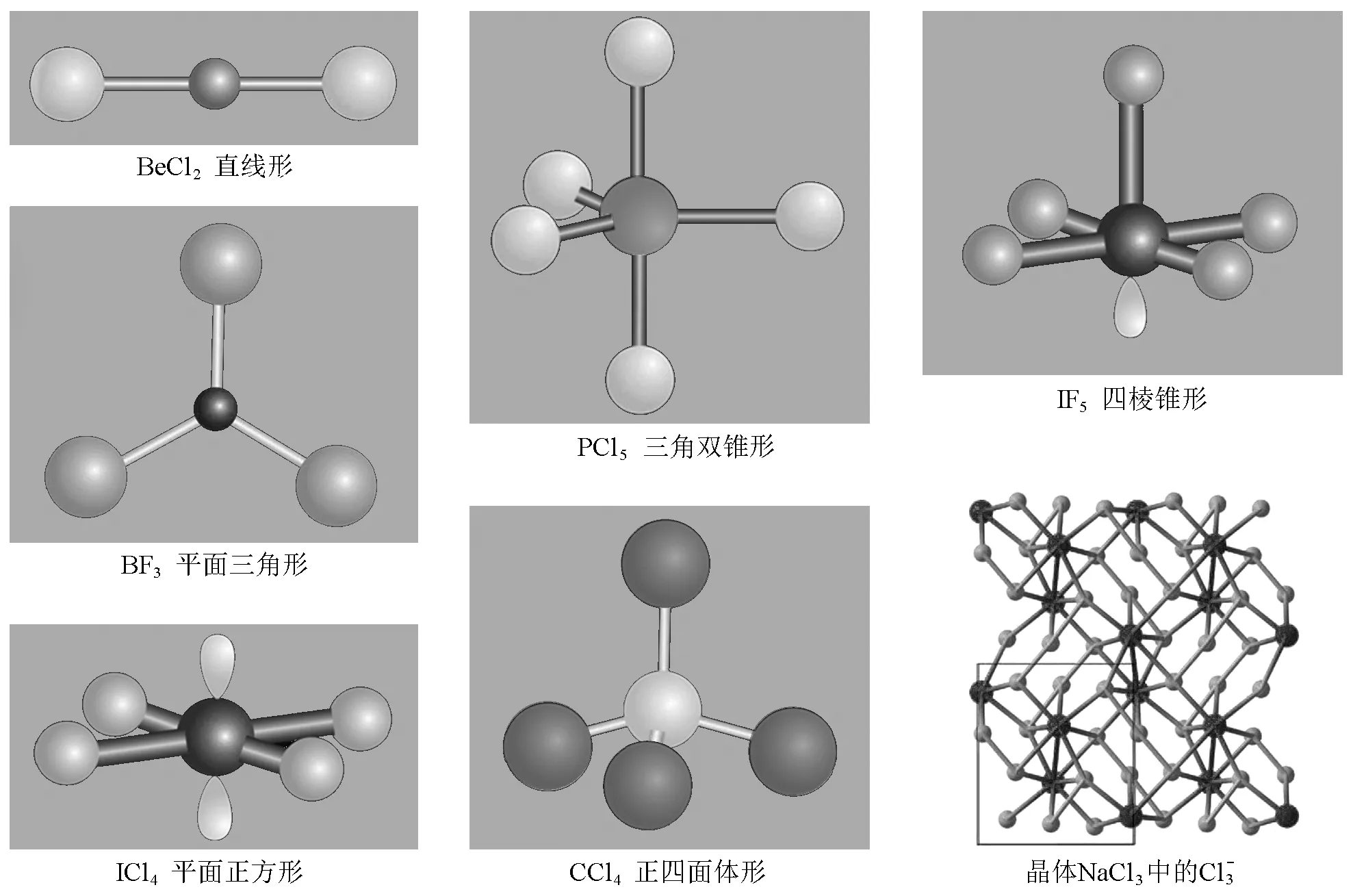
图1 表1中分子(或离子)的结构示意图[1,8]
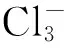
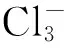
3 VSEPR理论与八电子规则
八电子规则即八隅体规则(octet rule)。1916年,Lewis[9]提出了8电子规则;后来,Langmuir将此规则表述为八隅体规则(octet rule)[10]。
八隅体规则是化学中一个经典而简单的经验规则,对于主族元素特别是碳族元素、氮族元素、氧族元素和卤素元素的化合物,如碳、氮、氧、卤素、钠、镁,由于其价电子构型为s轨道和3个p轨道,各个原子组合成分子时,各电子的价层趋向于都拥有8个电子,与惰性气体拥有相同的电子排列,即满足八隅体规则。
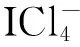
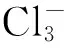
4 结语
在学科发展过程中,有些规则的提出确实抓住了事物或现象的客观规律与某些特征,但同时也往往存在局限性。八隅体规则就是这样的规则,此规则也是学生在学习基础化学时的一个基本规则,因此印象深刻。VSEPR理论是结构化学课程中一个简单而又有效的理论规则,其中不少结构都与八隅体规则不符。本文就新发现的晶体结构,对比了VSEPR理论与八隅体规则中的特殊分子或离子,以期使学生能对这两个规则有更全面的认识,并加深对学科发展规律的理解。
[1] Zhang W W,Artem R O,Alexander F G,etal.Science,2013,342:1502
[2] Sidgwick N V,Powell H M.ProcRoySocA,1940,176:153
[3] Gillespie R J,Nyho lm R S.QuantRevChemSoc,1957,11:339
[4] Gillespie R J.JChemEdu,1963,40:295
[5] Gillespie R J.InorgChem,1966,5(6):1634
[6] Bader R F W,Gillespie R J,MacDougall P J,etal.JAmChemSoc,1988,110(22):7329
[7] 周公度,段连运.结构化学基础.第4版.北京:北京大学出版社,2008
[8] 李炳瑞.结构化学.北京:高等教育出版社,2011
[9] Lewis G N.JAmChemSoc,1916,38(4):762
[10] Langmuir I.Science,1921,54(1386):59
VSEPR Theory and Octet-rule in Structural Chemistry
Lu Huizhe Du Fengpei
(CollegeofScience,ChinaAgriculturalUniversity,Beijing100193,China)
By introducing the exceptions to the octet-rule, VSEPR theory and the related problems about octet-rule were discussed in the Structural Chemistry course, helping students understand the related theory and applications.
Structural chemistry; VSEPR theory; Octet-rule
10.3866/pku.DXHX20150675
O6; G64

